3-甲基腺嘌呤通过抑制自噬促进小鼠毛囊再生的作用研究
2019-08-28罗福玲吴盛旺万敬员赵恒光
李 婧,罗福玲,吴盛旺,万敬员,赵恒光
(1重庆医科大学药学院,重庆400016;2重庆医科大学附属第一医院药学部,重庆400016;3重庆医科大学基础医学院,重庆400016;4重庆医科大学附属第一医院皮肤科,重庆400016)
脱发是临床常见病,发病率逐年上升,严重影响患者容貌和生活质量。临床上休止期脱发的产生,与毛囊休止期的过度延长有关[1],因此,寻找一种可以促进毛囊由休止期向生长转化的药物,是休止期脱发疾病研究的重要方向之一。
自噬是机体吞噬衰老细胞器或大分子物质的一个降解过程,这些物质通过自噬过程在溶酶体中降解为氨基酸、脂肪酸以及核苷酸并可被重复利用,在维持细胞自身的物质平衡和内环境稳态中起重要作用[2]。近年研究发现,自噬紊乱会导致多种疾病,包括脱发,而维持适当稳定的自噬水平则有助于促进毛发再生[3-5]。
拔毛法是目前普遍采用的一种生长期诱导模型,拔毛可诱导功能正常的毛囊快速转化进入生长期,并重新长出新发[6]。
为进一步研究自噬在毛发生长中的作用及机制,本研究采用3-甲基腺嘌呤(3-methyladenine,3-MA)作为自噬通路抑制剂[7],用拔毛法构建毛囊再生的模型,以3~4周龄毛囊处于休止期的C57BL/6小鼠作为拔毛后的毛发再生模型,并以空白处理组和自噬诱导剂雷帕霉素(rapamycin,RAPA)组为阴性对照,观察自噬通路在小鼠毛发再生中的作用,并进一步探讨3-MA通过抑制自噬在哺乳动物毛发再生中的重要意义,为临床进一步研究毛发疾病的治疗手段提供理论基础。
1 材 料
1.1 药品与试剂
苏木精、伊红(美国Amresco公司);免疫组化试剂盒、DAB浓缩试剂(武汉中杉金桥公司);P62抗体、Beclin1抗体(美国CST公司,兔抗);Western blot用兔抗 LC3B抗体(美国 Sigma公司);鼠抗Ki67抗体(美国 GeneTex公司);FITC-CD34、PECD49f(美国 BD公司);鼠抗 β-actin抗体、HRP标记二抗山羊抗兔、HRP标记山羊抗鼠、免疫组化用兔抗LC3B抗体(武汉博士德公司);3-甲基腺嘌呤(3-MA)、雷帕霉素(RAPA)(美国 Selleck公司);其他试剂均为市售分析纯。
1.2 仪 器
Coolpix相机、DS-Fil荧光显微镜(日本 Nikon公司);蛋白质凝胶电泳仪、ChemiDocXRSTM凝胶成像仪(美国Bio-Rad公司)。
1.3 实验动物
健康雄性3~4周龄 C57BL/6小鼠21只,体重(8±1)g,购自重庆医科大学实验动物中心(合格证号0004285),饲养于(23±2℃,12 h明暗交替)独立通气笼盒SPF系统。所有动物均符合动物伦理委员会标准。
2 方 法
2.1 动物分组及处理
所有鼠随机分为3组(n=7),1%戊巴比妥麻醉后,用低熔点石蜡融化后均匀涂抹于小鼠背部,凝固变硬后拔除背部毛发。3-MA组腹腔注射给予3-MA 2 mg/(kg·d);RAPA组腹腔注射给予 RAPA 1 mg/(kg·d),空白组(Vehicle组)拔毛后不予任何处理;拍照记录小鼠拔毛区毛发生长的动态变化。14 d后脱颈处死,取拔毛区全层皮肤组织备用。
2.2 HE染色检测毛囊形态学改变
石蜡切片脱蜡水化,苏木精1~5 min并返蓝,伊红30 s~3 min,双蒸水彻底清洗,脱水透明,中性树胶封片,显微镜采集图像并分析数据。
2.3 Western blot印记法检测皮肤中自噬相关蛋白的表达
组织液氮研磨后,细胞裂解液提取总蛋白并测定含量,SDS-PAGE电泳,80 V电压跑浓缩胶,100 V电压跑分离胶,转PVDF膜,5%BSA(溶于TBST)室温振荡封闭 1 h。鼠抗 β-actin、兔抗LC3B、兔抗 P62、兔抗 Beclin1一抗(1∶1 000)4℃孵育过夜,TBST洗膜,二抗(HRP羊抗鼠、羊抗兔1∶3 000)室温振荡孵育1 h,TBST洗膜,ECL发光液显影,凝胶成像仪采图,Image Lab5.0软件分析灰度值。
2.4 免疫组化检测毛囊中P62、ki67的表达
采用免疫组化SP法。石蜡切片脱蜡水化,柠檬酸修复液(pH 6.0)微波抗原修复,内源性过氧化物酶阻断剂、山羊血清均室温封闭30 min,兔抗兔抗P62、鼠抗Ki67一抗(1∶200)4℃孵育过夜,二抗山羊抗兔、山羊抗鼠室温孵育30 min,辣根酶标记链霉卵白素室温孵育30 min,DAB(1∶20)显色,TBS彻底清洗,苏木精染核返蓝,脱水透明,中性树胶封片,显微镜采集图像并分析数据。
2.5 免疫荧光检测毛囊中CD34、CD49f的表达
冰冻切片复温,5%BSA封闭,FITC-CD34、PECD49f(1∶50)37℃孵育 1 h,DAPI(2μg/mL)室温30 min,封片,荧光显微镜下采集图像并分析数据。
2.6 统计学分析
3 结 果
3.1 3-MA对小鼠背部毛发生长的影响
3~4周龄 C57BL/6小鼠毛囊处于休止期[6],在脱毛后即时观察背部皮肤颜色呈粉红色,拔毛后,拔发部位的皮肤颜色开始逐渐变灰、转黑,预示毛囊开始转入生长期[6]。在拔毛后第 2、5、7、9及14天,记录小鼠拔毛部位的皮肤颜色变化及毛发生长,结果如图1所示,3-MA组鼠无论皮肤颜色变化还是毛发生长均明显快于Vehicle组和RAPA组,而RAPA处理小鼠的背部颜色变化及毛发生长明显慢于3-MA组,甚至明显慢于Vehicle组。在第9天时,3-MA组鼠背部已有明显新毛发生长,Vehicle组鼠背虽为灰色但无毛发生长,而RAPA组鼠背仍为粉色,提示毛囊仍处于休止期。至第14天时,3-MA组和Vehicle组毛发生长已基本正常,RAPA组虽有毛发生长,但毛发数量和质量均明显较对照组差。
3.2 3-MA对鼠毛囊再生影响的形态学观察
第14天时,取鼠背部毛发再生部位的皮肤全层行HE染色显示,发现3-MA组鼠的毛囊生长明显优于 Vehicle组和 RAPA组(图2-A),表现为:(1)新生毛囊的数量与密度均明显多于Vehicle组和RAPA组。每中倍镜视野(×100)下,3-MA组的毛囊单位计数显著增加,与Vehicle组和RAPA组的比较分别为(8.67±1.52)vs(4.67±0.33)和(8.67±1.52)vs(3.33±0.33),P均小于 0.05(图2-B)。(2)形态学上,3-MA组的新生毛囊处于生长期,表现为毛囊长度更长,毛乳头体积更大,下端深达脂肪层下部,并接近肌肉深筋膜层浅面;Vehicle组毛乳头体积偏小,毛乳头下端多数仅位于真皮层中下部及脂肪浅层;而RAPA组甚至比Vehicle组毛乳头更小,毛乳头下端仅位于真皮层中上部。
3.3 3-MA对小鼠皮肤中自噬相关蛋白表达的影响
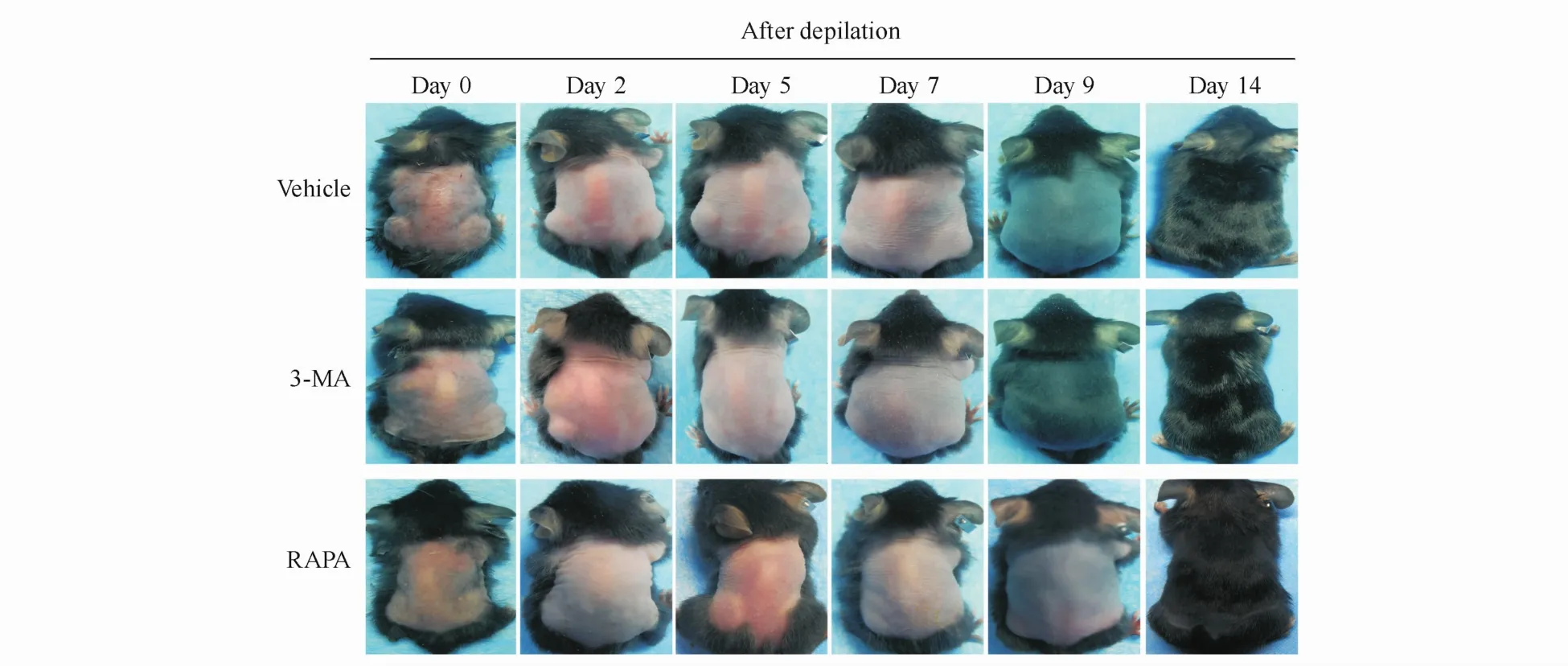
Figure1 Effect of3-methyladenine(3-MA)on dorsal hair regrowth in C57BL/6 mice
为检测3-MA处理后对C57BL/6鼠再生毛囊中自噬通路的影响,本研究利用Western blot法测定小鼠拔毛部位皮肤中自噬相关蛋白表达影响。结果如图3所示,与Vehicle组相比,3-MA组的Beclin1表达、LC3BⅡ/Ⅰ比值均显著降低[分别为(2.72±0.179)vs(4.25±0.084)和(0.28±0.029)vs(0.43±0.069),P均<0.05],总LC3B升高[(16.13±0.213)vs(7.98±0.263)],P62的表达则明显升高[(1.25±0.103)vs(0.82±0.013),P<0.05]。而RAPA组的Beclin1表达、LC3BⅡ/Ⅰ比值显著较Vehicle组升高[分别为(4.86±0.0.067)vs(4.25±0.084)、(0.81±0.032)vs(0.43±0.069),P均 <0.05],总 LC3B升高[(16.95±0.541)vs(7.98±0.263)],P62的表达则明显较 Vehicle组降低[(0.66±0.029)vs(0.82±0.013),P<0.05]。
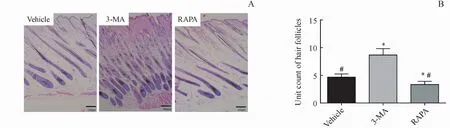
Figure2 (A)Effect of 3-MA on hair follicle regeneration by HE staining(×100)and(B)the quantitative result(±s,n=4)RAPA:Rapamycin.*P<0.05 vs vehicle group;#P<0.05 vs3-MA group
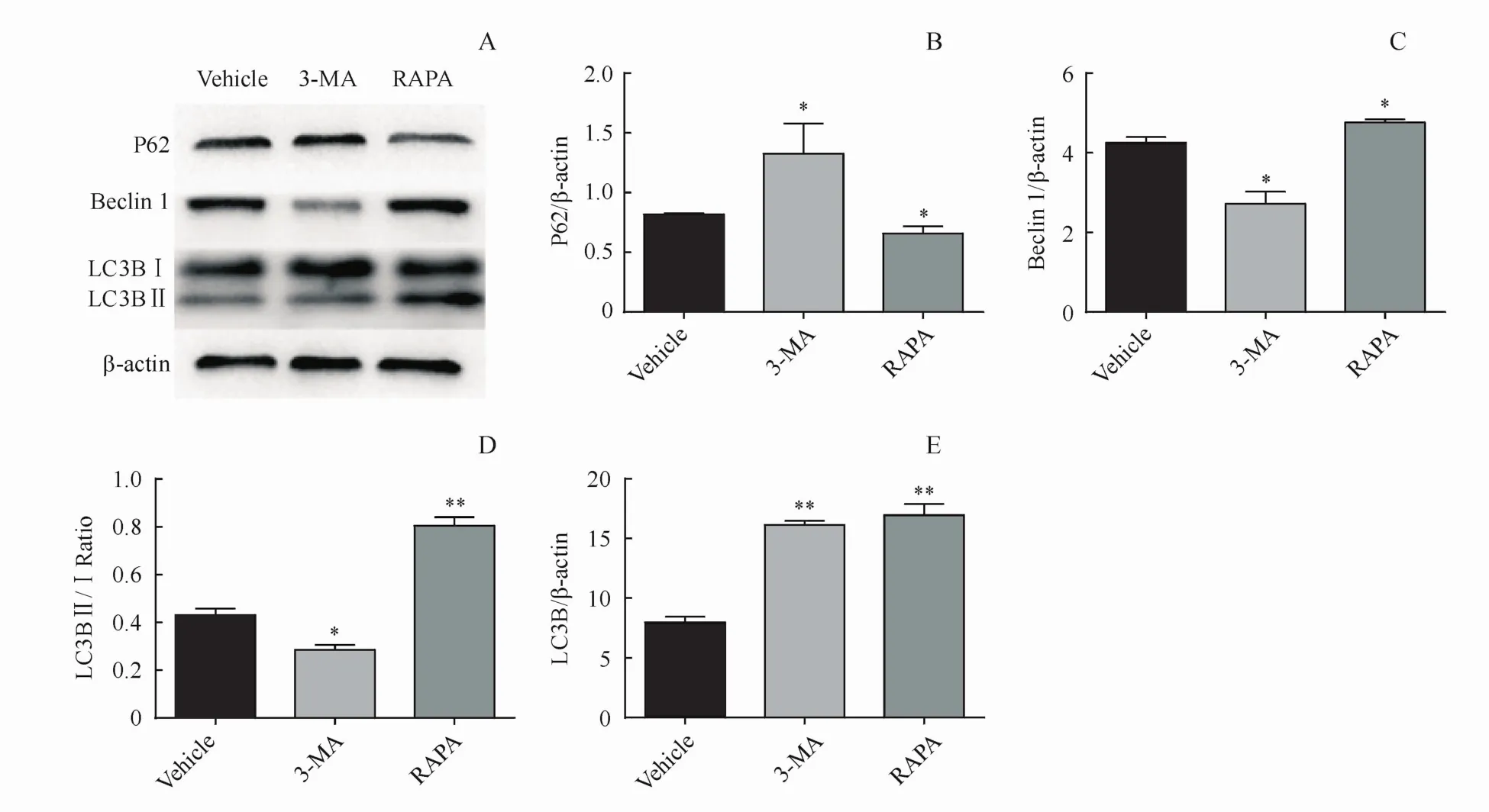
Figure 3 (A)Effect of 3-MA on expressions of Beclin1,P62,LC3BII/Ⅰand LC3B in dorsal skin by Western blot and(B E)the quantitative result(x¯±s,n=3)*P<0.05,**P<0.01 vs vehicle group
但由于以上结果中,Western blot方法检测的只是小鼠拔毛部位皮肤全层的蛋白变化,为进一步明确该变化是否发生于再生的毛囊结构中,本研究采用免疫组化染色特异性标记再生的毛囊结构中的以上蛋白,证实变化结果同上,即在3-MA处理后,在特定的毛囊结构中,LC3B总量明显升高(3-MA主要通过抑制胞浆型LC3BⅠ型向膜型LC3BⅡ型的转化,导致LC3BⅠ型堆积[8],LC3B总量增加),P62表达升高;而在RAPA处理后,LC3B总量升高的同时(RAPA诱导LC3BⅠ型向LC3BⅡ型的转化,LC3BⅡ型表达增强),P62表达明显降低(图4),表明上述的经Western blot检测的自噬变化结果同样发生于毛囊局部结构中。
3.4 3-MA对新生毛囊上皮细胞中Ki67表达的影响
为进一步明确3-MA导致的自噬变化对毛囊上皮细胞增殖分化的影响,本研究采用免疫组化染色检测毛囊上皮细胞中细胞增殖标记Ki67的表达,结果如图5所示。3-MA处理后毛囊上皮细胞在自噬通路发生明显抑制的同时,Ki67的表达明显增加,表明细胞的增殖分裂能力明显加强;而经RAPA处理后的结果却恰好相反。
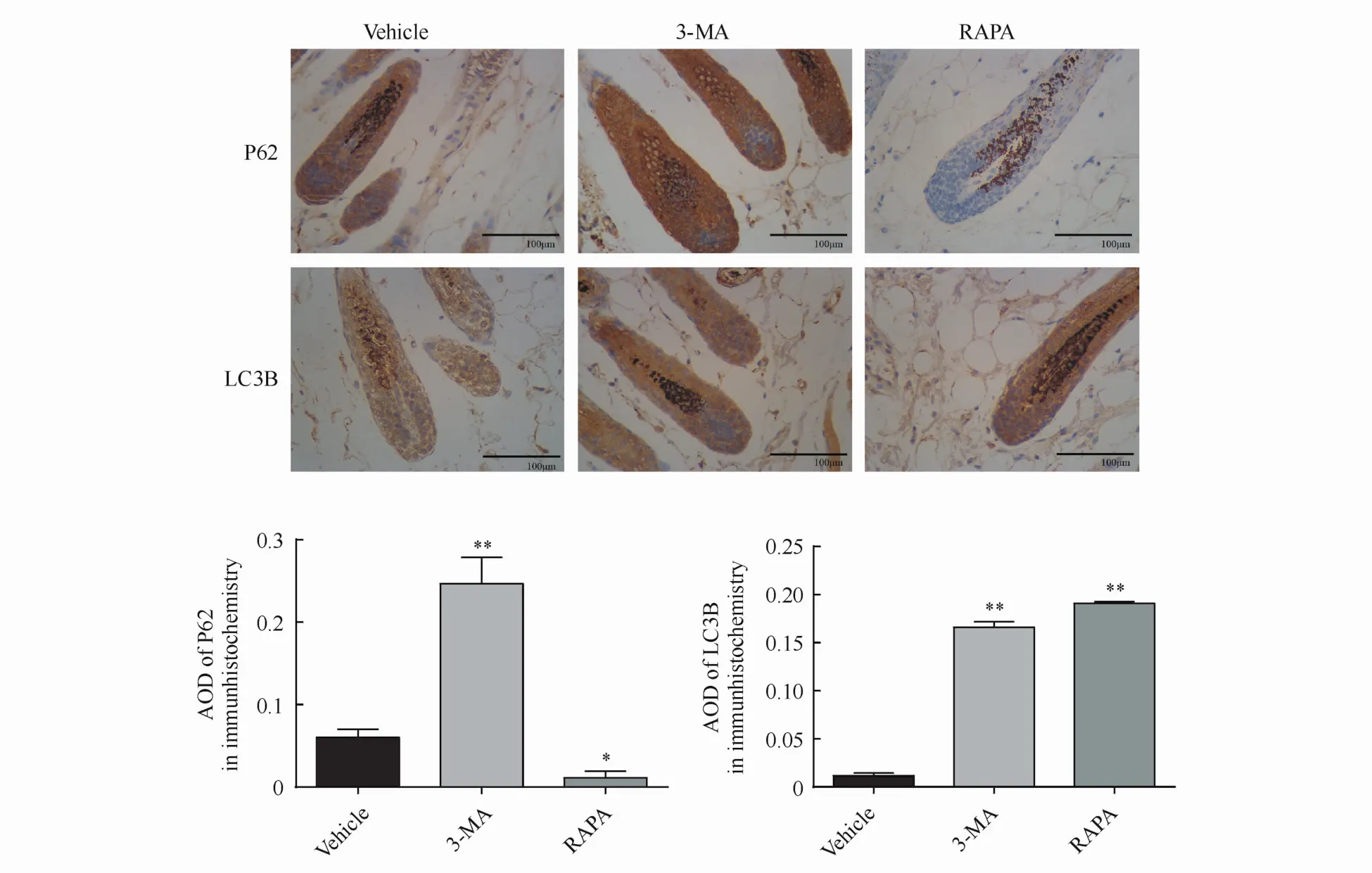
Figure 4 Effect of3-MA on expressions of P62 and LC3B in hair follicle cells by immunohistochemistry(×400)(±s,n=3)*P<0.05,**P<0.01 vs vehicle group
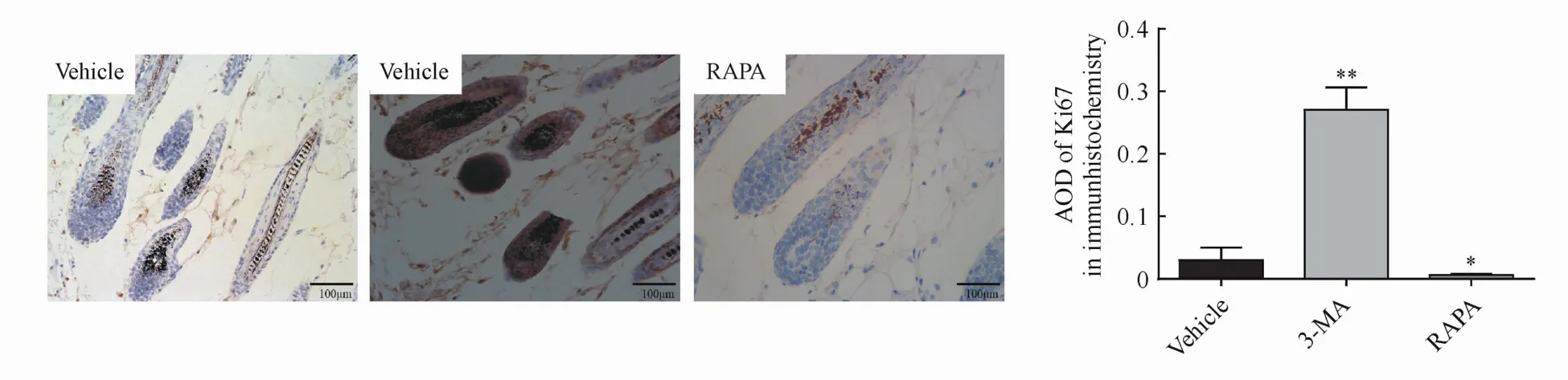
Figure 5 Effect of3-MA on expressions of Ki67 in hair follicle cells by IHC(×200)(±s,n=3)*P<0.05,**P<0.001 vs vehicle group
3.5 3-MA对小鼠毛囊中CD34、CD49f表达的影响
为进一步探讨3-MA对鼠毛发再生的影响是否与对毛囊干细胞的作用有关,本研究采用CD34和CD49f双标记染色以显示毛囊干细胞[9-10]。结果如图6所示,CD34和CD49f双标阳性细胞主要位于毛囊隆突部,在3-MA处理后双标阳性细胞的染色强度明显高于Vehicle组,而RAPA组则明显低于Vehicle组,表明经3-MA处理后,毛囊干细胞的数目增多,细胞增殖活跃,RAPA则可能抑制了毛囊干细胞的增殖分化过程。
4 讨 论
哺乳动物毛囊是一种具有自我再生能力的特殊器官,在出生后第一次毛囊形态学发生完成后,就依次进入退行期、休止期和生长期的不断循环。如果该正常循环周期一旦被破坏,则会发生各种毛发疾病,如临床休止期脱发的发生就与毛囊长期停滞于休止期有关,而如果能快速有效地促进毛囊由休止期重新转入生长期,则有助于对休止期脱发的临床治疗。
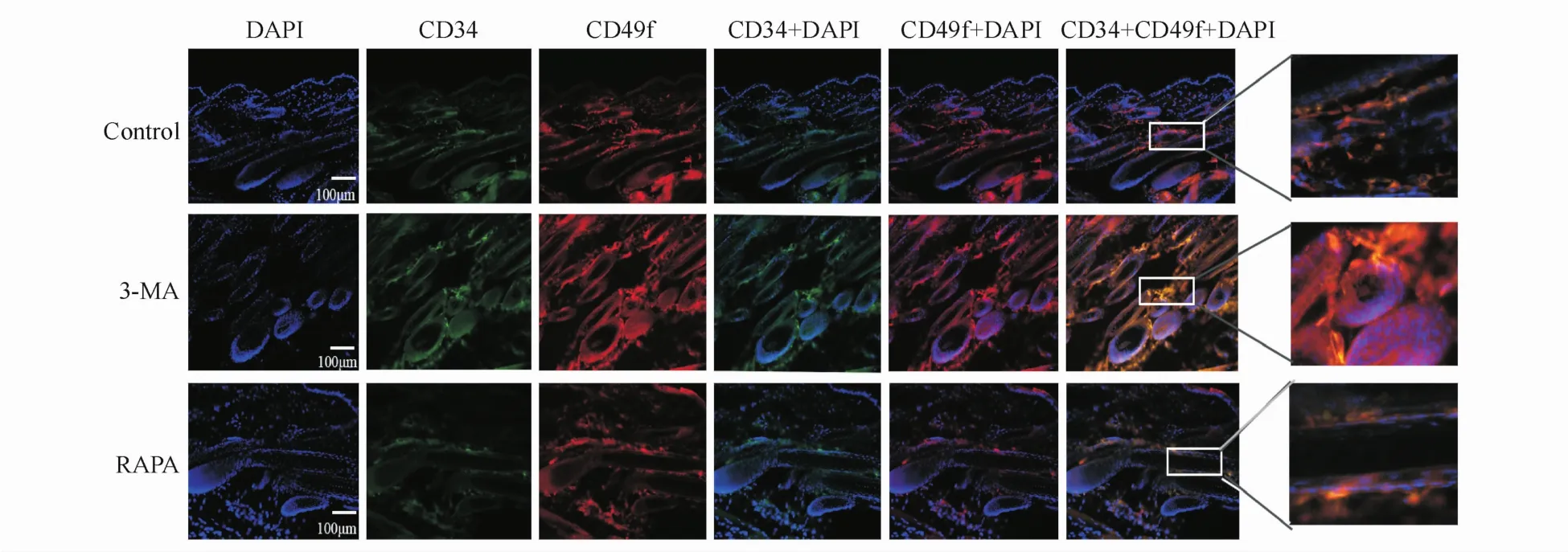
Figure 6 Effect of3-MA on expressions of CD34,CD49f in hair follicle by immunofluorescence(×200)
自噬是机体维持内环境稳态的一种重要机制,恰当的自噬水平有助及时清除衰老无用的细胞内物质,维持内环境的稳定;但过度亢进的自噬又可能导致对细胞内容物的过度清除,从而抑制细胞的功能[11-13]。毛囊作为一种快速更新的器官,维持恰当的自噬水平尤为重要。如研究发现,Mnd2鼠在转染HtrA2/Omi基因后,细胞会出现过度自噬导致鼠的休止期脱发、体重减轻[14]。Wang等[15]采用自噬抑制剂Tempol和RP67580抑制毛囊细胞中LC3BⅡ的表达,可以重建毛囊周期循环,而活性氧簇(ROS)和P物质则通过诱导毛囊细胞中自噬相关蛋白的表达,使毛囊处于休止期而不能向生长期转化;在移植自噬相关基因Atg7缺失小鼠的皮肤至SCID小鼠后,毛乳头的生成反而增加[16];相反,自噬诱导剂RAPA可增强毛囊细胞的自噬,从而延长C57BL/6小鼠从休止期进入生长期的时间[17]。本研究发现,自噬在毛囊周期的调节中的确发挥着重要作用。同时还发现在给予自噬抑制剂3-MA刺激后,毛囊上皮细胞内的Beclin1表达、LC3BⅡ/Ⅰ比值均显著降低,P62表达明显升高,鼠毛囊的再生明显被促进,毛囊上皮细胞中Ki67表达增加,毛囊干细胞的增殖分化加速,鼠再生部位的皮肤颜色改变及新发生成明显加强,而给予RAPA后,Beclin1表达、LC3BⅡ/Ⅰ比值显著升高,P62表达明显降低,Ki67表达减少,毛囊干细胞的增殖减慢,毛囊从休止期入生长期的时间反而延长,且新生毛发的质与量均有下降。证明通过抑制自噬可以促进小鼠的毛囊从休止期向生长期的转化,而诱导自噬可能导致休止期的持续延长。
综上所述,本研究提示自噬是毛囊上皮细胞的一种重要的周期循环调节机制,自噬的异常可能是毛囊发生休止期延迟或停滞的原因之一,而通过适当地调节休止期毛囊的自噬异常,则有助于促进毛囊从休止期向生长期的快速转化,促进休止期毛发的再生。使用自噬抑制剂3-MA或其相关的自噬抑制剂则有望在人类休止期脱发疾病的治疗中发挥重要作用,具有深入研究的前景与价值。
