MRI对比剂Gd-DO3A-Ether-Rhein的合成及其坏死亲和性研究
2019-08-28张立邦张东建金乔梅吴天泽殷志琦
张立邦,张东建,高 萌,金乔梅,吴天泽,杨 阳,张 健*,殷志琦
(1中国药科大学中药学院中药制剂系&天然药物活性组分与药效国家重点实验室,南京210009;2江苏省中医药研究院转化医学实验室,南京210028;3南京中医药大学附属中西医结合医院 南京210028)
坏死是一种由于急性物理化学损伤或突然的代谢失败(如机械损伤、感染、毒素和缺血)导致的细胞不可逆损伤的死亡形式[1-2]。细胞坏死发生于多种疾病中,如肿瘤、心肌梗死和脑卒中等[3-4]。同时,一些肿瘤治疗方法,如热消融、血管阻断剂等,主要通过诱导肿瘤细胞坏死达到杀伤肿瘤的目的[5-6]。因此,非侵入性成像坏死组织对相关疾病的早期诊断、治疗效果评价及治疗方案的调整具有重要的意义[7-8]。
坏死亲和性探针是一类能够特异性浓聚于坏死组织,从而对坏死组织进行可视化的化合物。本课题组前期研究发现单蒽醌类化合物具有良好的坏死亲和性和血浆药代动力学性质[9],其中大黄酸(rhein)是一种有潜力的先导化合物。基于大黄酸构建的单光子发射计算机断层显像(SPECT)探针99mTc-HYNIC-Rhein,在心肌坏死的快速成像和肿瘤治疗反应早期监测方面显示出良好的应用潜力[10-11],但是 SPECT成像空间分辨率较低,难以准确评估坏死的边界。
磁共振成像(MRI)是临床常用的成像手段,该技术具有时空分辨率高且没有辐射的优点。因此,本课题组构建了基于大黄酸的不同长度烷烃链连接臂的 MRI对比剂 Gd-DO3A-Linker-Rhein(GdL1-3),实验结果表明三者的弛豫率及水溶性表现出较大的差异,这说明连接臂的差异会对造影剂本身的理化性质产生影响。同时,该研究发现GdL1能够在给药后3 h对CA4P治疗导致的大鼠皮下W256肿瘤坏死区域进行成像[12],GdL3具有良好的成像坏死组织的潜力[13]。MRI技术灵敏度较低,需要大量的对比剂才能显像,因此需要MRI对比剂具有良好的水溶性,但是GdL3的油水分配系数为-(0.71±0.01),其水溶性有待提高;另一方面,连接臂的差异会对造影剂的理化性质产生影响[12,14],上述 MRI对比剂仅以烷烃链为连接臂构建探针,因此更换不同种类的连接臂进行更深入的研究,可能得到水溶性更好且保留坏死亲和性的以大黄酸为基础的MRI对比剂。
近年来,醚链(ether)被广泛用于放射性探针的结构修饰中以改善药物的某些理化性质和药代动力学特性[14-16],因此本研究以大黄酸为基础,以较短的醚链(乙氧基乙基)为连接臂构建坏死亲和性 MRI对比剂 Gd-DO3A-Ether-Rhein(GdE1),考察其水溶性和弛豫率的改变、体内外的坏死靶向性及MRI成像效果。
1 材 料
1.1 药品与试剂
大黄酸(rhein,成都思天德生物有限公司);苯并三氮唑-N,N,N′,N′-四甲基脲六氟磷酸盐(HBTU)、2-琥珀酰亚胺基-1,1,3,3-四甲基脲四氟硼酸酯(TSTU)(上海毕得医药科技有限公司)、N-乙基二异丙胺(DIPEA)、三氟乙酸(TFA);[2-(2-氨基乙氧基)乙基]氨基甲酸叔丁酯(上海毕得医药科技有限公司);1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸三叔丁基酯[DOTA-tris(t-Bu)ester,美国 Macrocyclics公司];其他试剂均为市售分析纯。
1.2 仪 器
Echo speed Plus 1.5 T磁共振仪(美国GE公司);AW 4.3后处理工作站;NM120核磁共振造影剂弛豫分析与成像系统(苏州纽迈分析仪器股份有限公司);Shandon冰冻切片(英国Thermo Fisher Scientific公司);全波长多功能酶标仪(美国赛默飞世尔科技有限公司)。
1.3 细胞与动物
人肝癌HepG2细胞株和人正常肝IO2细胞株购自上海细胞库;雄性SD大鼠,体重(220±10)g,购买自上海斯莱克实验动物有限责任公司,合格证号:SCXK(沪)2017-0005。研究中大鼠的护理符合美国国立卫生研究院公布的《实验动物保健原则》No.85-23(1996年修订),该项研究得到动物使用委员会和保健机构的批准。
2 方 法
2.1 10-{[6-(1,8-二羟基蒽醌-3-甲酰氨基)乙氧基乙基]氨基}羰酰甲基-1,4,7,10-四氮杂环十二烷-1,4,7-三乙酸合钆(Gd-DO3A-Ether-Rhein,即GdE1)的合成
2.1.1 化合物1的合成 在500 mL圆底烧瓶中加入大黄酸1.24 g(4.36 mmol)和130 mL乙腈,缓慢滴加[2-(2-氨基乙氧基)乙基]氨基甲酸叔丁酯863μL(4.36 mmol),再加入2-琥珀酰亚胺基-1,1,3,3-四甲基脲四氟硼酸酯(TSTU)1.45 g(4.82 mmol),并滴加N-乙基二异丙胺(DIPEA)2 mL(11.5 mmol)至反应液,室温搅拌 24 h,旋转蒸发除掉溶剂,经过硅胶柱纯化(二氯甲烷-甲醇,70∶1)得到黄色固体化合物1(1.08 g,52.43%)。
2.1.2 化合物2的合成 在50 mL圆底烧瓶中依次加入化合物 1 800 mg(1.70 mmol)、三氟乙酸1 mL和二氯甲烷10 mL,室温条件下反应6 h,旋转蒸发除掉溶剂,加入无水乙醚10 mL,抽滤,滤饼经45℃真空干燥得到黄色滤饼化合物2粗产物,粗产物不进行纯化。
2.1.3 化合物3的合成 称取苯并三氮唑-N,N,N′,N′-四甲基脲六氟磷酸盐(HBTU)631 mg(1.66 mmol)、1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸三叔丁基酯866 mg(1.51 mmol)于50 mL圆底烧瓶中,加入DMF 5 mL室温搅拌溶解,滴加N-乙基二异丙胺(DIPEA)527μL(3.0 mmol),室温搅拌5~10 min后,将化合物 2粗品(560 mg,1.51 mmol)的DMF(5 mL)溶液滴加到上述反应液中,室温搅拌12 h,反应结束后,减压除去溶剂,得到褐色油状产物化合物3,不进行纯化,直接进行下一步反应。
2.1.4 配体 10-{[6-(1,8-二羟基蒽醌-3-甲酰氨基)乙氧基乙基]氨基}羰酰甲基-1,4,7,10-四氮杂环十二烷-1,4,7-三乙酸(DO3A-Ether-Rhein,即 E1)的合成 将上述褐色油状产物化合物3置于250 mL茄型瓶中,分别加入二氯甲烷9mL和三氟乙酸3 mL,室温条件下反应6 h,旋转蒸发除掉溶剂得到粗产物,粗产物经过反相色谱柱纯化(流动相为甲醇-水,60∶40)得到黄色固体 DO3A-Ether-Rhein(E1)(865.1 mg,74.82%,该产率由“2.1.2”中化合物1投料量计算得到)。
2.1.5 Gd-DO3A-Ether-Rhein(GdE1)的合成 将六水合氯化钆250 mg(0.67 mmol)和 E1 500 mg(0.66 mmol)溶于去离子水 10 mL中,用 1 mol/L氢氧化钠调节pH至近中性,室温搅拌12 h后停止反应,减压除去溶剂,所得产物经反相色谱柱纯化(流动相为甲醇-水,80∶20)得到黄色固体 Gd-DO3A-Ether-Rhein(GdE1)(468.2 mg,77.79%)。
2.2 弛豫率测定及体外磁共振成像
参考文献[13]的方法,以 PBS(pH 7.4)为溶剂,将 GdE1配制成 5个浓度(0.125,0.25,0.5,1.0,2.0 mmol/L)的样品,分别检测5个样品对应的纵向弛豫时间t,以浓度为横坐标、1/t为纵坐标拟合直线,得到直线的斜率即为r1,利用 NM120(0.5 T)核磁共振造影剂弛豫分析与成像系统对上述5个样品进行成像,设置参数:重复时间160ms,层厚0.7 mm,回波时间13.5 ms。Gd-DOTA弛豫率的检测方法与GdE1相同。
2.3 油水分配系数(lgP)的测定
采用摇瓶法进行测量[17],以pH 7.4正辛醇饱和的PBS为溶剂将GdE1配制成不同浓度的样品,从不同浓度的样品中各量取3 mL分别在435 nm下测量吸收度,标记为A0。测量A0后,再分别加入PBS饱和的正辛醇溶液3 mL,在室温下剧烈涡旋15 min,然后在14 000 r/min条件下离心5 min,测量PBS层吸收度,标记为A1,根据公式lgP=lg[(A0-A1)/A1]计算油水分配系数(lgP),每个药物测量3次。

Scheme 1 Synthesis of Gd-DO3A-Ether-Rhein(GdE1)
2.4 细胞毒性实验
分别取人肝癌HepG2细胞和人正常肝IO2细胞进行消化传代,在96孔板中接种细胞(1×104个/孔),等细胞出现贴壁现象,吸走培养基,加入无血清组织的的DMEM培养细胞8 h,分别加入12.5,25,50,100,200μmol/L的 GdE1,空白组(Control)加入无血清的 DMEM,孵育细胞24 h,吸走培养基,每孔加入 MTT 20μL(5 mg/mL),孵育细胞4 h,将上清液除去,每孔加入DMSO 150μL,在490 nm处用酶标仪测定吸收度,计算细胞活力,实验按照相同的方法进行3次。Gd-DOTA的细胞毒检测方法与GdE1相同。
2.5 细胞体外磁共振成像实验
在6孔细胞培养板上加入人肝癌HepG2细胞,每孔5×105个,在含有10%胎牛血清的RPMI-1640培养基中培养,在培养箱中过夜(37℃,5%CO2)。
在57℃条件下孵育1 h诱导细胞坏死[18],将经高热处理的细胞与未经高热处理的细胞分别取出,离心后将上清液除去,分别加入不含血清的培养基100μL和 GdE1(3×10-3mmol/L)100μL,振荡混匀后在细胞培养箱中孵育30 min,接下来离心10 min(1 000 r/min),吸走上清液,用 PBS洗涤1次,再加入干净的PBS充分混匀,放在样品瓶中进行磁共振成像。
2.6 大鼠肌肉坏死模型的制备
微波消融是一种常见的诱导组织坏死的手段,根据文献方法[19],本次实验选取6只220~240 g大鼠,腹腔注射戊巴比妥钠(40 mg/kg)麻醉,将微波消融针插入大鼠左腿的肌肉中,30 W维持20 s引发大腿肌肉坏死,为避免感染,在每只大鼠的肌肉内注射了1.6×105IU的青霉素。
2.7 肌肉坏死模型大鼠的MR成像及数据处理
将肌肉坏死模型大鼠分为两组:对照组(Gd-DOTA)3只,给药组(GdE1)3只。起初采用T1WI和T2WI扫描6只大鼠的腿部,两组均按照0.1 mmol/kg的浓度给药,给药后进行 CET1WI扫描,扫描后利用GE AW4.3工作站处理数据。参数设置为[13]:T1W SE序列:TE 24 ms,TR 550 ms;CE-T1W SE序列:TE 60 ms,TR 550 ms;T2W FSE序列:TE 88 ms,TR 2920 ms。间隔0.2 mm,层厚3mm,FOV 100×100 cm2,NEX 2次,矩阵224×192。
在相同截面同一位置的肌肉MRI图像上挑选感兴趣区域(ROI),对该区域不同时间点的信号值(SI)进行测量,根据公式 CR=SInecrosis/SInormal计算坏死肌肉与正常肌肉的对比度(CR),分别计算给药后各时间点的CR。
2.8 大体切片及HE染色
在MRI扫描结束前6 h每组取1只大鼠尾静脉注射0.05%伊文思蓝溶液0.4 mL,扫描结束后将给予伊文思蓝的大鼠进行安乐死,使其平躺固定在大鼠纸板上,置于-20℃冰箱冰冻8 h,随后在大体切片机上进行切片,当切到与MRI图像对应的层面时用数码相机进行拍照。
在上述冷冻大鼠体内取出部分相关肌肉组织,用冰冻切片机切成10μm薄片,将薄片进行HE染色,染色后用数码相机进行拍照,最后在显微镜下观察肌肉细胞的形态。
2.9 数据的统计学分析
3 结 果
3.1 配体E1的结构鉴定
通过1H NMR、13C NMR、ESI-MS鉴定其结构。1H NMR(300 MHz,DMSO-d6)δ:11.80(2H,s,-OH),8.99(s,1H,-NH),8.50(s,1H,-NH),7.85~7.72(m,4H,Ar-H),7.40(d,1 H,J=9.0 Hz,Ar-H),3.92(m,2H,CH2-O),3.81(m,2H,-OCH2),3.61~2.81(m,12H,6×CH2),1.42~1.24(m,16H,8×CH2)。13C NMR(75 MHz,DMSO-d6) δ:191.35,171.37,164.19,161.23,141.54,137.51,124.52,122.42,119.38,117.55,68.40,54.84,54.00,53.10,50.52,48.77,39.23,38.78。分子式:C35H44N6O13。ESI-MSm/z:757.3[M+H]+。
3.2 GdE1的弛豫测定及体外成像
图1-A呈现了不同浓度的GdE1以及Gd-DOTA的成像图,从左到右浓度逐渐增加,由此可知在0~2 mmol/L浓度范围内,随着造影剂的浓度的增加,信号逐渐增强。从图1-B可以看出GdE1在PBS中的r1(5.45,R2>0.99)显著高于临床上常用的磁共振对比剂Gd-DOTA(4.08,R2>0.99)。
3.3 油水分配系数(lg P)的测定
测得GdE1的lgP为-(1.66±0.09)。
3.4 细胞毒性实验
图2-A可以看出在12.5~200μmol/L浓度范围内,GdE1组和Gd-DOTA组的HepG2细胞存活率均与空白组没有显著性差异(P>0.05),说明在此浓度范围内GdE1和Gd-DOTA对人肝癌HepG2细胞没有毒性。图2-B中可以看出,在12.5~25μmol/L浓度范围内,GdE1组和 Gd-DOTA组的IO2细胞存活率均与空白组没有显著性差异(P>0.05),说明在低浓度范围内 GdE1和Gd-DOTA对人正常肝IO2细胞没有毒性。但是在 50~200μmol/L浓度范围内,GdE1组的IO2细胞存活率均与空白组相比具有显著性差异(P<0.05);在 100~200μmol/L浓度范围内,Gd-DOTA组的细胞存活率与空白组相比具有显著性差异(P<0.05)。因此,相比于肝癌细胞,GdE1与Gd-DOTA在正常肝细胞中的安全性较低。
3.5 体外细胞成像实验
图3显示,在与GdE1共同孵育30 min以后,坏死细胞的亮度明显比活细胞的亮度高,同时坏死细胞的信号强度(4 369±70)显著高于活细胞(2 555±84)(P<0.05),这些现象表明 GdE1能够被坏死细胞特异性摄取。

Figure 1 Relaxation measurement and images of GdE1(upper panels)and Gd-DOTA(lower panels)in PBS(pH 7.4)with different conditions(0.125,0.25,0.5,1.0,2.0 mmol/L)A:Images ofGdE1 and Gd-DOTA;B:Relaxivity of GdE1 and Gd-DOTA
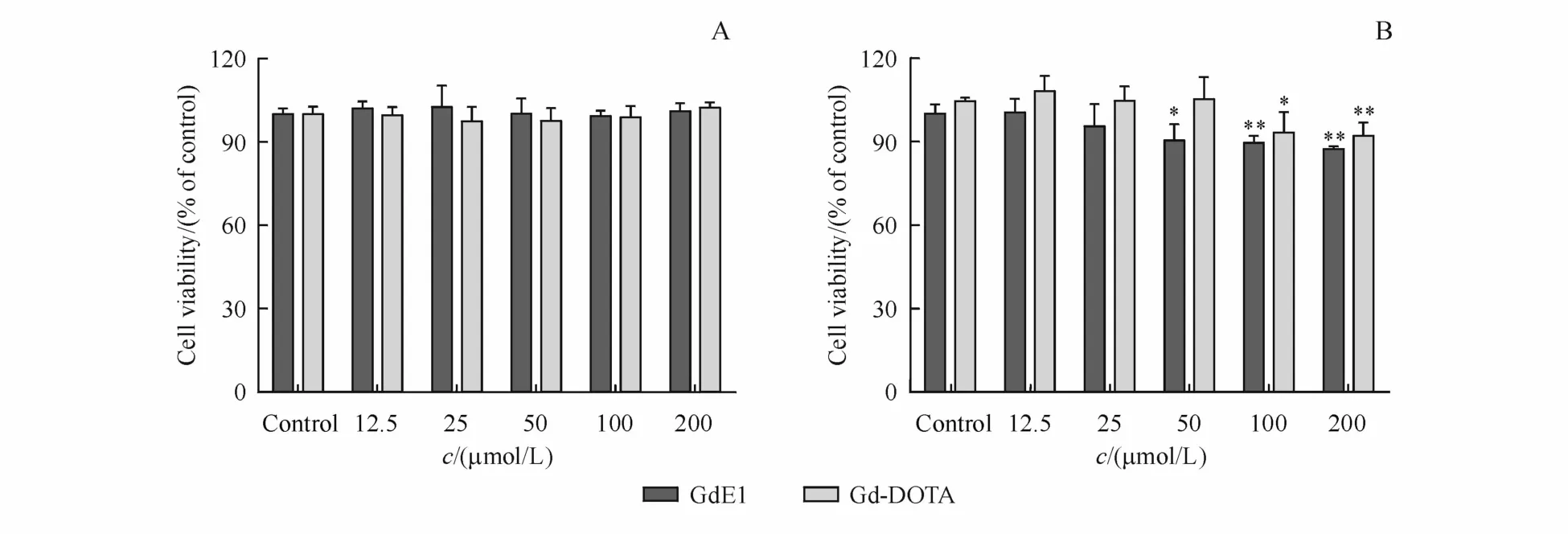
Figure 2 MTT assay of GdE1 and Gd-DOTA with different conditions(0,12.5,25,50,100,200μmol/L)A:MTT in the human hepatocellular carcinoma HepG2 cells(±s,n=3);B:MTT in the human normal hepatic IO2 cells(±s,n=4)*P<0.05,**P<0.01 vs control group
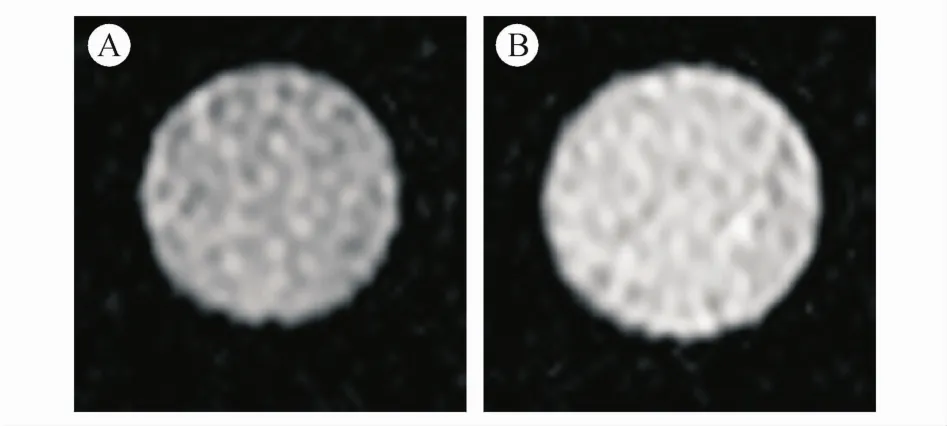
Figure 3 MR images of the human hepatocellular carcinoma HepG2 cellsA:HepG2 treated with GdE1 for 30 min;B:HepG2 heated in 57°C for 1 h and then treated with GdE1 for 30 min
3.6 大鼠肌肉坏死成像、大体切片及组织化学染色结果
如图4-A所示,GdE1组在给药后1 h,坏死肌肉信号强度明显高于正常肌肉,但坏死组织的边界有些模糊;等到了给药后3 h,坏死肌肉与正常肌肉信号的坏死比(CR)达到2.00±0.12(图4-B),显著高于给药后0 h(1.27±0.03)(P<0.05),且坏死区域边界十分清晰;给药后3~9 h,CR逐渐下降,且给药后3~5 h内CR大于1.71,在这个时间范围内依然能够清楚区分坏死组织与正常组织,但给药9 h后CR降低至1.37±0.23(图4-B),此时坏死肌肉区域的信号强度已经与正常肌肉相差无几;图4-A中GdE1组最右边一列大体切片图像表明成功制造了坏死肌肉模型,伊文思蓝能够与体内坏死组织特异性结合,并将坏死组织染成蓝色,图片中蓝色区域为肌肉坏死部位。
图4-A中,Gd-DOTA组最右边一列表明肌肉坏死模型的成功制造,蓝色区域为肌肉坏死部位,但在给药后1~9 h并没有观察到肌肉坏死区域有明显的信号增强;图4-B表明,Gd-DOTA组的CR在给药后0 h达到最高为1.23±0.02,而在给药后1~9 h坏死比相差不大(CR都接近于1.00),可能是由于Gd-DOTA在体内代谢很快,在给药后1 h内已经完全从坏死组织中清除,失去了对坏死组织的成像能力。
图4-C的HE染色结果在组织化学层面证明了模型的成功,正常肌肉区域细胞排列紧密,细胞完整性较好,而坏死肌肉区域细胞的完整性遭到破坏且排列顺序混乱。
以上结果表明,GdE1能够被坏死肌肉特异性摄取,且停留时间较长,能够在给药后3~5 h对坏死区域进行成像;而Gd-DOTA则在给药后1 h内快速从坏死组织中清除,这进一步说明了GdE1具有坏死亲和性。
4 讨 论
本研究以大黄酸为底物,以较短的醚链(乙氧基乙基)为连接臂构建了MRI对比剂Gd-DO3A-E-ther-Rhein(GdE1)。研究结果表明,GdE1水溶性良好且弛豫率较高,在体内外均表现出良好的坏死靶向性,能够通过MRI成像微波消融诱导的大鼠肌肉坏死部位,在坏死相关疾病的诊断中表现出良好的应用潜力。
与之前报道的以烷烃链为连接臂的探针GdL1-3相比,GdE1的理化性质显著发生改变。为提高磁共振对比剂水溶性,可以在分子结构中引入极性基团,有报道在疏水性基团与Gd-DTPA之间引入亲水性基团磷酸二酯能够降低化合物的疏水性[20]。本研究中 GdE1(lgP=-1.66±0.09)水溶性高于以烷烃链为连接臂的GdL2(lgP=-1.32±0.01)和 GdL3(lgP=-0.71±0.01),说明分子结构中引入亲水性的醚链能够提高分子探针的水溶性;此外,之前的研究中,以乙基为连接臂的GdL1(lgP=-2.15±0.01)水溶性最好,以丁基为连接臂的GdL2次之,以己基为连接臂的GdL3最差[12],而新构建的GdE1水溶性低于GdL1,可能是因为连接臂长度越短分子的水溶性越好。弛豫率方面,GdE1(r1=5.45)显著低于 GdL1-3(r1分别为 7.28,7.35和8.03),可能是因为将烷烃链替换为醚链增加了顺磁性螯合物整体的旋转扩散速率[20],或者醚链在水中没有完全伸展导致水分子与Gd3+的接触减少[21],这些因素都会导致弛豫率的降低,具体的原因还有待深入的研究。
与之前以烷烃链为连接臂的探针GdL1和GdL3相比,GdE1在坏死组织中的保留时间明显减少。GdL1能够在给药后3~12 h对坏死肝脏进行MRI成像,该时段内的 CR均大于1.95±0.15[12];此外,GdL3在给药后12 h坏死与正常肝脏的CR为2.36±0.20[13],依然维持在较高水平,这表明两者在坏死组织中有很长的保留时间。本研究中,GdE1成像时间窗仅为给药后3~5 h,可见将分子结构中的烷烃链替换为醚链会导致造影剂在坏死组织中被较快清除。之前的研究表明,以大黄酸为基础构建的造影剂的坏死亲和性可能是由于分子与坏死组织中暴露的DNA结合所致[11-12],因此,GdE1在坏死组织中保留时间的减少可能是因为分子与坏死组织中的DNA结合能力下降,目前GdE1与DNA的体外结合实验正在进行中。
本研究表明,对于 Gd-DO3A-Linker-Rhein探针,更换连接臂种类会改变分子探针的理化性质及其在坏死组织中的保留时间,后续可以将哌啶或甘氨酸链[14]作为连接臂继续研究。此外,本研究仅在细胞和肌肉坏死模型中评价了GdE1的坏死靶向性,今后可以在心肌梗死模型[11]、肝脏缺血再灌注模型或药物诱导的肿瘤坏死模型[22]中进一步评价该探针的坏死亲和性。
