毛冬青三萜C-28位氧化修饰相关CYP450基因的发掘和功能鉴定
2019-08-28陈媛媛赖美红贠小芸
陈媛媛,赖美红,贠小芸,王 魁,徐 晖
(广州中医药大学中药资源科学与工程研究中心,岭南中药资源教育部重点实验室(广州中医药大学),国家中成药工程技术研究中心南药研发实验室,广州510006)
毛冬青Ilex pubescensHook.et Arn.为冬青科冬青属的植物,其根和叶均可入药,是南方常用中药材,具有清热解毒、活血通脉、消肿止痛等功效[1]。近年研究表明,毛冬青对于心脑血管疾病以及肾病、妇科疾病[2-5]有一定的治疗价值。
毛冬青的主要有效成分为三萜及三萜皂苷,而且大部分为熊果烷型[6-8](α-amyrin衍生物),少数为齐墩果烷型(β-amyrin衍生物)。三萜类化合物虽然在植物中广泛存在,但人们对其具体的生物合成途径了解还不十分全面,对毛冬青三萜类化合物的生物合成途径的认识亦是如此。三萜化合物的生物合成过程可大致分为前体形成、骨架构建以及骨架修饰三个环节[9-11]。骨架的修饰过程是植物调控形成众多种类单体皂苷的重要过程,机制至今尚未完全阐明。
细胞色素P450酶(CYP450)是一类在自然界中广泛存在,具有氧化功能的亚铁血红素蛋白酶家族,参与微生物、动物、植物体内各种代谢反应。在植物中,CYP450在萜类、黄酮类、生物碱类、植物激素等多种物质的生物合成中都发挥重要的生理功能[12]。在三萜皂苷的生物合成途径下游,CYP450起着对三萜骨架的修饰作用,丰富了结构多样性,是植物体内含有种类繁多的三萜类化合物的因素之一[11]。因此,细胞色素P450基因(CYP450)的鉴定是揭示三萜生物合成机制的关键。
近几年,随着高通量测序技术的发展,转录组学方法成为筛选鉴定CYP450基因的重要手段之一。Luo等[13]对三七根进行了转录组测序,并从中筛选到了可能参与三七皂苷生物合成的两个细胞色素P450基因(Pn02132和Pn00158)和一个UDP-糖基转移酶基因(Pn00082)。Misra等[14]将茉莉酸甲酯诱导前后的紫花罗勒转录组数据建成EST文库,从中挖掘并鉴定了两个参与三萜C-28位氧化的基因,CYP716A252和CYP716A253。
酿酒酵母自身的生物合成途径能够产生三萜皂苷前体2,3-氧化鲨烯[15],被广泛用于三萜化合物合成相关基因的功能研究。本课题组前期构建了一株高产 amyrin(α-amyrin和 β-amyrin)的酿酒酵母菌株WAT11tfAX,可作为研究五环三萜类化合物合成相关CYP450基因功能的宿主(未公开发表数据)。毛冬青中三萜类化合物的C-28位多被氧化为羧基,因此本研究利用课题组前期获得的毛冬青转录组数据(Genbank Accession No.SRP102344)[16],对毛冬青中的三萜 C-28位氧化酶基因进行挖掘,并通过在酵母工程菌中进行异源表达来确定其功能。
1 材 料
1.1 植物来源
本实验所用植物为毛冬青,采自广州中医药大学大学城校区药王山,植株经广州中医药大学中药资源与工程研究中心詹若挺研究员鉴定为毛冬青Ilex pubescensHook.et Arn.。
1.2 培养基
LB/Amp培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,121℃灭菌20 min,加入氨苄青霉素使终浓度为100μg/mL。
YPD培养基:蛋白胨20 g,酵母提取物10 g,121℃灭菌20 min,用前加入过滤除菌的葡萄糖溶液使终浓度为2%。
色氨酸缺陷(SC-T)培养基:无氨基酵母氮源6.7 g,缺陷型氨基酸(不含色氨酸)1.92 g,121℃灭菌20 min,用前加入过滤除菌的葡萄糖或半乳糖溶液使终浓度为2%。
固体培养基配制时在上述培养基中加入2%琼脂粉。
1.3 菌株和质粒
大肠埃希菌Escherichia coliTrans1-T1(基因型:F-φ80(lacZ)ΔM15ΔlacX74hsdR(r-k,mk+)ΔrecA1398endA1tonA),购自北京全式金公司。
酿酒酵母Saccharomyces cerevisiaeWAT11tfAX(基 因 型:WAT11,trp1::PGAP1-SctHMGR1-TCYC1,ura3::PGAP1-ScERG20-TCYC1,leu2::PGAP1-SeACSL641PTCYC1,his3::PTEF1-IaAS1-TCYC1),实验室保存。
质粒pEASY(购自北京全式金公司),质粒pESC-TRP(Stratagene,实验室保存),质粒 pEASYIpAO2、质粒pESC-TRP-IpAO2(本研究构建)。
1.4 试 剂
大肠埃希菌培养用的LB培养基,酿酒酵母培养用的YPD培养基购自英国Oxiod公司,SC-T培养基购自美国Sigma公司。
PrimeSTAR Max酶(大连TaKaRa公司);植物RNA提取试剂盒、质粒小量提取试剂盒、DNA凝胶回收试剂盒(广州美基公司);反转录试剂盒、零背景克隆试剂盒、抗His标签小鼠抗体、HRP标记山羊抗小鼠IgG(H+L)抗体(北京全式金公司);限制性内切酶(英国NEB公司);ClonExpress IIOne Step Cloning Kit(南京诺唯赞公司);葡萄糖、半乳糖、氨苄青霉素(北京 Coolaber公司);α-amyrin、β-amyrin、熊果酸、齐墩果酸对照品(上海甄准公司);色谱正己烷(天津科密欧公司);BSTFA(美国Sigma公司);其余试剂均为市售分析纯。
1.5 仪 器
PCR仪(苏州东胜公司);TGem微量分光光度计(北京天根公司);mini-protan小型垂直电泳仪(美国Bio-Rad公司);凝胶成像系统(法国Vilber公司);Agilent 7980B气质联用色谱仪(美国Agilent公司)。
2 方 法
2.1 毛冬青三萜C-28位CYP基因的筛选及其编码氨基酸的序列分析
在前期获得的毛冬青转录组数据中检索出注释为“cytochrome P450”且长度大于1 100 bp的Unigene,将筛选出的CYP基因可能编码的氨基酸序列与已鉴定参与三萜C-28位氧化的CYPs氨基酸序列(共13个)合并构建系统进化树。所用软件为MEGA 7.0,方法选择邻接法。用ESPript 3.0在线工具(http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)对筛选出的CYP氨基酸序列进行比对分析。
2.2 目的基因的克隆
提取毛冬青嫩叶的总RNA,以其为模板,反转录得到cDNA。根据筛选得到的Unigene 0036170(命名为IpAO2)DNA序列设计特异性引物AO2-F和AO2-R(引物序列见表1),用PrimeSTAR Max高保真酶PCR扩增基因。PCR程序为:98℃2 min,98℃ 10 s,55℃ 5 s,72℃ 30 s,35个循环;72℃延伸5 min。用琼脂糖凝胶电泳检测PCR扩增得到的DNA片段,切胶回收后测定DNA的浓度,用零背景克隆试剂盒将IpAO2基因连接到pEASY克隆载体上,连接产物转化至E.coliTrans1-T1感受态细胞,菌液均匀涂布于LB固体培养基(含100 μg/mL氨苄青霉素),于37℃培养过夜后挑取单克隆进行菌落PCR鉴定,阳性克隆进一步通过测序验证。将获得的含IpAO2基因的质粒命名为pEASY-IpAO2。
2.3 重组表达质粒的构建
将酵母表达载体pESC-TRP用限制性内切酶BamH I和XhoI进行双酶切,回收载体片段。以pEASY-IpAO2为模板,设计引物 V-AO2-F和V-AO2-R(引物序列见表1),进行PCR扩增,获得DNA片段,切胶回收后用ClonExpress IIOne Step Cloning Kit将其插入pESC-TRP的多克隆位点2。阳性克隆的筛选步骤同上。将获得的质粒命名为pESC-TRP-IpAO2。

Table 1 Primers used in this study
2.4 在酵母中表达毛冬青IpAO2基因
将质粒pESC-TRP-IpAO2用醋酸锂转化法转化至S.cerevisiaeWAT11tfAX中,菌液均匀涂布于SC-T固体培养基(含葡萄糖),平板在30℃培养48 h。挑取重组酵母单菌落接种于SC-T液体培养基(含葡萄糖)15 mL中,30℃,225 r/min培养36 h后,换至SC-T液体培养基100 mL中(含半乳糖),诱导培养7 d。
2.5 Western blot分析
取诱导后8 h的酵母菌体,提取酵母细胞的总蛋白进行SDS-PAGE电泳。电泳结束后取下凝胶转膜,再经一抗、二抗标记后,用化学发光法显影,以转化了空载体pESC-TRP的菌株为阴性对照。
2.6 重组酵母代谢产物的提取和分析
离心收集酵母菌体,加入提取液(40%KOH-无水乙醇,1∶1)10 mL,混匀后水浴加热回流30 min,调节提取液pH至2.0~2.5,用等体积的正己烷萃取3次,分取正己烷层,挥干,残渣加BSTFA硅烷化试剂衍生化,然后用GC-MS进行检测。
气相条件:进样口温度为 250℃;进样量1μL,不分流;色谱柱为 HP-5MS(30 m×0.25 mm,0.25μm);柱温箱升温程序150℃起始,保持1 min,以10℃/min升至300℃,保持20min;载气为He,柱流量0.7 mL/min。质谱条件:EI离子源,电子能量70 eV,离子扫描范围50~600m/z,四极杆温度150℃,离子源温度230℃,GC-MS连接口温度280℃,化合物检索的谱库为NIST14.L。
2.7 IpAO2蛋白结构的预测
用 Phyre2在线工具(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预 测IpAO2蛋白的跨膜域和蛋白的三级结构。
3 结 果
3.1 IpAO2基因的筛选及其编码蛋白的序列分析
将从毛冬青转录组数据中检索筛选出的可能编码CYP450的Unigenes对应氨基酸序列与文献报道已知参与五环三萜C-28位氧化的CYP450氨基酸序列(共13个)合并构建系统进化树,结果见图1。通过系统发育分析,发现Unigene 0036170与其它已知的催化C-28位氧化的CYP450聚为一支,推测其编码的蛋白很可能具有类似功能,参与毛冬青五环三萜的C-28位氧化。将该基因命名为IpAO2,其包含一个1 443 bp的开放阅读框,编码480个氨基酸。
将IpAO2基因编码的氨基酸序列与CYP716A154、 CYP716A252、 CYP716A253、CYP716A52v2、CYP716A75、IpAO1的氨基酸序列进行比对,结果见图2,分析结果显示IpAO2与上述三萜C-28位氧化酶CYP450序列相似性较高,可达70%,进一步说明IpAO2可能具有类似的功能。
3.2 IpAO2基因在酵母中的异源表达
将获得的重组酵母菌株S.cerevisiaeWAT11tfAX/pESC-TRP-IpAO2命名为 strain 1,质粒上的GAL1启动子被2%半乳糖诱导激活,启动转录和翻译过程,表达IpAO2基因。提取重组酿酒酵母strain 1的总蛋白后,利用目的蛋白序列C端连接的6×His抗原标签进行Western blot实验。结果(图3)表明酵母合成了和预期大小相符的重组蛋白(55.2 kD)。
3.3 重组酵母代谢产物分析
收集诱导培养7 d后的重组酵母菌体,提取其代谢产物,硅烷化后用GC-MS进行检测。图4分别为总离子流图(A)、质谱图(B)以及选择离子流图(C)。在转化了空载体pESC-TRP的酵母代谢产物中,发现在保留时间11.9和12.3 min处出现了预期的β-amyrin(Peak 1)色谱峰和 α-amyrin色谱峰(Peak 2),虽然与标准品β-amyrin和α-amyrin的保留时间存在一定漂移,但选择离子流图显示检测到了特征离子峰(m/z498.4、218.2、189.1),且质谱离子碎片也与标准品一致;转化了IpAO2基因的重组酵母strain 1的代谢产物中,除了在11.9 min和12.3 min时仍能检测到底物β-amyrin(Peak 1)、α-amyrin(Peak 2)外,还出现了4个新的色谱峰Peak 3(14.7min)、Peak 4(15.5min)、Peak 5(14.1 min)和Peak 6(15.6 min)。通过NIST14.L谱库检索,4个新的化合物初步确认分别为oleanolic acid(匹配度 93%)、ursolic acid(匹配度 95%)、uvaol(匹配度94%)和ursolic aldehyde(匹配度99%)。Peak 3和Peak 4分别与相应的齐墩果酸和熊果酸标准品的保留时间存在一定漂移,但选择离子流图显示检测到了特征离子峰(m/z585.5、320.2、203.2),且质谱离子碎片也与标准品一致,说明了菌株strain 1生成了齐墩果酸和熊果酸。由此,推断IpAO2基因编码一个三萜C-28位氧化酶,能够分别催化底物β-amyrin和α-amyrin氧化生成齐墩果酸和熊果酸。
3.4 IpAO2蛋白结构的预测结果
Phyre2在线工具预测结果见图5,IpAO2预测为跨膜蛋白,跨膜区域为12 aa至27 aa。以lanosterol 14-alpha demethylase(PDB ID:c4lxjA)为模板同源建模,3D模型的覆盖率达96%,可信度为100%。比对预测3D模型和模板的骨架原子,模型整体结构均方根RMS为2.54Å。
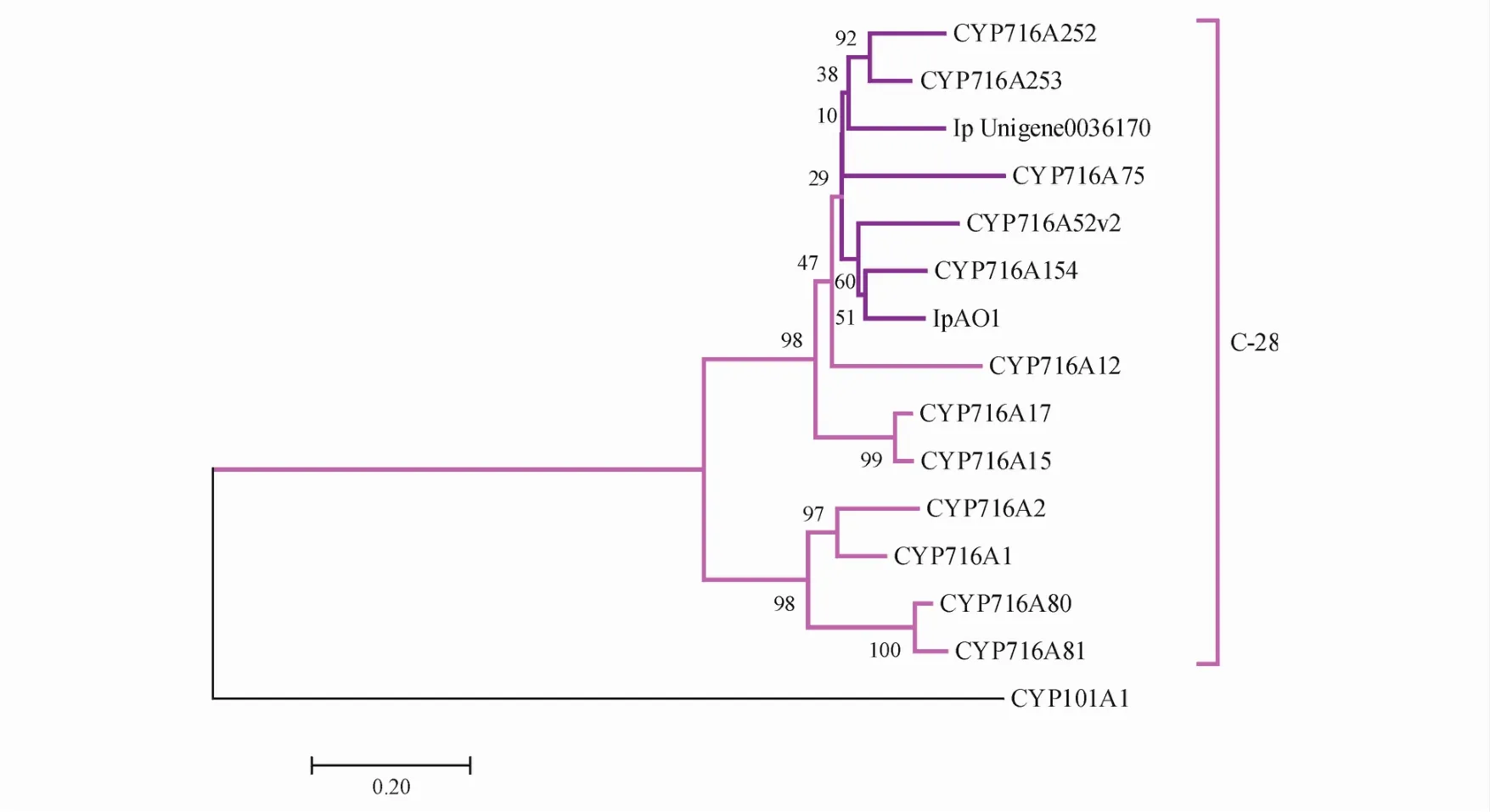
Figure1 Phylogenetic tree analysisComplete amino acid sequences of pentacyclic triterpene C-28 modifying cytochrome P450 monooxygenases(CYP450s),together with that of Ilex pubescens unigene 0036170 were analyzed by MEGA7.0.Sequence alignmentwas carried out following CLUSTALW analysis and the phylogenetic tree was built using the neighbor-joiningmethod.Evolutionary distanceswere computed using the Poisson correction method.The sequence numbers of the proteins used for tree building are as follows:Arabidopsis lyrata subsp.lyrata CYP716A1(EFH44718.1),Arabidopsis thaliana CYP716A2(BAU61505.1),Medicago truncatula CYP716A12(ABC59076.1),Vitis vinifera CYP716A15(BAJ84106.1),Vitis vinifera CYP716A17(BAJ84107.1),Maesa lanceolata CYP716A75(AHF22088.1),Barbarea vulgaris subsp.Arcuata CYP716A80(ALR73782.1),Barbarea vulgaris subsp.Arcuata CYP716A81(ALR73781.1),Panax ginseng CYP716A52v2(AFO63032.1),Catharanthus roseus CYP716A154(AEX07772.1),Ocimum basilicum CYP716A252(AFZ40057.1),Ocimum basilicum CYP716A253(AFZ40058.1),Ilex pubescens IpAO1[17](a homolog of CYP716A210,MH370828).Outgroup:Pseudomonas putida CYP101A1(P00183.2)
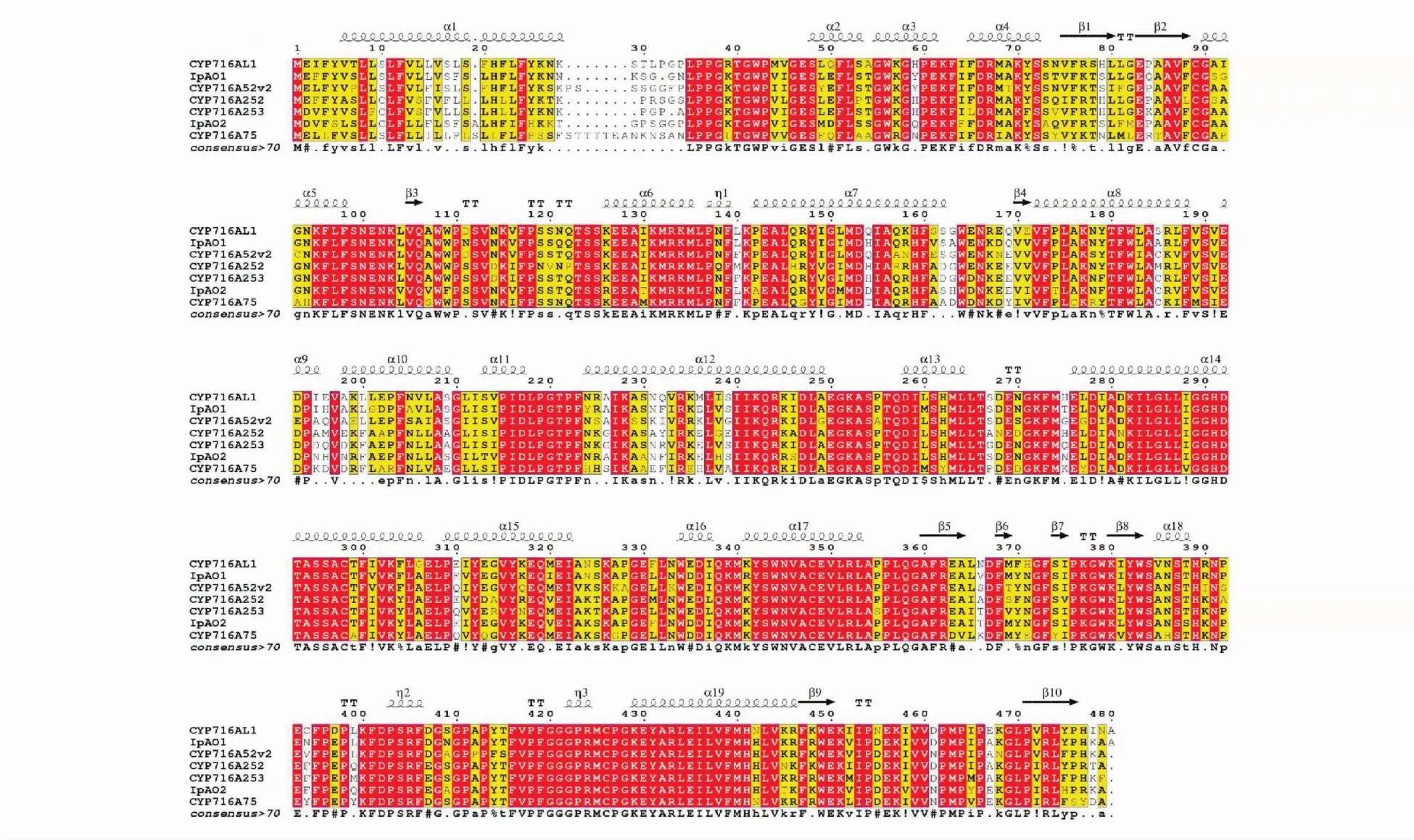
Figure 2 Multiple sequence alignments of IpAO2 with other known CYP450s
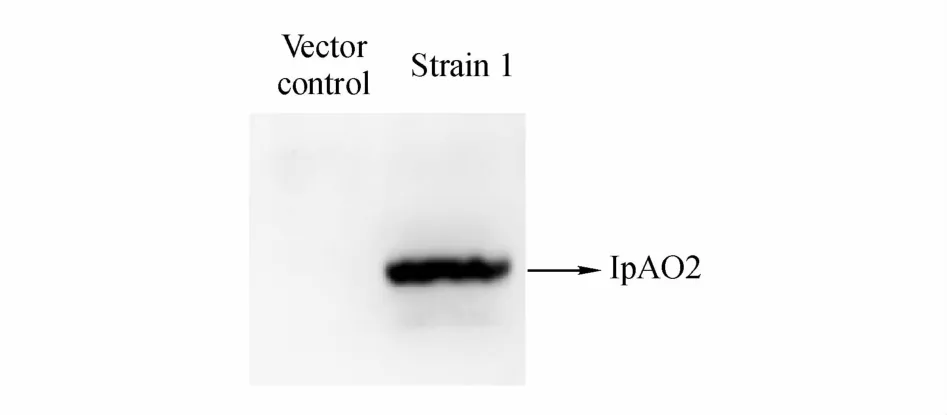
Figure3 Western blot analysis of recombinant protein expressed in S.cerevisiae WAT11tfAX
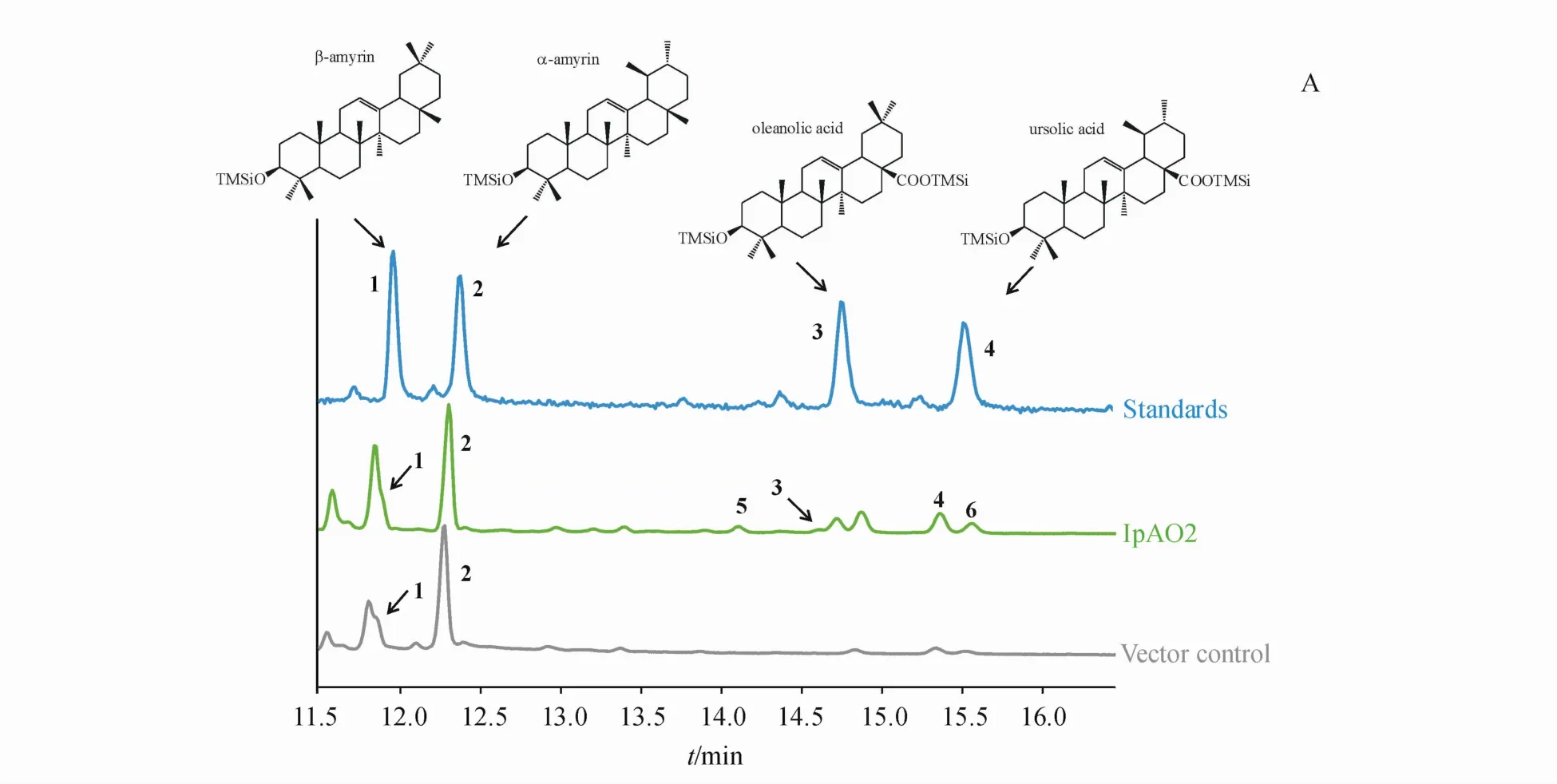


Figure4 In vivo enzymatic activity assay in yeastA:Total ion chromatograms(TICs)of yeast extracts.Mixture ofβ-amyrin(1),α-amyrin(2),oleanolic acid(3)and ursolic acid(4)was used as standrad sample;B:Mass fragmentation patterns obtained from authentic standards and yeastextracts;C:The abundancee of selected ion chromatograms of strain 1 extract

Figure5 Predicted transmembrane helices(A)and protein 3Dmodel of IpAO2(B)Image coloured by rainbow N→C terminus Model dimensions(Å):X:84.889 Y:64.537 Z:62.809
4 讨 论
植物次生代谢产物结构复杂多样,许多具有广泛的生物学活性。随着分子生物学技术的发展,植物次生代谢产物的生物合成与调控也日益受到关注。毛冬青三萜类化合物具有抗炎、降压、抗凝血等药理活性[18],为毛冬青的主要药效成分,具有较高的药物开发价值,但对于其生物合成途径,特别是对下游部分的认识还非常有限。本研究发掘并鉴定了1个具有五环三萜C-28位氧化功能的CYP450基因——IpAO2,其编码的蛋白能将底物α-amyrin和β-amyrin氧化为熊果酸和齐墩果酸。实验中还检测到uvaol(Peak 5)和ursolic aldehyde(Peak 6),但限于没有标准品,无法确证。文献报道[19-21]多个五环三萜C-28位氧化酶是通过连续的三步氧化反应将底物C-28的甲基氧化为羧基,因此推测 IpAO2也是通过催化 α-amyrin生成uvaol、ursolic aldehyde,最终形成熊果酸。IpAO2基因的鉴定丰富了对毛冬青中三萜化合物下游生物合成路径的认知,同时为后期进一步利用代谢工程手段在酿酒酵母中生产以熊果烷型为主的三萜化合物奠定了基础。
据文献报道,已知的具有五环三萜C-28位氧化功能的CYP450多以香树脂醇和羽扇豆醇作为底物,如Medicago truncatula中的CYP716A12能够分别氧化α-amyrin,β-amyrin和羽扇豆醇生成熊果酸、齐墩果酸和白桦脂酸[22],Panax ginseng中的CYP716A52v2[23]和Maesa lanceolata中 的CYP716A75[20]具有 β-amyrin的 C-28位氧化功能。本研究发现 IpAO2能够同时氧化 α-amyrin和β-amyrin,与前期已鉴定的毛冬青另一个C-28位氧化酶IpAO1功能相同,但氨基酸序列相似性仅为78.79%。不同的三萜C-28位氧化相关CYP450对底物是否存在选择性差异,具体哪些关键氨基酸残基决定了底物的特异性等问题值得深入研究。
