中期因子在绒毛膜癌中的表达及其与临床病理特征的关系研究
2019-08-28姚红丽姚英武崔开宇李娟仝进毅孙丽萍
姚红丽 姚英武 崔开宇 李娟 仝进毅 孙丽萍
中期因子(midkine,MK)属于肝素结合因子的一种多肽,在人体胚胎发育期与细胞生长、分化有关。MK在胚胎时期高表达,出生后逐渐降低,在成年组织中,除肾脏和小肠上皮外,其他部位几乎不表达[1]。研究发现,MK在多种人类肿瘤中过度表达,在肿瘤发生、发展的过程中发挥重要作用,具有促进细胞生长、迁移、浸润、分化及抗细胞凋亡等作用[1-3],并且与肿瘤的不良预后有关[4-5]。MK在绒毛膜癌(以下简称绒癌)中的表达情况及其与绒癌的转移、侵袭、预后的关系研究报道不多。本研究旨在分析MK在绒癌中的表达情况,探讨MK表达与绒癌病理特征的关系,以期为绒癌的诊治及预后判断提供理论参考,现报道如下。
1 材料和方法
1.1 材料
1.1.1 细胞 人绒癌细胞株JEG-3由中国科学院北京细胞所细胞库提供,人绒癌细胞株JAR由中国科学院上海生物细胞研究所提供。
1.1.2 组织标本 选取2012年1月至2017年12月在本院行手术治疗32例绒癌患者的绒癌组织标本,患者年龄 27~55(39.6±7.2)岁;其中肿瘤临床分期Ⅰ期 12例、Ⅱ期5例、Ⅲ期11例、Ⅳ期4例。绒癌组织标本均为患者手术切除的子宫组织标本。患者临床资料完整,术前均未接受过化疗。
1.1.3 主要试剂和仪器 Transwell侵袭小室购自美国Corning Costar公司。Matrigel体外侵袭试验凝胶购自北京大学细胞生物学系。RPMI 1640培养基购自美国GibcoBRL 公司,PBS缓冲液(pH 7.2~7.6)购自美国 Sigma公司。免疫组织化学S-P试剂盒、兔抗人MK多克隆抗体、Western blot、增强化学发光法(ECL)检测试剂盒购自武汉博士德公司。兔抗人β-actin抗体及DAB显色试剂盒均购自北京中杉金桥生物技术公司。逆转录试剂盒购自北京嘉美生物科技有限公司。Forma 3111型水套式二氧化碳培养箱为美国Forma公司产品。常、低温超速离心机为德国Eppendorf公司产品。iQ5实时荧光定量PCR仪为美国Bio-Rad公司产品。
1.2 方法
1.2.1 人绒癌细胞株JEG-3、JAR的培养 将JEG-3、JAR细胞株接种于RPMI 1640培养液中,EG-3、JAR细胞均呈贴壁生长,JEG-3细胞形态不规则。JEG-3、JAR细胞株均生长良好,3d传代1次。接种后的细胞在培养液中呈现悬浮状态,细胞质回缩,细胞呈圆球形,大约4h后细胞在培养瓶底部附着,贴壁生长,随即细胞进入对数生长期。细胞长满瓶壁后,进入平台期,此时细胞虽然有活力但不再分裂。选择对数生长期的JEG-3、JAR细胞进行后续实验。
1.2.2 绒癌JEG-3、JAR细胞体外侵袭能力检测 采用Matrigel法。取对数生长期的JEG-3、JAR细胞,采用Transwell侵袭小室检测系统,检测400倍光镜下的穿膜细胞数,观察四周和中间的5个不同视野,取其平均数值。JEG-3、JAR细胞在体外的侵袭能力以穿膜细胞数量来表示。实验重复5次。
1.2.3 不同培养时间点绒癌JEG-3、JAR细胞MK mRNA表达水平检测 采用RT-PCR法分别检测JEG-3、JAR细胞培养12、24、48h时MK mRNA表达水平。参照RT-PCR逆转录试剂盒的说明书进行操作,分别提取JEG-3、JAR细胞的总RNA 2μl,多聚胸腺嘧啶T重复寡核苷酸 Oligo(dT)15μl和适量双蒸水(ddH2O)水混匀至总体积 13μl,70℃变性 5min,冰上放置 5min,再加入5×逆转录缓冲液 5μl、dNTP 混合物 1μl、RNA 酶抑制剂1μl,MMV 逆转录酶 1μl,ddH2O 4μl,至总体积为 25μl,混匀,42℃孵育60min,85℃灭活5min,冰上骤冷。再取40个 EP管,每管分别装入 RT产物 1.5μl,Taqmix 12.5μl,ddH2O 9μl,SYBR Green 1μl,扩增的目的基因引物各1μl,采用实时荧光定量PCR法扩增。MK上游引物:5′-AGCAAAGGCCAAAGCCAAGA-3′,下游引物:5′-ACAAGGCAGGGCATGATTGA-3′。GAPDH 上游引物:5′-GGAGTCAACGGATTTGGTCG-3′,下游引物:5′-GCCTTCTCCATGGTGGTGAA-3′。反应条件设为95℃预变性 3min,95℃变性 30s,55℃退火 30s,72℃延伸 50s,40个循环。实验重复5次。
1.2.4 绒癌JEG-3、JAR细胞MK蛋白表达水平检测采用Western blot法。分别提取JEG-3、JAR细胞的总蛋白,蛋白含量采用Bradford法检测。每条泳道置入50μg的总蛋白,经过十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,电泳完成后转膜及封闭,然后加入兔抗人MK一抗或β-actin抗体,4℃孵育过夜,用三羟甲基氨基甲烷缓冲盐水(TBS)洗膜,加入辣根过氧化物酶(HRP)标记的山羊抗兔 IgG(1∶2 000),室温条件下孵育1h,TBS洗膜3次,按ECL显色试剂盒进行显色、曝光、冲洗X线片。Western blot检测结果扫描后应用Gel-pro Analysis图像分析处理软件进行图像吸光度值分析。实验重复5次。
1.2.5 绒癌组织MK蛋白表达情况检测 采用免疫组织化学法。将用石蜡包埋的绒癌组织标本均连续4μm厚切片,采用S-P法进行免疫组织化学显色反应,MK抗体的工作浓度为1∶150。用已知的MK和Ki-67阳性片作为阳性对照;0.01%mol/L PBS代替一抗,其余操作同正常免疫组化染色步骤,作为阴性对照。MK蛋白表达阳性细胞为细胞质和(或)细胞膜中出现黄色、棕褐色颗粒。每张切片观测10个具有代表性的高倍视野,每个高倍视野记数50个细胞,依据镜下阳性细胞占细胞总数的百分率综合判断。MK蛋白表达阳性细胞数<10%为阴性(-),10%~20%为弱阳性(+),21%~50%为中等阳性(++),>50%为强阳性(+++)。
1.3 观察指标 (1)比较绒癌JEG-3、JAR细胞体外侵袭能力;(2)比较不同培养时间点绒癌JEG-3、JAR细胞MK mRNA表达水平;(3)比较绒癌JEG-3、JAR细胞MK蛋白表达水平;(4)分析绒癌组织MK蛋白阳性表达率与临床病理特征的关系,包括患者年龄、肿瘤临床分期、国际妇产科联盟(FIGO)预后评分等。
1.4 统计学处理 应用SPSS 19.0统计软件;计量资料以表示,组间比较采用两独立样本t检验;计数资料组间比较采用Fisher确切概率法;P<0.05为差异有统计学意义。
2 结果
2.1 绒癌JEG-3、JAR细胞体外侵袭能力比较 JEG-3细胞的穿膜细胞数为(204.5±12.5)个/视野,JAR 细胞的穿膜细胞数为(136.4±17.6)个/视野,JEG-3细胞穿膜数明显多于JAR细胞,两者比较差异有统计学意义(P<0.05),即JEG-3细胞体外侵袭能力强于JAR细胞,见图1。
图1 绒癌JEG-3、JAR细胞穿膜情况比较(×400)
2.2 绒癌JEG-3、JAR细胞MK mRNA表达水平比较培养12、24、48h时,高侵袭性JEG-3细胞MK mRNA表达水平均高于低侵袭性JAR细胞,两者比较差异均有统计学差异(均P<0.05),见图2。
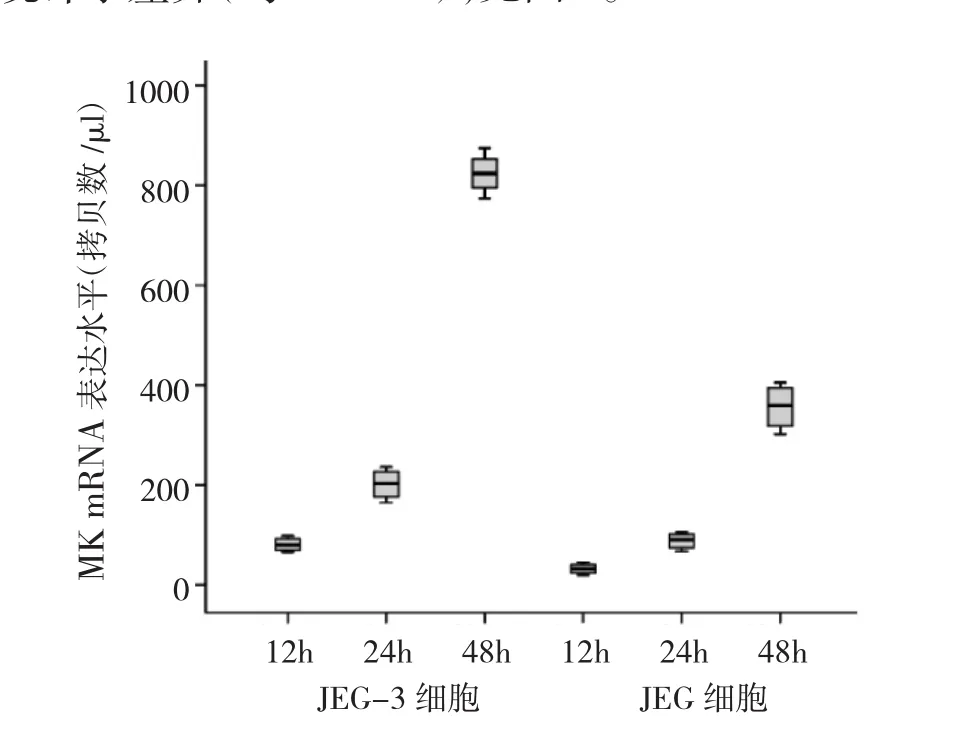
图2 不同培养时间点绒癌JEG-3、JAR细胞MK mRNA表达水平比较
2.3 绒癌JEG-3、JAR细胞MK蛋白表达水平比较MK蛋白在高侵袭性JEG-3细胞中的表达水平为(1.87±0.20),在低侵袭性JAR细胞中的表达水平为(0.70±0.19)。JEG-3细胞MK蛋白表达水平高于JAR细胞,两者比较差异有统计学意义(P<0.05),见图3、4。
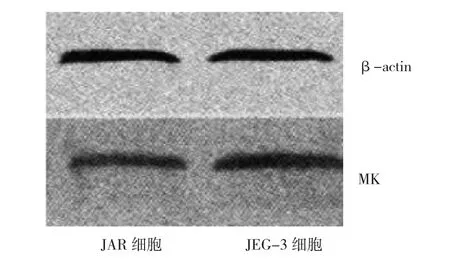
图3 绒癌JEG-3、JAR细胞MK蛋白表达电泳图

图4 绒癌JEG-3、JAR细胞MK蛋白表达水平比较
2.4 绒癌组织MK蛋白表达情况与临床病理特征的关系分析 分析绒癌组织MK蛋白表达情况与患者年龄、临床分期、FIGO预后评分的关系,结果显示MK蛋白在绒癌组织中的表达阳性率与患者年龄无明显关系,在<40岁与≥40岁患者间的差异无统计学意义(P>0.05),MK蛋白在临床分期为Ⅲ~Ⅳ期的绒癌组织中表达阳性率高于Ⅰ~Ⅱ期的绒癌组织(P<0.05),在FIGO预后评分高危的绒癌组织中表达阳性率高于低危的绒癌组织(P<0.05),见表 1。
3 讨论
MK存在于细胞的表面和细胞外基质中,它对葡氨聚糖肝素和硫酸肝素具有高度亲和力。妊娠中期可见MK大量表达,表明MK蛋白在妊娠的过程中起重要作用[6]。在成人身上,MK被限制在一定的组织中表达。然而,在肿瘤发生、炎症和组织细胞修复过程中,MK的表达明显上调。MK在多种人类恶性肿瘤中均高度表达,如头颈部肿瘤、消化道肿瘤、泌尿系统肿瘤等[7-9],且MK可能参与肿瘤发生、发展、转移等过程,并与不良预后有关[10-11]。本研究结果也发现MK在绒癌高侵袭性JEG-3细胞、低侵袭性JAR细胞及绒癌组织中均有不同程度表达,提示MK可能与绒癌的侵袭性改变有关。
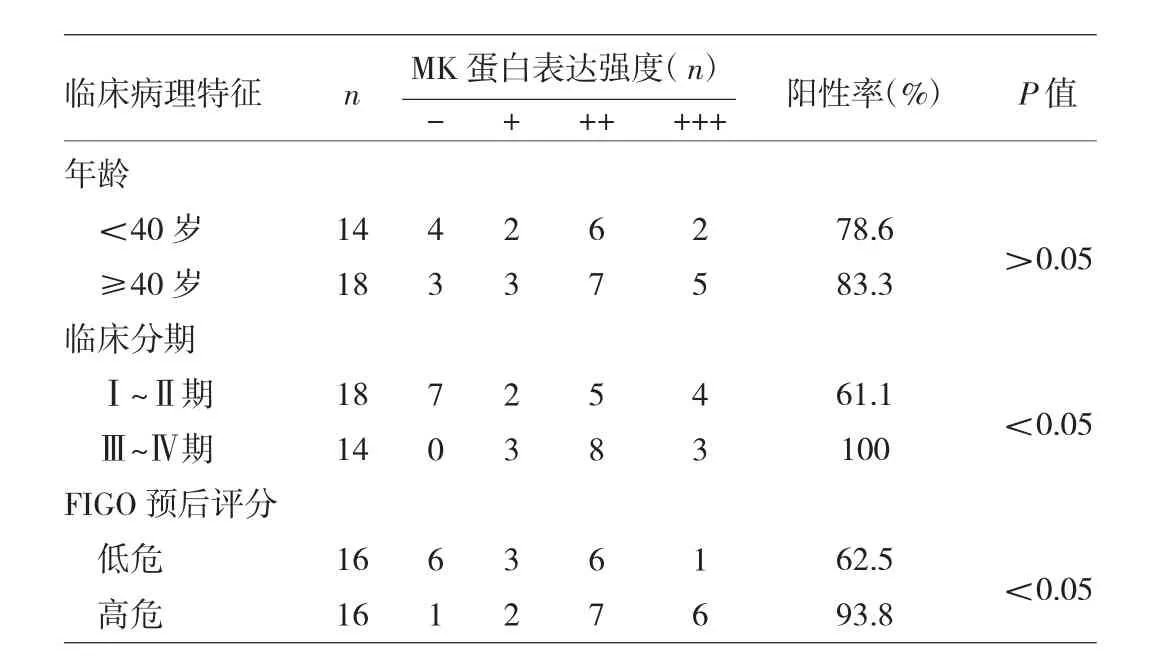
表1 绒癌组织MK蛋白表达情况与临床病理特征的关系分析
Huang等[12]采用免疫组织化学和RT-PCR技术对胃癌组织进行检测,发现MK表达水平与肿瘤临床分期及远处转移呈有关,表明MK对肿瘤转移有促进作用。Ma等[13]发现MK表达阳性可独立预测肝胆管细胞癌复发,发现MK表达阳性预示可切除的肝胆管细胞癌患者预后不良。Xia等[14]表明MK在非小细胞肺癌中表达水平越高,癌细胞的侵袭、转移能力越强,提示预后不良。Taku等[15]采用Cox比例风险模型对头颈部鳞状细胞癌的研究发现,血清MK水平为患者生存的独立预后因子,过表达会导致患者死亡的相对风险上升,且血清MK水平与化疗敏感性有关。本研究结果也显示MK蛋白在绒癌组织中的表达与临床分期及FIGO预后评分有关,临床分期越晚、FIGO预后评分高危的绒癌组织MK蛋白表达明显增强,提示MK与绒癌侵袭及预后相关。
绒癌属于妊娠滋养细胞肿瘤的一种,是源于胎盘滋养细胞的恶性疾病。因此,研究MK在绒癌中的表达情况意义重大,可能通过干预MK基因在绒癌中的表达,从而干预绒癌细胞的侵袭和转移,达到改善患者预后的目的。为研究MK高度表达与绒癌侵袭、转移的相关性,本研究小组前期研究发现绒癌组织中MK的表达明显强于侵蚀性葡萄胎及葡萄胎组织,提示MK可能是促进绒癌细胞侵袭、转移的一个重要因素,其表达水平升高可能增强绒癌细胞的侵袭能力[16]。为进一步研究MK高度表达与绒癌侵袭、转移及预后的关系,本研究采用Matrigel体外侵袭试验、Western blot法、RT-PCR从蛋白及mRNA水平对MK在绒癌组织及细胞株中进行了检测。发现随着绒癌临床分期的升高MK的表达明显增强;而且高侵袭性JEG-3细胞中MK的表达水平明显高于低侵袭性JAR细胞。这表明绒癌组织中MK的表达增强可能是促进绒癌细胞侵袭、转移的一个重要因素,同时也影响了绒癌患者的预后。但其具体分子作用机制有待进一步深入研究。Lu等[8]研究胆管癌细胞系对吉西他滨化疗耐药机制,发现MK促进胆管癌细胞的上皮细胞向间充质转化(EMT),当EMT被小干扰(si)RNA靶向Twist阻断时,MK对吉西他滨耐药的增强作用被消除。此外,MK促进了Notch-1的表达,而siRNA敲低Notch-1则阻断了胆管癌细胞系的EMT过程。这说明MK通过上调Notch-1诱导EMT促进胆管癌的吉西他滨耐药,促进肿瘤复发转移。此外,对皮肤黑色素瘤的研究表明,MK是决定患者预后的新淋巴管生成的系统诱导物,MK的这一作用与淋巴内皮细胞中mTOR通路的旁分泌激活有关[17]。
综上所述,MK在绒癌组织中高表达,且与绒癌细胞侵袭能力有关,其表达阳性率随绒癌分期的升高而增高。MK在绒癌的侵袭、进展中起至关重要的作用,可作为判断绒癌恶性程度和预后的重要生物标志物。
