3D打印技术在多学科协作脊柱肿瘤精准化、个性化手术治疗的应用
2019-08-26吴信尚显文张皓叶川宁旭杨龙杨丹袁代柱李钟辉
吴信 尚显文 张皓 叶川 宁旭 杨龙 杨丹 袁代柱 李钟辉
贵州医科大学附属医院骨科(贵阳 550001)
脊柱手术解剖结构复杂,邻近重要血管、神经、脊髓,椎管内外和不同节段的手术难度不尽相同,特别是颅颈交界区、颈胸椎及胸腰椎移行区、骶尾部等,这些部位的力线改变及解剖结构复杂,手术难度和风险较大,手术往往需要多学科协作(multi-disciplinary treatment,MDT)[1-2]。传统的脊柱肿瘤手术依靠X线、CT及MRI等术前影像资料,要求手术医生具有丰富的经验及空间想象能力,对外科医生临床素养和经验要求极高。脊柱肿瘤手术成功的关键在于术前周密的规划、术中准确、彻底切除肿瘤以及重建术后脊柱的稳定性[3]。随着3D打印及导板技术的推广,使脊柱肿瘤手术进入精准化、个性化时代,可明显缩短手术时间、减少出血,手术安全有效[4]。本研究旨在探讨多学科协作模式下,基于3D打印及导板技术辅助脊柱肿瘤精准切除及准确置钉的安全性及可行性,为脊柱肿瘤的精细化、个性化治疗提供依据。纳入2016年6月至2018年12月,贵州医科大学附属医院骨科联合本院神经外科、血管外科、胸外科、普外科、麻醉科、介入科、肿瘤内科、ICU等多学科共同诊治的36例脊柱肿瘤患者,对照组18例常规参照影像学资料制定手术方案,观察组18例患者术前应用3D打印脊柱肿瘤实体模型及置钉导板,制定精准化、个性化的手术方案,手术效果均满意。观察组手术时间、术中透视次数、出血量、置钉准确率明显优于对照组,术后随访6~12个月均获得满意疗效,现报告如下。
1 资料与方法
1.1 一般资料选取具有明确手术指征的脊柱肿瘤患者36例,其中男17例,女19例;年龄:18~76岁,平均(43.6±2.5)岁;神经鞘瘤9例,骨转移瘤6例,脊膜瘤6例,多发性骨髓瘤4例,神经纤维瘤4例,骨巨细胞3例,脊索瘤2例,血管周细胞瘤1例,侵袭性血管瘤1例;从发病部位分:颈部4例,颈胸交界3例,胸中部9例,胸腰交界4例,腰部11例,骶尾部5例。患者术前诊断脊柱肿瘤,术后病理结果证实。36例患者采用随机数表法分为两组,观察组18例经多学科协作制定手术方案,均在术前行薄层CT、CTA及MRI检查,个性化制作3D打印脊柱模型及置钉导板;对照组18例根据常规影像资料制定手术方案。两组患者的平均年龄和性别差异无统计学意义(P>0.05)。入组的所有患者均知情同意,自愿参与试验,且获得医院伦理委员会批准。
1.2 纳入与排除标准纳入标准:(1)患者诊断明确,有手术指征,无手术禁忌症,知情同意,愿意参加临床试验;(2)术前行薄层CT、CTA及MRI检查,制作3D打印模型及导板;(3)均行脊柱肿瘤病灶切除术,术后随访6个月以上。排除标准:(1)有手术禁忌症者;(2)拒绝接受临床试验者;(3)术后随访流失者。
1.3 3D打印模型及导板的准备观察组所有病例均行脊柱病灶术区薄层CT、CTA、MRI平扫+增强检查,CT层厚1 mm,MRI为1.5 mm,将Dicom格式的文件导入Mimics 17.0软件(Materialise公司,比利时),经计算获得3D模型,通过图像融合技术进行三维重建,目标区域包含肿瘤、骨骼、神经、血管等多种组织,将计算好的STL格式脊柱模型,采用不同颜色多分割蒙版创建模型,通过修复重建骨骼及血管、神经,完成3D模型的配准,输出至熔融沉积型3D打印机,以聚乳酸塑料作为打印原材料,制作出1∶1大小的脊柱肿瘤实体模型,经过粉刷上色处理后得到最终的3D脊柱实体模型(图1)。脊柱椎体模型标定最佳置钉点及进针导管,将脊柱椎体模型及置钉通道数据导入3-matic 9.0逆向工程软件(Materialise公司,比利时),以拟置钉椎体后部的解剖学形态建立反向模板,并将进针导管与反向模板相结合获得个性化进针导板,将脊柱模型及导板文件导入3D打印机,以光敏树脂为原材料打印置钉导板,体外验证导板与椎体后部骨性结构完整贴合且稳定,以低温等离子消毒导板术中备用(图2、3)。
1.4 设计手术方案及模拟手术根据脊柱不同节段肿瘤所累积的重要脏器,需要多学科协作共同制定围手术期治疗措施及个性化手术方案。联合3D打印模型清晰显示术区空间解剖结构,精准定位肿瘤位置、大小及周围组织结构,明确肿瘤形态及准确界定切除范围,以便定制手术方案及医患沟通;同时应用3D导板辅助准确置钉,模拟进钉角度和深度,选择合适的螺钉种类、直径,植入螺钉。手术过程中根据具体情况调整,实现对肿瘤组织精确、完整的切除,避开重要血管、神经及脏器,保障脊柱肿瘤手术的安全性。
1.5 手术方法根据肿瘤位置选择合适手术入路,术前明确解剖结构,肿瘤血供丰富者于介入科行肿瘤供血动脉介入栓塞;颅颈交界区的肿瘤,需与神经外科共同协作;胸腔纵隔及主动脉的肿瘤,需与胸心外科、血管外科等共同协作;骶尾部累及直肠的肿瘤,术前与普外科共同协作;对于手术创伤大,术中麻醉风险高,术后生命征不平稳,术后需放化疗的患者,术前与麻醉科、ICU、肿瘤内科等多学科协作制定手术方案。通过多学科协作模式,发挥各专科之所长,联合各科专家进行病例讨论,有效避免某一科室医生对其他科室专业知识认识不足造成的局限性。以患者为中心,针对特定病例进行全面整体分析,为患者确定最佳的个性化诊疗方案,共同确保围手术期的安全。联合3D打印技术,术前根据模型模拟手术,术中参照3D打印模型精准切除肿瘤,避免损伤瘤体周围重要组织;术中准确放置导板,根据导板设计的预进钉点及角度在椎体相应的部位置入椎弓根螺钉,重建脊柱稳定性,术中置钉完成后予G臂透视,评估置钉位置(图3)。

图1 脊柱肿瘤影像学检查及对应3D打印模型示意图Fig.1 Imaging examination of spinal tumor and schematic diagram of corresponding 3D printing model

图2 颈椎肿瘤影像学检查及导板示意图Fig.2 Imaging examination and navigation model of cervical spine tumor

图3 颈椎肿瘤3D打印模型及导板辅助置钉Fig.3 3D printing model of cervical spine tumor and navigation template assisted pedicle screw placement
1.6 评价置钉准确率两组患者术后均复查脊柱正侧位X片、薄层CT+三维重建。根据CT评价螺钉与椎弓根的情况,根据 KAWAGUCHI等[7]和 LU等[8]提出的方法来评价置钉准确率,见表1。数据统计分析时,将0级置钉情况定义为准确置钉,并计算置钉准确率,记录是否引起神经、血管及脊髓损伤。

表1 置钉准确情况分类标准Tab.1 Classfication standard for accruate localization of pedicle screw placement
1.7 术后随访及功能评估术后分别于第1、3、6个月门诊随访,以后每3个月随访一次,随访评估时间直至术后12个月。随访行VAS评分,神经查体及运动功能检查,进行X片、CT、MRI检查。转移性肿瘤患者术后24个月内每6个月行一次胸部CT检查,随后每6个月评价一次肿瘤转移情况。
1.8 统计学方法采用SPSS 19.0软件进行统计分析,计量资料以(±s)表示,计数资料用χ2检验;手术时间、术中出血量及透视次数为计量资料,两组差异比较采用t检验,置钉准确率为计数资料,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料对比两组患者基本情况对比,见表2,均随访6~12个月,未出现遗漏。

表2 两组患者基本情况比较Tab.2 Comparison of basic conditions of patients in both groups
2.2 观察指标两组手术时间、术中出血量、透视次数、术后置钉准确率进行比较。观察组置钉96枚,其中0级95个,1个1级,无2、3级;对照组置钉92枚,其中0级84个,5个1级,3个2级,无3级,见表3。观察组手术时间、出血量、透视次数、置钉准确率均优于对照组,差异有统计学意义(P<0.05)。两组置钉均未引起神经、血管及内脏损伤。
表3 两组患者手术时间、透视次数及出血量比较Tab.3 Comparison of operation time,fluoroscopy times and blood loss of patients in both groups ±s
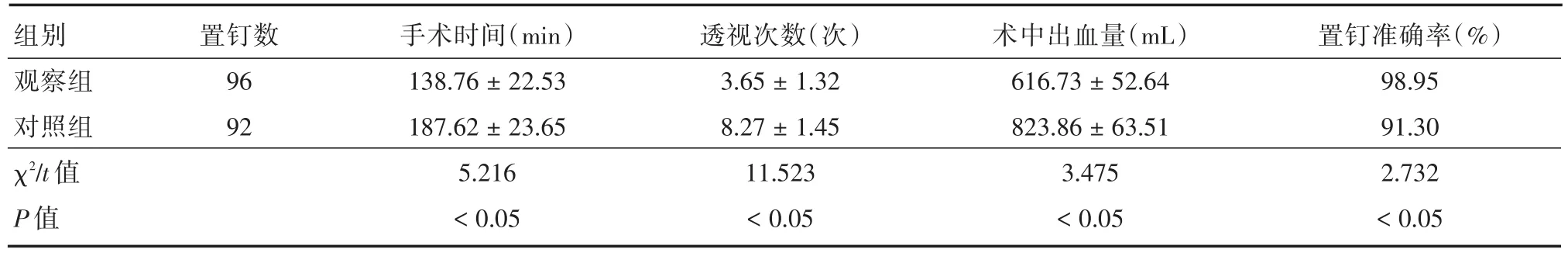
表3 两组患者手术时间、透视次数及出血量比较Tab.3 Comparison of operation time,fluoroscopy times and blood loss of patients in both groups ±s
组别观察组对照组χ2/t值P值置钉数96 92手术时间(min)138.76±22.53 187.62±23.65 5.216<0.05透视次数(次)3.65±1.32 8.27±1.45 11.523<0.05术中出血量(mL)616.73±52.64 823.86±63.51 3.475<0.05置钉准确率(%)98.95 91.30 2.732<0.05
2.3 术后随访结果术后分别于第1、3、6个月门诊随访,以后每3个月随访一次,其中第6、12个月随访行VAS评分,见表4。两组术前VAS评分比较差异无统计学意义(P>0.05),两组术后6、12个月VAS评分均较术前显著降低(P<0.05),观察组术后VAS评分显著低于对照组(P<0.05)。
表4 两组患者VAS评分比较Tab.4 Comparison of VAS scores between two groups ±s

表4 两组患者VAS评分比较Tab.4 Comparison of VAS scores between two groups ±s
注:与同组术前比较,*P<0.05;与对照组同时间点比较,△P<0.05
组别观察组对照组t值P值VAS评分(分)术前7.32±1.27 7.38±1.32 0.721>0.05术后6个月2.23±1.21*△2.68±1.34*2.347<0.05术后12个月1.33±1.06*△1.63±1.15*2.862<0.05
3 讨论
脊柱解剖结构复杂,不同脊柱节段的肿瘤处理难度亦不相同,特别是枕颈处、上颈椎、颈胸及胸腰椎交界区、骶骨等,这些部位解剖结构复杂及力线改变,手术难度和风险较大,手术常常需要多学科协作完成。由于脊柱肿瘤瘤体容易压迫及侵蚀邻近部位神经、脊髓和重要脏器,出现疼痛、麻木、瘫痪等症状;肿瘤侵蚀椎体,破坏脊柱稳定性;同时,因瘤体周围血供丰富造成手术难度大、耗时长、出血多等,这些都可能增加术后并发症的发生率[9-11]。术中尽量减少正常椎体结构破坏的情况下完整、精准地切除肿瘤,准确置钉重建脊柱稳定性,是预防肿瘤局部复发、改善患者生存质量及提高生存率的关键。
建立MDT团队,发挥多学科协作诊疗模式优势,术前共同探讨围手术期的治疗方案。例如:肿瘤血供丰富的患者术前介入科行选择性动脉栓塞;胸腔脏器、主动脉及纵隔的肿瘤需要心胸外科、血管外科同台手术;累及直肠肛管的肿瘤需肛肠外科同台手术;术后肿瘤内科的后续放化疗;根据外科快速康复(ERAS)理念,围手术期的营养管理,疼痛科及麻醉科的多模式镇痛,康复科的术后功能锻炼等。3D打印技术应用于多学科协作模式下辅助完成复杂的脊柱肿瘤手术,既发挥了多学科协作模式的整体观、个性化手术方案的优越性及安全性,又能发挥3D打印技术在术中精准、完整的切除肿瘤,有效缩短手术时间,减少出血量,提升肿瘤切除术的安全性,提高置钉准确率。联合3D打印技术,重建脊柱肿瘤及周围重要组织模型,使术者清晰、直观的掌握肿瘤与周围组织的解剖形态,辅助肿瘤组织精准、完整的切除,尤其对于解剖结构复杂的脊柱肿瘤具有独特的优势。同时,应用逆向工程软件个性化打印3D导板辅助置钉,避开重要血管、神经、脊髓等重要组织,保障置钉的安全性,尤其对于颈胸椎的手术置钉准确率优势更为明显,然而腰骶椎脊柱肿瘤的手术,应用3D打印技术主要是指导肿瘤的精准切除及避免瘤体周围重要解剖结构的损伤。因此,3D打印技术联合多学科协作,为复杂的脊柱肿瘤手术提供了安全保障,设计更加全面而准确、个性化的手术方案,保障围手术期的安全性,现已成为脊柱肿瘤外科手术的发展趋势[12-14]。
本研究通过多学科协作共同制定围手术期治疗方案,术前根据3D打印模型进行手术演练及直观的医患沟通,保障了脊柱肿瘤手术的安全性。3D打印快速成型及逆向工程技术,制作出三维立体直观的个体化脊柱实体模型及椎弓根螺钉导航模板,明显缩短了手术时间、减少手术出血量及术中透视次数,减少对血管、神经、脊髓损伤的风险,增加置钉准确率,保证手术的安全性和精准性。3D打印技术在骨科手术应用中显示出无与伦比的应用前景,随着影像数据采集的组织分辨率逐步提高,3D建模中失真率逐渐下降,3D打印的精度明显改善,导板设计中既能够满足最稳定的导航定位,又能够减少对椎板、棘突等软组织的剥离,3D打印的模型及导板将会更符合实际需求[15-17]。本研究通过多学科协作模式中应用3D打印脊柱肿瘤实体模型及椎弓根置钉导板技术的研究,多学科讨论定制个性化、全面整体的手术方案,保障了围手术期的安全性、有效性,展现了多学科协作诊疗的现代医学模式的优越性;同时证实了数字化、精准化、个性化设计的3D打印脊柱模型及椎弓根螺钉导板,能够提高脊柱肿瘤的切除率及术中置钉的精确性。除此之外,3D打印技术已在众多医学领域获得广泛应用,比如医学教育、定制内置物、假体及生物打印等[18-19]。
应用3D打印制备实体模型及导板也存在一定局限性。首先,个体化精细的3D打印模型及导板对于影像数据资料要求较高,医院应配备高分辨率影像设备;其次,3D打印模型及导板的设计和制作需要一段时间,不实用于急诊手术;再者,模型及导板的设计及制作过程需掌握相应的软件及设备,制作过程复杂,推广难度大;另外,3D打印设计及制作过程中存在难免的误差环节,比如3D模型重建可能出现误差,打印机的精度不高产生的误差等,这些误差均能影响模型的精确性和导板置钉的准确性。同时,本研究存在病例数少、随访时间短等局限性,有待进一步前瞻性随机对照研究,需进一步对相同部位及节段脊柱肿瘤手术时间、出血量的成组对照的统计分析,缺乏大样本病例,需进一步分析对比模拟与实际置钉的配准相关性,以证实本研究的优势及临床推广意义。
