自噬相关蛋白4A对胃癌细胞干性及上皮间质转化的影响
2019-08-26蒋海兵王伟盘箐李国庆
蒋海兵 王伟 盘箐 李国庆
南华大学附属第二医院1消化内科,2肿瘤科(湖南衡阳421001);3永州职业技术学院病原生物与免疫学教研室(湖南永州425100)
胃癌是源自胃黏膜上皮细胞的恶性肿瘤,其病死率居中国恶性肿瘤的第2位,可见对人们的生命健康有严重威胁,且发病率尚未见下降趋势。自噬是一个进化上高度保守的细胞降解过程,也是近年来生命研究的热点。正常情况下,细胞自噬有利于维持自身稳态,但发生放化疗、缺血缺氧等情况下,细胞自噬又能起到抑制细胞癌变、保护细胞器和蛋白质的作用。同时也有研究认为,在肿瘤生长的早期阶段,自噬机制能促进肿瘤生长[1]。
目前报道已有30余种不同的自噬相关蛋白参与自体吞噬过程[2]。ATG4蛋白醇是半胱氨酸蛋白水解酶,在促进自噬体成熟中起主要功能性作用。据文献报道,自噬相关蛋白4A(autophagy associated protein 4A,ATG4A)也是半胱氨酸肽酶的一种,是自噬发生过程中的关键分子,而且参与其他疾病调控[3]。此外,ATG4A也被证明在卵巢癌的预后中具有重要作用,以及在肿瘤干细胞特性维持方面具有重要意义[4],然而ATG4A在胃癌中的作用尚不明确。本研究通过对胃癌细胞采用划痕试验、Transwell小室试验、Western Blot等方法进行检测,研究ATG4A对胃癌细胞干性、上皮间质转化(pithelial mesenchymal transition,EMT)的影响。
1 材料与方法
1.1 实验仪器与试剂二氧化碳恒温培养箱(Model 2300),SDS-PAGE蛋白电泳槽(Bio-Rad公司),倒置相差显微镜(CMK40-F200型,Olymqus公司),超纯水仪(Milliipnre公司),DMEM-F12培养基(Gibeo公司),逆转录试剂盒(Fcrmcntan公司),封闭用山羊血清(武汉boster生物技术公司),RIPA蛋白裂解液(江苏beyotime生物公司),BCA蛋白浓度检测试剂盒(Thermo公司),兔抗人Oct4、Sox2抗体(Abc公司),兔鼠抗人ATG4A、GAPDH抗体(Samta Cruz公司),小鼠抗人Bmi-1、vimentin、E-cadherin抗体(BD公司)。
1.2 方法
1.2.1 细胞培养细胞复苏后置于培养箱内(37℃、5%CO2),用含10%胎牛血清的DMEM培养基培养不同胃癌细胞株(SGC-7901、MGC-803、MGC-823、MKN-47),待细胞融合度大概90%时进行传代及后续实验。
1.2.2 慢病毒对ATG4A进行过表达、敲除过表达或抑制ATG4A的慢病毒被克隆至PLvx和PLKO.1载体中,克隆和病毒生产是由药科美生物科技有限公司完成,包括载体构建,病毒包装等。对于过表达ATG4A,将SGC-7901细胞接种至培养皿,待细胞长满80%左右换液,于含有6 μg/mL Polybrene培养基中加入病毒混悬液培养24 h。而对于抑制ATG4A表达,三株ATG4A shRNA慢病毒和对照慢病毒载体被感染到MGC-803中,然后细胞在无抗生素培养基中恢复48 h,培养稳定过表达或抑制ATG4A的细胞;将胃癌细胞株分为为:对照组(干扰及过表达ATG4A空白载体组)、干扰组(Sh-ATG4A-1、2、3)、过表达组(ATG4A-OE)。
1.2.3 划痕试验取对数生长期细胞进行传代接种入6孔板内(密度1×105个/mL),等待细胞长满后采用PBS清洗,沿孔板底部划一条直线,PBS清洗后,加入(含5 mg/L Mitomycin和10%血清)DMEM培养基。倒置显微镜下拍摄并确定划痕边缘区域及相对距离,实验重复3次。
1.2.4 Transwell实验将Matrigel胶稀释后铺于Transwell小室上层内(冰上操作),室温过夜。取在对数生长期的胃癌细胞按照1×105/孔,种入24孔板Transwell中,孵育过夜,待细胞贴壁后,Transwell小室的上室加入200 μL细胞悬液,而将500 μL含胎牛血清的DMEM培养基加入至Transwell下室内。常规培养24 h后,4%多聚甲醛固定Transwell小室底面细胞。结晶紫染色10 min,PBS漂洗,在显微镜下观察并计数。
1.2.5 细胞球的培养取生长良好胃癌细胞(密度2×104个/mL)接种于超低粘附的6孔板中,加入含 EGF 20 ng/mL及B27(1×)的DMEM/F12的干细胞培养基,以获取肿瘤球。2周后,采用显微镜(200×)观察,随机选取5个视野,取平均计数,重复3次。
1.2.6 RT-qPCR检测ATG4AmRNA表达水平按照总RNA提取试剂盒、逆转录试剂盒说明书分别提取各组胃癌细胞总RNA及逆转录合成cDNA模板,取2 μL cDNA用于RT-qPCR反应,独立实验重复3次。用系统软件进行结果分析:样品的相对表达用 2-ΔΔCt表示。
1.2.7 WesternBlot检测 收集不同组胃癌细胞后,用预冷PBS溶液清洗,加入蛋白酶抑制剂和RIPA裂解液后冰浴,高速离心,对上清液采用BCA法测定蛋白浓度。进行SDS-PAGE凝胶电泳,转至PVDF 膜,加适量一抗anti-ATG4A(1∶400)、antisox2(1∶500)、anti-oct4(1∶400)、anti-Bmi-1(1∶400)、anti-vimentin(1∶1 000)、E-cadherin(1∶2 000)在4℃孵育过夜后,加入过氧化物酶(HRP)结合二抗(1∶2 000)室温震荡孵育2 h,经ECL显色后胶片曝光显影,所有实验重复3次。
1.3 统计学分析采用SPSS 20.0软件对数据进行统计学处理。数据以均数±标准差表示。先进行单因素方差分析,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 胃癌细胞株中ATG4A高、低表达的筛选由图1可见,RT-qPCR及Western blot检测结果均证实,MGC-803中ATG4A表达量最高,而SGC-7901中ATG4A表达最低。
2.2 干扰与过表达ATG4A菌株鉴定对胃癌细胞MGC-803干扰ATG4A表达后,与CTAL组相比,ShATG4A-1、ShATG4A-2、ShATG4A-3组中ATG4A蛋白表达明显下降(均P<0.05);而对胃癌细胞SGC-7901过表达ATG4A后,与CTAL相比,ATG4A-OE组中ATG4A蛋白表达明显上升(P<0.05)。见图2。
2.3 胃癌细胞划痕实验比较划痕实验结果发现,干扰 ATG4A 表达后,CTAL、ShATG4A-1、ShATG4A-2、ShATG4A-3组胃癌细胞MGC-803划痕修复率分别为(81.45±7.52)%、(53.54±4.69)%、(60.76±5.47)%、(55.80±5.21)%,与CTAL组相比,ShATG4A-1、ShATG4A-2、ShATG4A-3组划痕修复率明显下降(均P<0.05)。同样,CTAL、ATG4AOE组胃癌细胞SGC-7901的划痕修复率分别为(45.65±5.60)%、(70.12±8.65)%,与CTAL组相比,ATG4A-OE组划痕修复率明显上升(P<0.05)。见图3。
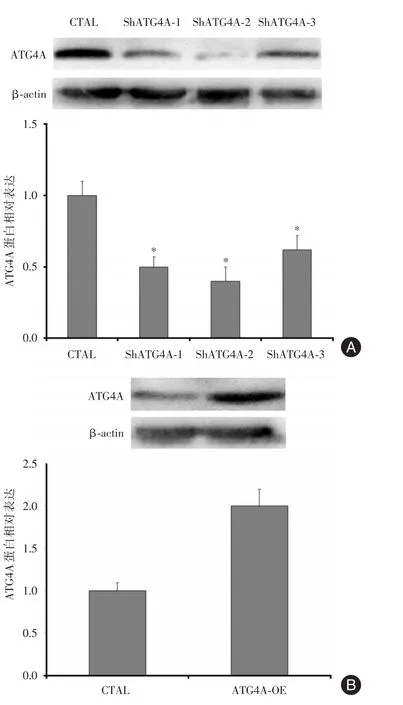
图2 干扰与过表达ATG4A菌株鉴定Fig.2 Identification of ATG4A strain with overexpression and Interference
2.4 Transwell实验结果Transwell实验发现,干扰ATG4A 表达后,CTAL、ShATG4A-1、ShATG4A-2、ShATG4A-3组胃癌细胞MGC-803的穿膜细胞数分别为(282 ± 30)、(190 ± 24)、(142 ± 19)、(202 ± 26),与CTAL组相比,ShATG4A-1、ShATG4A-2、ShATG4A-3组穿膜细胞数明显下降(均P<0.05)。同样,CTAL、ATG4A-OE组胃癌细胞SGC-7901的穿膜细胞数分别为(182±28)、(266±44),与CTAL组相比,ATG4A-OE组穿膜细胞数明显上升(P<0.05)。见图4。

图3 胃癌细胞划痕实验比较Fig.3 Comparison of scratch tests on gastric cancer cells
2.5 胃癌细胞成球培养比较成球培养结果发现,干扰ATG4A 表达后,CTAL、ShATG4A-1、ShATG4A-2、ShATG4A-3组胃癌细胞MGC-803的每个视野成球直径在40~100 μm之间的个数分别为(50±8)、(28±5)、(31±6)、(33±8)。与CTAL组相比,ShATG4A-1、ShATG4A-2、ShATG4A-3组成球细胞数明显下降(均P<0.05);同样,CTAL、ATG4A-OE组胃癌细胞SGC-7901的成球细胞数分别为(12±2)、(17±3)。与CTAL组相比,ATG4A-OE组成球细胞数明显上升(P<0.05)。

图4 胃癌细胞侵袭能力检测Fig.4 Detection of invasive ability of gastric cancer cells
2.6 WesternBlot检测胃癌细胞干性标志物及EMT相关信号分子的影响 由图5A可知,干扰ATG4A表达后,与CTAL组比较,ShATG4A-1、ShATG4A-2、ShATG4A-3组胃癌细胞株MGC-803中SOX-2、OCT-4、Bmi-1蛋白表达明显下降(均P<0.05)。而过表达 ATG4A后,与CTAL组比较,ATG4A-OE组胃癌细胞株SGC-7901中SOX-2、OCT-4、Bmi-1蛋白表达明显上升(均P<0.05),见图5B。
由图5C可知,干扰ATG4A表达后,与CTAL组比较,ShATG4A-1、ShATG4A-2、ShATG4A-3组胃癌细胞株MGC-803中E-cad表达上升,Vim、N-cad表达下降(均P<0.05)。而过表达ATG4A后,与CTAL组比较,ATG4A-OE组胃癌细胞株SGC-7901中E-cad表达下降,Vim、N-cad表达增加(均P<0.05),见图5D。
3 讨论
ATG4A是自噬发生过程中的关键分子,属于半胱氨酸肽酶的一种,且参与其他疾病调控。本实验选取5个细胞株采用Western blot及RT-qPCR法验证不同分化程度的胃癌细胞系中ATG4A分子表达差异,结果显示,高分化胃癌细胞SGC-7901低表达ATG4A分子,而低分化胃癌细胞MGC-803高表达ATG4A。
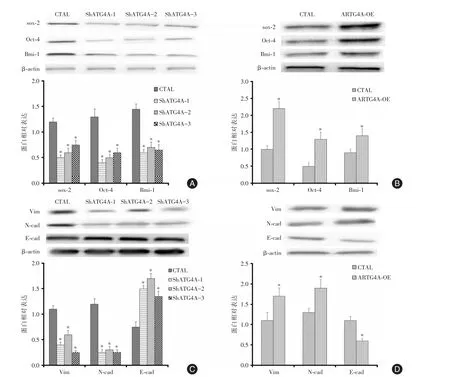
图5 westernblot检测ATG4A对胃癌细胞干细胞特性及上皮间质转化蛋白的影响Fig.5 The effect of ATG4A on the stem cell properties and epithelial-mesenchymal transformation protein of gastric cancer cells detected by Western Blot
目前研究分子生物学的一种重要方法是进行干扰或者过表达,RNA干扰是真核生物体内由双链RNA介导的降解同源RNA的现象,是特异性抑制靶基因表达的一种方法,广泛应用于基因功能研究,其作用主要是基因发生转录后进行调控[5]。在本课题研究中,构建了3个干扰序列(Sh-ATG4A-1、Sh-ATG4A-2、Sh-ATG4A-3)及一个过表达序列(ATG4A-OE),以及相应的空白载体,这部分实验由生物公司完成,还包括进行病毒包装、转染等进行鉴定。实验选择MGC-803细胞进行干扰,即调低ATG4A表达,而对SGC-7901细胞进行ATG4A过表达,通过划痕实验、Transwell小室实验等检测,研究ATG4A表达变化对细胞生物学的影响。
在衡量肿瘤细胞生物学行为方面,迁移能力具有重要意义。有研究指出肿瘤细胞迁移能力与其恶性程度较为一致,迁移能力代表细胞在体内的运动能力,受到细胞自身因素及机体等因素影响[6]。本研究划痕试验结果显示,与CTAL组相比,ShATG4A-1、ShATG4A-2、ShATG4A-3组划痕修复率明显下降,同样与CTAL组相比,ATG4A-OE组划痕修复率明显上升,这表明ATG4A能够促进胃癌细胞迁移能力;在肿瘤细胞侵袭迁移能力检测上,Transwell小室检测法因重复性高,简便易行,是目前广泛被接受细胞侵袭模型。在本实验中,与CTAL组相比,ShATG4A-1、ShATG4A-2、ShATG4A-3组穿膜细胞数明显下降,同样与CTAL组相比,ATG4A-OE组穿膜细胞数明显上升,这表明ATG4A能够增强胃癌细胞侵袭能力。
在肿瘤组织中,有相当一部分具有自我更新能力和异质性的肿瘤细胞亚群,被称为肿瘤干细胞(cancer stem cell,CSC),其在侵袭中的作用是肿瘤侵袭转移研究的重要内容[7-9]。日益增多的实验支持CSC学说,肿瘤干细胞通过无限增殖和自我更新能力促进肿瘤的生长、扩散转移,具有较强新转移灶的克隆形成能力、迁徙能力以及运动能力,但肿瘤干细胞干性在某些因素刺激下能够增强,或者减弱,并非所有细胞干性一致[10-11]。成球能力是判定细胞干性一个重要的方面,研究中发现,与 CTAL组相比,ShATG4A-1、ShATG4A-2、ShATG4A-3组成球细胞数明显下降,同样与CTAL组相比,ATG4A-OE组成球细胞数明显上升。这表明干扰ATG4A表达后,胃癌细胞成球能力下降,而过表达后,其成球能力增强;在本研究中我们选取干细胞特性的蛋白标志物SOX-2,OCT-4,BMI-1进行研究,Western Blot检测也证实,干扰ATG4A表达后,胃癌细胞株MGC-803干性标志物SOX-2、OCT-4、Bmi-1表达明显下降,而过表达ATG4A后,胃癌细胞株SGC-7901干性标志物SOX-2、OCT-4、Bmi-1表达明显上升。这表明ATG4A能够影响胃癌细胞干性,进而调控胃癌细胞侵袭转移。
EMT是上皮细胞来源的恶性肿瘤细胞获得迁移和侵袭能力的重要生物学过程,同时也是指上皮细胞通过特定程序转化为具有间质表型细胞的过程[12-13]。在EMT过程中,许多蛋白的表达水平发生了变化,如间质细胞标志物如神经性钙黏着蛋白(N-cadherin),波性蛋白(Vimentin)表达量上升,而上皮细胞标志物如上皮性钙黏着蛋白(E-cadherin)表达量下降[14]。在本研究中,干扰ATG4A表达后,与CTAL组比较,各干扰组MGC-803细胞中Vimentin,N-cadherin蛋白表达下降,E-cadherin蛋白表达上升,这表明胃癌细胞出现EMT下降现象,同时其侵袭转移能力下降;同样过表达ATG4A后,与CTAL组比较,ATG4A-OE组SGC-7901细胞中N-cadherin,Vimentin蛋白表达增加,E-cadherin蛋白表达下降(均P<0.05),这说明过表达ATG4A具有促进胃癌细胞EMT作用,以及增强胃癌细胞侵袭转移能力。
综上所述,目前研究ATG4A与胃癌细胞间关系的报道很少,本实验通过划痕、Transwell小室试验发现,ATG4A与肿瘤细胞分化程度呈负相关,还能够影响胃癌细胞侵袭转移。通过Western Blot检测发现,ATG4A能影响胃癌细胞干性及EMT,实现对侵袭转移的调控,但具体调控机制尚不清楚,笔者将在后续试验中对此问题开展研究。
