帕瑞昔布钠对神经病理性疼痛大鼠脊髓胶质细胞活化的影响
2019-08-26邓慧周扬徐岩杨静扶超屠伟峰
邓慧 周扬 徐岩 杨静 扶超 屠伟峰
1广州中医药大学南部战区总医院麻醉科(广州510010);2第74集团军医院麻醉科(广东惠州516008)
帕瑞昔布钠是一种非甾体类抗炎药,可以选择性抑制环氧合酶-2(cyclooxygenase-2,COX-2)。COX-2是合成前列腺素(prostaglandin,PG)的重要限速酶之一,炎症反应的重要介质。COX-2抑制剂治疗炎性疼痛已广为人知,但是其作用于神经病理性疼痛的机理尚不清楚。神经病理性疼痛(neuropathic pain,NP)是神经系统原发和(或)继发性损害或功能障碍引起的疼痛,机制十分复杂[1]。研究表明COX-2可能对NP的早期发展起重要作用[2],帕瑞昔布钠可以缓解神经病理性疼痛[3]。同时,胶质细胞作为中枢神经系统的“免疫细胞”,在神经损伤后参与各种免疫炎症反应,抑制胶质细胞激活可以有效防治NP[4]。COX-2是否能通过抑制脊髓背角胶质细胞活化而缓解治疗NP,目前国内外尚缺乏相关基础和临床研究。本研究通过术后即刻鞘内注射帕瑞昔布钠,拟探讨COX-2抑制剂对神经病理性疼痛中脊髓层面胶质细胞活化的影响,以期为非甾体类抗炎药抑制脊髓胶质细胞活化而发挥镇痛作用提供理论和实验依据。
1 材料与方法
1.1 实验动物与分组SPF级雄性SD大鼠50只(180~220 g,购自南方医科大学动物实验中心),随机分为4组:正常对照组(NC组,n=5)、假手术对照组(SC组,n=15)、L5脊神经结扎模型组(SNL组,n=15)、帕瑞昔布钠治疗组(PAR组,n=15)。SC组和SNL组术后即刻鞘内注射生理盐水20 μL,PAR组术后即刻鞘内注射40 μg/μL的帕瑞昔布钠-生理盐水溶液10 μL,然后用10 μL生理盐水冲洗。并在术前、术后第1、3、7 d测量PWT(paw withdrawal threshold,PWT),术后第1、3、7 d取大鼠脊髓腰膨大,免疫组织化学染色观察Iba-1和GFAP蛋白表达水平。实验期间所有大鼠均单笼饲养,自然照明,自由饮食。
1.2 实验试剂与仪器GFAP(GA5)Mouse mAb抗体(3670T,CST);Monoclonal Anti-iba1抗体(SAB2702364,SIGMA);GTVisionTMⅢ抗鼠兔通用型免疫组化检测试剂盒(GK500705,基因科技股份有限公司);触觉测量套件Von Frey纤维丝;注射用帕瑞昔布钠(40 mg)(美国辉瑞制药有限公司,国药准字J20080045;PE-10导管(宁波安来科技有限公司);BX-51显微镜(Olympus公司)。
1.3 鞘内置管与L5脊神经结扎(L5 spinal nerve ligation,SNL)模型制备 无菌条件下对大鼠行鞘内置管:麻醉,将PE-10管平行插入L3-4棘间孔2 cm,大鼠出现甩尾反射且导管内见清亮的脑脊液流出,然后用生理盐水冲管后热熔封管固定。5d后鞘内注射2%利多卡因15 μL,并用15 μL生理盐水冲洗,若出现双后肢运动麻痹,并且在30 min内恢复正常,则视为置管成功。置管成功的大鼠参照文献[5]进行SNL造模,麻醉后暴露并部分咬除左侧L5横突,游离L5背根神经,并以6-0丝线结扎。术后进行PWT测试,剔除运动功能障碍和未出现触觉痛敏的大鼠。SC组暴露L5神经5 min但不结扎;NC组无任何处理。
1.4 机械缩足反射阈值测量根据CHAPLAN[6]的方法,实验前将大鼠置于透明玻璃箱中30 min使之适应实验环境。用von Frey纤维丝测定(PWT),0.008、0.02、0.04、0.07、0.16、0.40、0.60、1.0、1.4,共9个刻度刺激大鼠足底皮肤。出现缩足反应(如舔足、抬腿等)时记为阳性反应X,无反应记为O。如若刺激有阳性反应,则选择低一级别的纤维丝,如果没有反应则选择高一级别的纤维丝。当反应出现阳性反应与隐性反应交替出现,则开始记录反应模式,并再测4次即可。将实验记录的数据输入电脑,计算PWT。行为测试需采用盲法。
1.5 取材及免疫组织化学染色分别对各组大鼠在相应时间点用10%福尔马林和生理盐水进行灌注取脊髓腰膨大,4℃固定24 h后石蜡包埋切片。切片常规脱蜡至水,抗原修复后,封闭后4℃抗体孵育过夜。所用一抗为鼠抗-GFAP(1∶100,Cell Signaling Technology);鼠抗-Iba1(1∶400,Sigma)。滴加二抗,室温孵育30 min,DAB显色后苏木素复染,树脂封片,显微镜下观察。
1.6 统计学方法计量资料均以均数±标准误表示,应用STATA13.1统计软件分析,组间比较采用单因素方差分析(One Way ANOVA),P<0.05为差异有统计学意义。
2 结果
2.1 机械缩足反射阈值变化造模前各组间PWT比较差异无统计学意义;造模后,SNL组、PAR组PWT明显下降(P<0.01),提示机械痛敏产生。且在本实验的观察时间以内(术后1~7 d),SNL组PWT持续低于SC组(P<0.01)。PAR组给药后第1天仍明显低于SC组(P<0.01);第3天与SNL组相比PWT明显升高(P<0.05),第7天时与SC组比较无差异。见图1。

图1 术后即刻鞘内注射帕瑞昔布钠对SNL诱导的机械性痛觉过敏的影响Fig.1 The effect of intrathecal Parecoxib on mechanical hypersensensitivity induced by SNL
2.2 脊髓小胶质细胞变化见图2~3,SNL造模后小胶质细胞在脊髓背角被诱导激活(见图2A)。与SC组相比,SNL组造模后第1、3、7天脊髓背角Iba-1蛋白表达大量上调(P<0.05)。而PAR组脊髓背角Iba-1蛋白表达下调(P<0.05)。
2.3 脊髓星型胶质细胞变化SNL造模后星型胶质细胞在脊髓背角被诱导激活(图4A)。与SC组相比,SNL组造模后第1、3天脊髓背角GFAP蛋白表达上调(P<0.01),第7天恢复正常。给药后第1、3、7天,PAR组脊髓背角GFAP蛋白表达下调(P<0.01),与SC组比较均无差异。见图4~5。
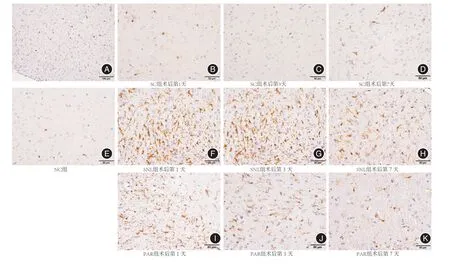
图2 术后即刻鞘内注射帕瑞昔布钠对SNL模型大鼠脊髓小胶质细胞IBA-1蛋白表达的影响Fig.2 The effect of Parecoxib in the activation of microglia induced by SNL

图3 术后即刻鞘内注射帕瑞昔布钠对SNL大鼠脊髓背角中IBA-1蛋白表达的影响Fig.3 The effect of Parecoxib in the expression of IBA-1 protein
3 讨论
本实验选用SNL模型[5],实验结果显示,在造模后24 h内,术侧后足PWT值降低,产生机械性痛敏,并在实验时间1~7 d内维持较低水平,提示SNL手术诱导了快速明显的机械痛觉过敏。造模后24 h,脊髓背角Iba-1蛋白表达上调,第3天达到高峰并逐渐降低,说明SNL造模可以诱导脊髓背角小胶质细胞的激活。而脊髓背角GFAP蛋白在第1天开始表达,并在第7天恢复正常,说明SNL造模也可以诱导脊髓背角星型胶质细胞活化。这与OBATA等报道SNL模型可以导致PWT下降及胶质细胞(星型胶质细胞和小胶质细胞)活化[7-8]结果一致,说明造模成功。
本实验按文献记载实验剂量及预实验结果[9],通过术后即刻鞘内注射40 μg/μL的帕瑞昔布钠-生理盐水溶液10 μL,观察到NP早期鞘内注射帕瑞昔布钠后Iba-1和GFAP蛋白表达明显下调,胶质细胞活化受到抑制,并且术侧后足PWT升高,明显减轻了由SNL诱导的痛觉过敏,缓解了NP急性期疼痛。帕瑞昔布钠是第一个可注射COX-2特异性选择抑制剂[10]。可以迅速被水解成伐地昔布,通过特异性抑制COX-2阻断花生四烯酸合成PG而发挥抗炎镇痛作用,被广泛用于手术后中重度疼痛。以此推测,在NP早期抑制COX-2表达可以通过抑制胶质细胞活化来缓解NP急性疼痛。

图4 术后即刻鞘内注射帕瑞昔布钠对SNL模型大鼠脊髓星型胶质细胞GFAP蛋白表达的影响Fig.4 The effect of Parecoxib in the activation of Astrocyte induced by SNL

图5 术后即刻鞘内注射帕瑞昔布钠对SNL大鼠脊髓背角中GFAP蛋白表达的影响Fig.5 The effect of Parecoxib in the expression of GFAP protein
研究表明,小胶质细胞P38信号途径激活将启动转录因子 NF-κB(nuclear factor κB),合成释放IL-1β、IL-6以及COX-2。这些细胞因子通过自分泌的方式放大小胶质细胞的活化作用,并直接作用于背角神经元使其电活动异常,导致痛敏形成[11]。炎性细胞因子可以诱导中枢神经系统中的突触传递长期改变,并参与NP的发生与发展,而胶质细胞是炎性因子在中枢神经系统中的主要来源[12-13]。以往文献证明神经损伤可以明显激活胶质细胞,并且上调中枢神经系统的促炎性细胞因子的水平,而注射激活的胶质细胞可以使正常大鼠产生NP[14]。本实验中,给予COX-2抑制剂帕瑞昔布钠后,显著抑制了胶质细胞活化。以此,我们可以推测COX-2作为炎症反应中的重要介质,抑制COX-2来抑制胶质细胞活化可能是帕瑞昔布钠缓解急性NP的机制之一。
研究表明,COX-2可以促进PGE2合成,大鼠坐骨神经损伤后,其巨噬细胞的COX-2表达上调引起PGE2增多,而注射特异性COX-2抑制剂NS-398 可以下调PGE2,并且阻断NP[15]。PGE2 在炎性痛和神经病理性痛中发挥重要作用,生理状态下,脑脊液中可以检测到PGE2的释放[16]。研究发现,炎症刺激可以引起中枢神经系统PGE2合成和释放增加,在体外应用P物质会检测到胶质细胞中的PGE2释放,说明PGE2会在胶质细胞中释放。另有实验表明,PGE2可以诱导星型胶质细胞表达脑源性神经营养因子(brain derived neurotrophic factor,BDNF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF),同时促进炎性细胞因子的释放,参与NP[17]。可以推测抑制COX-2,可能使胶质细胞中PGE2合成释放减少,并且炎性因子下调,从而阻断了痛敏的形成。
本实验仅从NP发生早期观察COX-2抑制剂对脊髓胶质细胞的作用,而COX-2抑制剂是否对NP的维持以及其在慢性期是否产生同样作用仍需探索。综上所述,基于前期文献报道与我们的实验研究,帕瑞昔布钠缓解了NP急性期疼痛,其机制可能与抑制脊髓背角胶质细胞的活化,以及神经免疫反应的激活有关,这为COX-2抑制剂治疗神经病理性疼痛提供了新的依据。
