RNA干扰抑制癌胚抗原相关细胞黏附分子1表达对人脑胶质瘤SHG44细胞化疗敏感性的影响
2019-08-26盛旭东李文张俊锋王辉许刚柱
盛旭东 李文 张俊锋 王辉 许刚柱
西安医学院第一附属医院1神经外科,2医疗质量控制科(西安710077)
胶质瘤是中枢神经系统最常见,病死率最高的恶性肿瘤,具有较强的放化疗抵抗。因此,如何提高胶质瘤患者对化疗药物的敏感性,寻找更有效的治疗靶点逐渐成为胶质瘤术后辅助治疗的重点。联用替莫唑胺(temozolomide,TMZ)与生物靶向药物以提高肿瘤疗效和降低毒性反应是近年来的研究热点之一[1-2]。癌胚抗原相关细胞黏附分子1(CEACAM1)在多种肿瘤中具有调节增殖、影响血管生成等作用[3]。笔者前期的实验研究表明干扰CEACAM1基因表达可抑制SHG44胶质瘤细胞的增殖,促进细胞凋亡[4]。本实验利用siRNA技术降低人脑胶质瘤SHG44细胞中CEACAM1的表达,探讨将CEACAM1作为靶点进行基因治疗的可行性,为胶质瘤的综合治疗提供新的思路。
1 材料与方法
1.1 材料人脑胶质瘤SHG44细胞由本实验室保存,Lipofectamine2000(美国 Invitrogen公司),RPMI1640细胞培养液与胎牛血清(美国HyClone公司),RT-PCR试剂盒(日本Takara公司),CCK-8试剂盒(北京索莱宝生物科技有限公司),FITCAnnexinV凋亡检测试剂盒(美国Invitrogen公司),CEACAM1单克隆抗体(美国Epitomics公司);GAPDH单克隆抗体(北京赛诺博公司),替莫唑胺(江苏天士力公司)。
1.2 方法
1.2.1 siRNA的设计与合成以CEACAM1基因为靶基因,采用网上设计软件(http://sirna.wi.mit.edu/)来设计siRNA。其中CEACAM1基因siRNA序列以 5′-CAGCCACAGAAAUAAUUUATT-3′作为正义链,以5′-UAAAUUAUUUCUGUGGCUGTT-3′作为反义链;阴性对照siRNA序列以5′-UUCUCCGAACGUGUCACGUTT-3′作为正义链,以 5′-ACGUGACACGUUCGGAGAATT-3′作为反义链。由上海生物工程公司合成。
1.2.2 细胞培养、转染及分组将人脑胶质瘤SHG44细胞于含10%胎牛血清的RPMI1640中,置于5%CO2、饱和湿度、37℃培养箱内培养,贴壁生长24 h后转染。按照Lipofectamine 2000说明书进行细胞转染。实验分为正常对照组(无干预措施)、阴性对照组(转染阴性对照siRNA)及siRNA干扰组(转染CEACAM1基因siRNA)。
1.2.3 Real time PCR检测SHG44细胞CEACAM1基因表达收集转染48 h后的SHG44细胞,Trizol一步法抽提细胞总RNA,逆转录合成cDNA后用特异引物扩增内参和目的条带,并进行对比。引物序列如下:GADPH上游5′-TTGGTATCGTGGAAGGAC-3′,下游 5′-CAGTAGAGGCAGGGATGA-3′;CEACAM1上游5′-CCACAGTCACAGGAGATAAG-3′,下游5′-AAGACCTCACACCAATACG-3′。用2-ΔΔCt方法分析处理实时定量数据,计算CEACAM1 mRNA的表达差异。实验重复3次,取平均值。
1.2.4 CCK-8实验检测CEACAM1siRNA转染对细胞增殖及化疗敏感性的影响细胞接种于96孔板,于转染后分别培养24、48、72 h,每组设5个平行孔,每孔滴加已配好的CCK-8溶液10 μL,继续培养4 h,以酶标仪于450 nm处读取吸光度A值,计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-实验组A值/对照组A值)×100%。另外将接种于96孔板的细胞加入转染混合液后,立即加入不同浓度TMZ(10、20、40、80 μg/mL),每个剂量组设5个平行孔,继续在5%CO2培养箱中培养48 h,加入CCK-8后于酶标仪450 nm处检测A值。
1.2.5 流式细胞术检测细胞凋亡转染前24 h以每孔1×106个细胞接种于96孔板中,转染及TMZ处理步骤同前,每组设5个平行孔,48 h后胰酶消化,收集细胞,按照细胞凋亡检测试剂盒说明书进行操作,流式细胞仪检测分析。
1.3 统计学方法利用SPSS 18.0统计软件处理数据。计量资料以均数±标准差表示,多组间比较应用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 RT-PCR检测转染siRNA后对CEACAM1mRNA表达的影响 转染48 h后,正常对照组CEACAM1 mRNA表达相对值(0.79±0.08),而siRNA干扰组CEACAM1 mRNA表达相对值为(0.31±0.07),显著低于正常对照组(P<0.01)。正常对照组和阴性对照组两者之间差异无统计学意义(P> 0.05),见图1、表1。
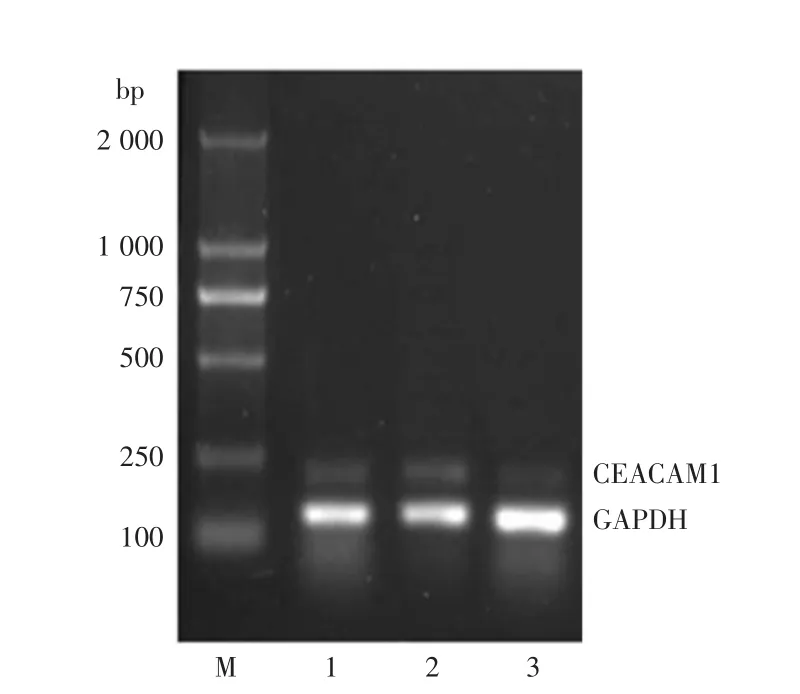
图1 RT-PCR检测siRNA转染后CEACAM1 mRNA的表达Fig.1 The expression of CEACAM1 mRNA after siRNA transfection by RT-PCR
表1 各组细胞中CEACAM1 mRNA相对值比较Tab.1 The comparison of CEACAM1mRNA relative values in different groups of cells ±s
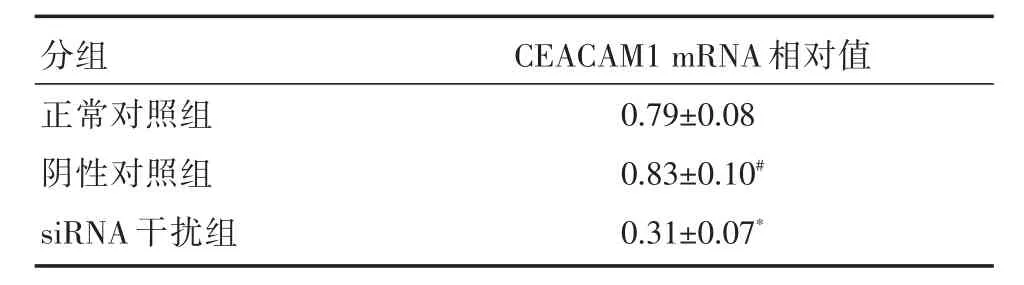
表1 各组细胞中CEACAM1 mRNA相对值比较Tab.1 The comparison of CEACAM1mRNA relative values in different groups of cells ±s
注:与正常对照组比较,#P>0.05;*P<0.01
分组CEACAM1 mRNA相对值正常对照组阴性对照组siRNA干扰组0.79±0.08 0.83±0.10#0.31±0.07*
2.2 CEACAM1siRNA对胶质瘤SHG44细胞增殖的影响CCK-8实验结果显示:转染后24 h、48 h和72 h,siRNA干扰组SHG44细胞的增殖抑制率显著高于正常对照组(P<0.01),而正常对照组与阴性对照组SHG44细胞体外增殖能力之间差异无统计学意义(P>0.05),见表2。
表2 各组细胞增殖抑制率比较Tab.2 The comparison of cell proliferation inhibition rates in each group ± s,%

表2 各组细胞增殖抑制率比较Tab.2 The comparison of cell proliferation inhibition rates in each group ± s,%
组别正常对照组阴性对照组siRNA干扰组24 h抑制率0 5.72±0.87 13.36±1.53 48 h抑制率0 5.45±0.76 27.28±2.48 72 h抑制率0 2.35±0.82 38.08±2.64
2.3 CEACAM1 siRNA对SHG44细胞TMZ敏感性的影响转染后加入不同浓度TMZ处理各组细胞,48 h后酶标仪检测结果显示,各组SHG44细胞的吸光度值均呈下降趋势(表3)。其中采用80 μg/mL TMZ对转染CEACAM1 siRNA后的SHG44细胞进行处理,其增殖抑制率可达57.5%,显著高于未经TMZ处理的正常对照组。正常对照组、阴性对照组与siRNA干扰组SHG44细胞TMZ的IC50值分别为(37.16 ± 5.12)、(36.50 ± 4.68)和(19.34 ± 3.27)μg/mL。siRNA干扰组IC50值明显降低,与正常对照组、阴性对照组比较,差异有统计学意义(P<0.05);正常对照组与阴性对照组的IC50值之间差别无统计学意义(P>0.05),说明干扰CEACAM1表达能抑制SHG44细胞增殖并提高其化疗敏感性。
表3 干扰CEACAM1表达对TMZ处理后SHG44细胞增殖抑制的影响Tab.3 The interference of inhibits proliferation SHG44 cells by CEACAM1 expression after TMZ treatment ± s,μg/mL
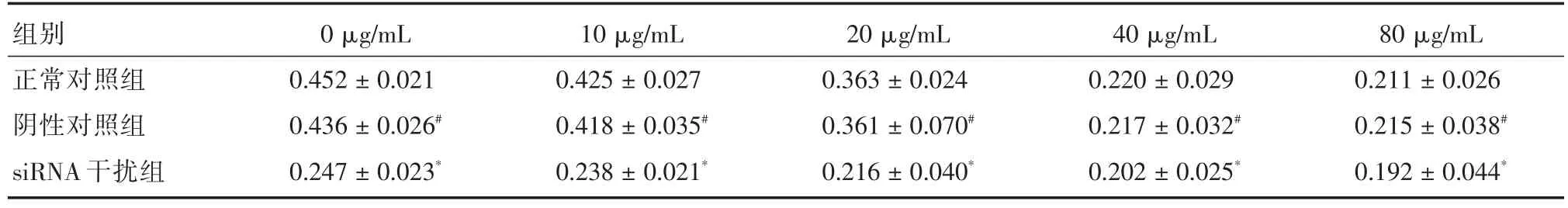
表3 干扰CEACAM1表达对TMZ处理后SHG44细胞增殖抑制的影响Tab.3 The interference of inhibits proliferation SHG44 cells by CEACAM1 expression after TMZ treatment ± s,μg/mL
注:与正常对照组比较,#P>0.05;*P<0.01
组别正常对照组阴性对照组siRNA干扰组0μg/mL 0.452±0.021 0.436±0.026#0.247±0.023*10μg/mL 0.425±0.027 0.418±0.035#0.238±0.021*20μg/mL 0.363±0.024 0.361±0.070#0.216±0.040*40μg/mL 0.220±0.029 0.217±0.032#0.202±0.025*80μg/mL 0.211±0.026 0.215±0.038#0.192±0.044*
2.4 TMZ对转染CEACAM1siRNA后SHG44细胞凋亡的影响 流式细胞仪检测显示,转染CEACAM1 siRNA的SHG44细胞在TMZ(80 μg/mL)作用48 h后凋亡率为(23.61±3.64)%,显著高于正常对照组(11.65±2.38)%和阴性对照组(12.37±2.92)%(P<0.01);与未经TMZ处理的siRNA干扰组(16.27±2.25)%相比较,也是明显增加(P<0.01)。经过TMZ处理的正常对照组和阴性对照组凋亡率之间差异无统计学意义(P>0.05),见表4、图2。
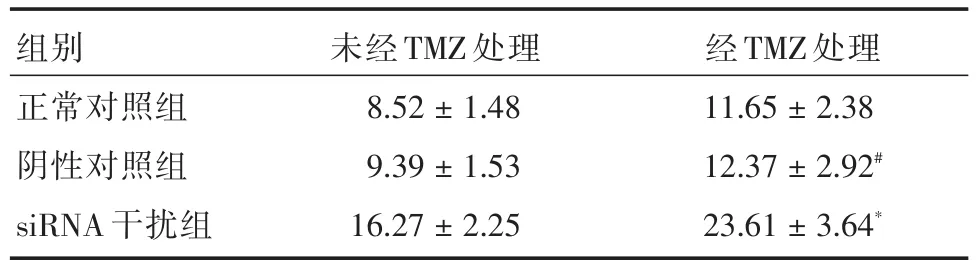
表4 FCM测定TMZ对转染CEACAM1siRNA细胞凋亡率的影响Tab.4 The interference of TMZ on apoptosis rate of CEACAM1siRNA cells transfected by FCM x ± s,%
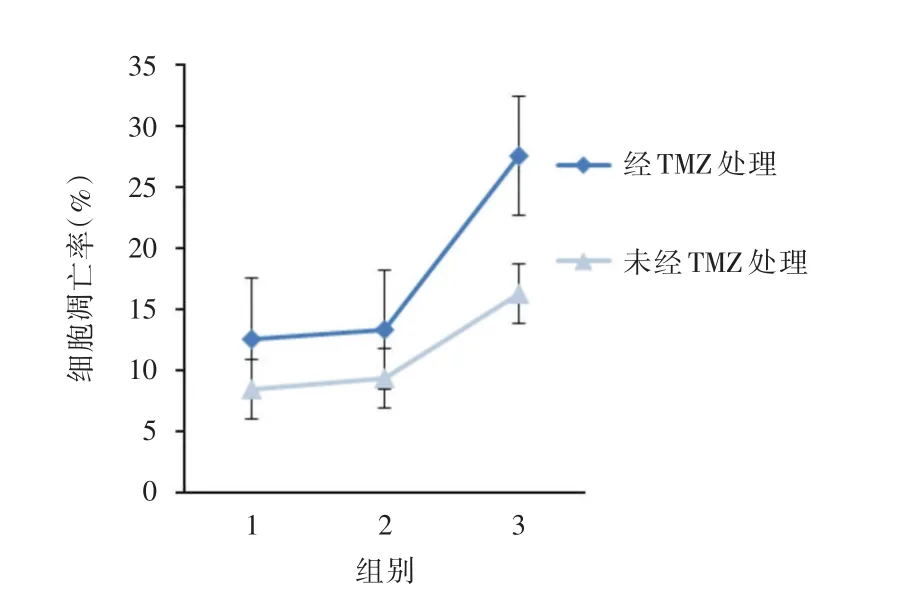
图2 3组SHG44细胞凋亡率比较Fig.2 The comparison of apoptosis rates in 3 groups of SHG44 cells
3 讨论
胶质母细胞瘤是一种恶性的原发性脑肿瘤,对常规疗法具有高度抗性。TMZ是此类患者的一线治疗药物,但这些患者的生存率很低,其中一个很重要的原因就是肿瘤细胞对化疗药物敏感性降低,产生耐药性[5-6]。因此,探讨如何提高胶质瘤细胞化疗敏感性,对于改善此类患者的生存质量具有十分重要的临床意义。为了减少胶质瘤细胞对TMZ的抵制,很多学者进行相关研究。有研究[7]表明honokiol可以通过内在的线粒体依赖性机制增强TMZ诱导的细胞凋亡,从而杀灭神经胶质瘤细胞。PAZHOUHI等[8]发现TMZ和thymoquinone(TQ)联合应用对胶质瘤细胞具有协同细胞毒作用,显着降低了胶质瘤细胞侵袭性,同时使胶质瘤细胞分泌的MMP-2和MMP-9表达水平降低。胶质瘤的发生发展与基因异常导致的细胞分化失调关系密切[9-11]。本团队前期的实验研究表明脑胶质瘤中CEACAM1表达上调,CEACAM1与胶质瘤的发生、发展密切相关,其表达可影响肿瘤生物学行为[12]。进一步深入探讨和研究CEACAM1与胶质瘤化疗敏感性的关系,能够加深对该基因特性的了解,为判断能否将CEACAM1作为胶质瘤基因治疗的靶点提供一定的依据。
在本实验中,合成针对CEACAM1的特异性siRNA,对SHG44细胞株进行转染,RT-PCR检测结果显示,转染后SHG44细胞中CEACAM1基因表达显著降低,提示CEACAM1基因表达被抑制。CCK-8实验结果显示,转染后24、48、72 h,siRNA干扰组的SHG44细胞增殖抑制率高于同时间点正常对照组,差异具有统计学意义。另外的细胞培养实验表明,采用不同浓度TMZ对CEACAM1 siRNA转染后的胶质瘤SHG44细胞进行处理,发现siRNA干扰组的增殖较未转染的正常对照组细胞明显减慢。此外,siRNA干扰组SHG44细胞对TMZ的IC50值明显降低,提示CEACAM1 siRNA可提高胶质瘤细胞对TMZ的敏感性。流式细胞术检测结果显示,CEACAM1siRNA转染后SHG44细胞凋亡率明显高于正常对照组、阴性对照组,三组细胞在应用TMZ处理后凋亡率都有所增加,其中siRNA组的凋亡率可达到(23.61±3.64)%,显著高于未经TMZ处理的siRNA干扰组和经TMZ处理的正常对照组SHG44细胞,说明CEACAM1siRNA与TMZ联合作用可显著促进胶质瘤SHG44细胞的凋亡。
本实验在脑胶质瘤细胞中通过应用RNA干扰技术并结合TMZ治疗,阻碍了胶质瘤SHG44细胞的增殖过程,诱导肿瘤细胞凋亡,并且抑制CEACAM1表达可以提高胶质瘤细胞的化疗敏感性,从而为临床治疗胶质瘤提供了新的思路及实验依据。然而本实验只是针对SHG44细胞一个细胞株进行的研究,有研究报道在胶质母细胞瘤的细胞株中,如 U251、U373、SNB19,虽然种属相同但其对化疗药物的敏感性不尽相同[13],下一步实验尚需在其它胶质瘤细胞株中进行进一步的检测,更加深入探讨CEACAM1在胶质瘤中的改变对TMZ化疗效果的影响及其机制。
