阿魏酸通过抗凋亡途径改善戊四氮诱导的癫痫鼠的脑神经损伤
2019-08-26张淑红张金波刘东海金绍静王淑秋朱金玲
张淑红 张金波 刘东海 金绍静 王淑秋 朱金玲
佳木斯大学基础医学院(黑龙江佳木斯154007)
癫痫是一种常见的反复发作的慢性脑部疾病[1],目前临床癫痫治疗主要包括抗癫痫药物治疗以及手术治疗。常用药物副作用比较小的主要是卡马西平和奥卡西平,但长期使用会导致抗药性,因此开发新的抗癫痫药物以获得更好的疗效一直倍受关注。阿魏酸(ferulic acid,FA)是一种植物内富含的酚类化学物质[2],FA具有多效生物活性,包括抗炎、抗氧化和抗凋亡等特性[3]。FA对脑损伤、脊髓缺血和阿尔茨海默病样病理具有神经保护作用[4-5]。FA还能增加细胞色素c的稳定性,从而抑制细胞凋亡[6]。目前阿魏酸钠已在临床应用于心脑血管疾病的治疗,没有发现明显的副作用,另有研究[7]证明,FA可以减少过氧自由基诱导的海马神经细胞死亡,减少蛋白质氧化和脂质过氧化诱导的羟基自由基。2017年REN等[8]通过细胞水平和动物体内研究发现FA可通过抗氧化和抗凋亡机制对脑缺血/再灌注损伤发挥神经保护作用。目前关于FA的抗癫痫研究少见,一项研究[9]结果显示FA具有抗癫痫作用,可预防由戊四氮点燃引起的氧化应激和认知障碍。癫痫持续发作可导致患者脑神经元细胞凋亡,Bcl-2和Bax是凋亡途径的关键因子,为此本研究选择FA作为治疗癫痫的药物,探讨其在PTZ诱导的癫痫发作模型中的神经保护作用,以及FA是否通过抗凋亡途径起作用,为FA在临床的应用提供理论依据。
1 材料与方法
1.1 动物及分组2017年9月15日从哈尔滨医科大学实验动物学部购置清洁级雄性Wistar大鼠[体质量(200±20)g,黑龙江省佳木斯大学实验动物中心(动物使用许可证编号为SYXK(黑)2016-014)],房间温度为(22±2)℃,自由获取食物和水。将60只大鼠随机分成5组(n=12):生理盐水组,大鼠仅注射生理盐水;戊四氮组(PTZ组),大鼠仅注射PTZ(35 mg/kg,腹腔注射);低剂量FA组(25 mg/kg,腹腔注射);中剂量FA组(50 mg/kg,腹腔注射);高剂量FA组(100 mg/kg,腹腔注射)。低剂量FA组、中剂量FA组、高剂量FA组在注射PTZ前30 min分别注射不同浓度的FA。各组均在每日中午12时给药,连续28 d。药物浓度根据文献[10-11]选择。连续3 d Racine评分在4或5分以上的大鼠视为癫痫大鼠模型建造成功。本研究得到佳木斯大学伦理道德委员会批准(批准编号:JMSU-222)。
1.2 主要试剂FA购于上海源叶生物科技有限公司;PTZ由Sigma提供;Bcl-2和Bax等抗体购自武汉博士生物工程有限公司;245广谱蛋白Marker,10×转膜液,20×TBS购于北京索莱宝科技有限公司;BCA试剂盒、ECL化学发光液购于上海碧云天生物技术有限公司,DAB试剂盒购于北京中衫金桥生物技术有限公司;其他试剂均由分子实验室提供。
1.3 PTZ诱导的癫痫大鼠行为评估将PTZ溶解在盐水中,除生理盐水组外的大鼠均进行PTZ处理后将大鼠置于透明的笼中,观察其惊厥行为30 min。癫痫发作的潜伏期(s),癫痫持续时间(s)和癫痫发作的严重程度(根据Racine评分[12])。如果在30 min内没有观察到癫痫发作的迹象,则最大潜伏期为1 800 s。
1.4 取材在4周结束时麻醉大鼠,然后使用0.01 mol/L磷酸盐缓冲盐水(PBS)进行心脏灌注以洗掉血液。快速断头取出脑并置于冰盘上,分离两个半球。从一个半球切出海马区域并立即在液氮中冷冻以供进一步使用。将另一半球在4%多聚甲醛溶液中固定72 h,然后石蜡包埋,制备海马体的连续冠状切片(4 μm)。
1.5 Hochest33258染色法检测细胞凋亡 石蜡切片经二甲苯及梯度酒精脱蜡后用枸橼酸盐缓冲液(pH 6.0)97℃水浴10 min。PBS洗2遍,每次3 min。加入Hoechst 33258染色液,染色5 min。去染液,用PBS洗2遍,每次3 min。滴一滴抗淬灭封片液,盖上一洁净的盖玻片,尽量避免气泡。使用Olympus荧光显微镜观察,最后用Image pro plus6.0来测量海马神经元的凋亡率。
1.6 WesternBlot法分析Bcl-2和Bax在海马组织中的表达 取出液氮中的海马组织,在含有蛋白酶和磷酸酶抑制剂的冷匀浆缓冲液中匀浆,12 000 r/min离心10 min。除去上清液,稀释至等量的蛋白质(50 μg)并在95℃煮沸4 min。在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳中分离变性蛋白质。将蛋白质转移到醋酸纤维膜上。用含3%脱脂乳的TBST液,在37℃下封闭膜90 min,再4℃下与针对Bax和Bcl-2的特异性兔多克隆抗体一起孵育过夜。通过在TBST或PBST中洗涤膜3次,每次5 min,除去过量的一抗。将1∶1 000稀释的二抗(抗兔IgG)与膜在室温下温育1 h。将膜在室温下暴露于透明度增强的化学发光试剂(ECL)2 min,并使用ChemiDocMP显现。Tanon GLS软件进行条带强度的检测和定量。
1.7 统计学方法用SPSS 17.0进行统计分析。实验数据表示为均数±标准差,采用方差同质性检验方差是否齐性,当方差齐性时,使用单因素方差检验;当方差不齐时,使用Welch方法进行比较,并将LSD用于多重比较。以P<0.05时为差异有统计学意义。
2 结果
2.1 FA对癫痫发生的影响在评估时间点,与PTZ组相比,FA组的Racine评分显著降低,癫痫发作持续时间显著减少(F=76.51,P<0.01),而癫痫发作潜伏期显著增加(F=67.86,P<0.01),且随着药物浓度的增加显著性增强,见图1。结果表明,FA可以减少或预防自发性癫痫的发生,延长生存期。
2.2 Hochest33258染色法检测细胞凋亡 与PTZ组相比,生理盐水组大鼠的海马CA1区域没有表现出严重的神经元凋亡,统计结果显示,与PTZ组比较,FA以剂量依赖性方式降低了PTZ点燃诱导的海马神经元凋亡率(F=402.01,P<0.01)。不同浓度的FA对PTZ致痫大鼠海马神经元凋亡的影响见图2。

图1 FA对癫痫大鼠癫痫行为的影响(n=12)Fig.1 Effect of FA on epileptic behavior in epileptic rats
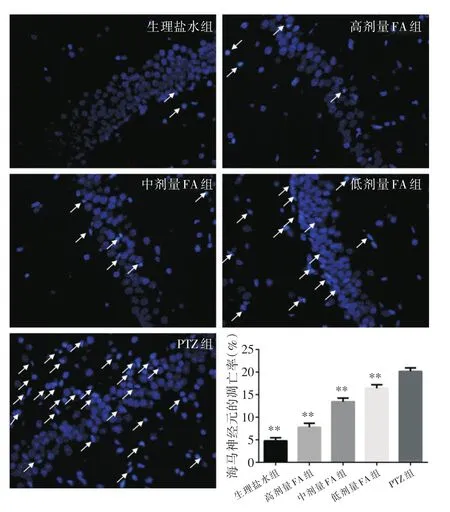
图2 Hochest 33258染色法检测各组大鼠海马神经元细胞凋亡的结果Fig.2 Hochest 33258 staining method for detecting apoptosis of hippocampal neurons in each group
2.3 WesternBlot法检测海马组织中Bcl-2和Bax的表达 与PTZ组相比,生理盐水组和FA组Bcl-2蛋白表达均显著增加(F=27.66,P<0.001);与PTZ组相比,生理盐水组和FA组Bax蛋白表达显著降低(F=62.13,P<0.001),且随着浓度的增加显著性增强(图3)。
3 讨论

图3 各组大鼠海马组织中Bcl-2和Bax的表达结果(n=6)Fig.3 Expression of Bcl-2 and Bax in hippocampus of rats in each group
癫痫是中枢神经系统中最常见的慢性疾病,并且影响全世界至少5 000万人[13]。PTZ点燃大鼠模型模拟人类颞叶癫痫特征:海马萎缩,边缘区域神经元丢失。最近,许多科学家使用点燃模型来研究癫痫的神经生物学,并评估新疗法[14-15]和认知缺陷的有效性[16]。在各类化合物中,天然存在的酚类已引起关注,尤其是FA。许多研究[17-18]报道了FA对脑损伤、脑缺血和阿尔茨海默病样病理改变的神经保护作用,然而,FA对癫痫脑损伤的保护作用报道极少。因此,笔者研究了FA在戊四氮诱导的大鼠癫痫模型中的神经保护作用。
本研究发现FA组与PTZ组相比,Racine评分显著降低,癫痫发作显著减少。且随着浓度的增加,显著性增加。结果表明,FA有效地抑制了PTZ点燃小鼠癫痫发作的严重程度。对癫痫的发作具有明显的改善作用,与REN等[8]的研究结果一致。
Hochest 33258染色结果显示,与PTZ组相比,高、中、低剂量FA组可减轻由癫痫导致的细胞凋亡,且随着FA浓度的增加,凋亡率减低,说明FA可通过减轻细胞凋亡对细胞起保护作用。
为探讨FA抗细胞凋亡的具体途径,本研究进一步检测了细胞凋亡的相关因子Bcl-2和Bax的表达。Bcl-2家族蛋白由促进或抑制细胞凋亡的成员组成,Bax是Bcl-2基因家族的成员,与Bcl-2形成异源或同源二聚体,Bax和Bcl-2作为促凋亡调节因子和抗凋亡调节因子参与多种细胞活动。如果Bax的相对量高于Bcl-2,作为凋亡激活剂起作用,则会促进细胞死亡。相反如果Bcl-2的相对量高于Bax,从而抑制细胞凋亡。本实验结果显示,与PTZ组相比,FA组Bcl-2蛋白表达明显增加,而Bax蛋白表达明显减低,这些结果与之前的研究结果一致[19-20]。且随FA浓度增加或减低显著性增强。
本研究表明,PTZ点燃模型中FA治疗可显著降低强直-阵挛性抽搐和抽搐持续时间,延长其爆发的潜伏期,减少海马CA1区细胞凋亡以及在海马CA1区下调Bax和上调Bcl-2的表达。提示FA可能通过抗细胞凋亡从而减少神经元细胞的损失。但FA的抗凋亡机制有待进一步研究,下一步笔者将选择多个凋亡因子,探讨具体的凋亡路径。总之,本研究表明FA对PTZ诱导的癫痫脑损伤具有神经保护作用。这种保护作用可能是由抗细胞凋亡机制介导的。FA可作为预防癫痫的有效神经保护剂。
