豨桐丸对尿酸钠晶体诱导巨噬细胞NF-κB 活化的影响
2019-08-26贾萍,陈刚
贾 萍, 陈 刚
(1. 重庆医科大学附属第一医院中西医结合科, 重庆400016; 2. 重庆工商大学环境与资源学院制药工程系, 重庆400067)
尿酸盐晶体激发的炎症是痛风核心病理特征[1], 它一旦在关节组织中形成, 则可通过与巨噬细胞、 中性粒细胞、滑膜成纤维细胞等细胞表面的Toll 样受体(TLR) -2、 4 结合[2], 经过一系列信号转导通路而激活NF-κB 抑制蛋白(IκB) 激酶(IKK) 使IκBα 降解, NF-κB 二聚体(主要是p65/p50) 游离后核移位, 与靶基因启动子上κB 序列特异性结合, 启动细胞因子、 粘附分子、 趋化因子等众多炎症介质基因的转录[3]。 因此, 调控NF-κB 活化被公认为是治疗痛风的有效手段之一。
尽管现有抗痛风药物疗效确切, 但不良反应明显, 因此从中医药中探寻有效、 不良反应小的方剂有重要意义[4]。 豨桐丸来源于《济世养生集》 卷三, 具有祛风胜湿、 舒筋活络之功效, 是中医治疗痹症(痛风属于中医“痹症” 范畴) 的经典常用方剂, 课题组前期发现它可抑制尿酸盐诱导大鼠痛风性关节炎发展, 降低关节组织中白细胞介素-1β (IL-1β)、 肿瘤坏死因子-α (TNF-α) 的表达[5]; 可抑制尿酸盐诱导巨噬细胞Nod 样受体蛋白3(NLRP3) 炎性体活化, 以及巨噬细胞产生IL-1β 成熟体;还可抑制尿酸盐诱导的巨噬细胞表达IL-1β 前体, 但其机制迄今仍不清楚。 因此, 本实验选择尿酸盐诱导的小鼠RAW264.7 巨噬细胞株, 观察豨桐丸对IL-1β 表达、 IκBα降解、 p65 蛋白核转移、 NF-κB 与DNA 结合活性的影响,以期阐明该制剂拮抗痛风炎症发展的作用机制。
1 材料
1.1 细胞株 小鼠单核巨噬细胞白血病细胞株RAW264.7购自中国科学院细胞库。
1.2 试药 豨莶草、 臭梧桐叶均购自重庆桐君阁股份有限公司, 经西南大学药学院张继芬副教授鉴定为正品。 IL-1β酶联免疫检测试剂盒(美国R&D 公司, 批号673827); 金丝桃苷、 奇壬醇对照品(四川省维克奇生物科技有限公司, 批号201018、 201153); 秋水仙碱(美国Sigma 公司,批号1002048038); ECL 试剂(美国Milipore 公司, 批号1331501); p65、 IκBα、 β-actin、 Lamin B1 抗 体 (美 国Santa Cruz 公 司, 批 号B2125、 F2014、 C2011、 B2255);RIPA 裂解液 (上海碧云天生物科技有限公司, 批号110317180212); p65 与DNA 结合活性检测试剂盒(美国Active Motif 公司, 批号521478932)。
1.3 仪器 Infinite M200 型酶标仪(美国Bio-Tek 公司);ChemiDoc XRS 型成像系统(美国Bio-Rad 公司); RC24 型高速冷冻离心机(美国Thermo Scientific 公司); Mill-iQ 型纯水系统(美国Millipore 公司)。
2 方法
2.1 细胞培养 RAW264.7 细胞培养于含10%胎牛血清的DMEM 培养基中(含100 U/mL 青霉素、 100 μg/mL 链霉素), 37 ℃、 5%CO2下培养。
2.2 豨桐丸制备 取豨莶草、 臭梧桐叶各500 g, 置于10倍体积蒸馏水中浸泡1 h 后煮沸提取1 h, 重复3 次, 合并提取液, 经过滤、 浓缩并真空冷冻干燥后得到固体提取物,密封保存于-20 ℃下。 临用前, 用DMEM 培养基配制成4 mg/mL母液, 0.22 μm 微孔滤膜过滤除菌后备用。
2.3 尿酸盐晶体制备[6]4 g 尿酸溶于800 mL 双蒸水中,加热溶液至60 ℃后用0.5 mol/L NaOH 溶液调节pH 至8.9, 4 ℃冰箱中过夜, 4 000 r/min 离心20 min, 收集沉淀, 即得, 高压灭菌、 烘干。 临用前, 在无菌条件下用DMEM 培养基配制成2 mg/mL 母液备用。
2.4 细胞活力检测 采用MTT 法。 RAW264.7 细胞以1×104/孔的密度培养于96 孔板中, 24 h 后将细胞随机分为对照组、 实验组(25、 50、 100、 200、 400、 800 μg/mL),继续培养24 h。 加入MTT 至终质量浓度为0.5 mg/mL, 继续培养4 h, 弃培养液, 每孔加入200 μL DMSO, 于570 nm波长处检测吸光度, 计算细胞活力, 公式为细胞活力=(实验组吸光度/对照组吸光度) ×100%。
2.5 细胞培养液中IL-1β 水平检测 采用ELISA 法。RAW264.7 细胞以1×105/孔的密度培养于96 孔板中, 24 h后将细胞随机分为对照组、 模型组(200 μg/mL)、 秋水仙碱组(阳性对照, 0.4 μg/mL 秋水仙碱+200 μg/mL 尿酸盐, 临用前用DMSO 溶解成200 mg/mL 母液, 最终培养体系中DMSO 终浓度为0.1%) 及豨桐丸低、 中、 高剂量组(100、 200、 400 μg/mL 豨桐丸+200 μg/mL 尿酸盐)。 上述药物预作用2 h 后, 加入尿酸盐继续培养18 h, 取细胞培养液, 12 000 r/min 离心5 min, 按照ELISA 检测试剂盒说明书检测IL-1β 水平。
2.6 细胞总蛋白、 核蛋白提取制备 RAW264.7 细胞以1×105/孔的密度培养于96 孔板中, 24 h 后将细胞分为对照组、 模型组(200 μg/mL)、 秋水仙碱组 (阳性对照药,0.4 μg/mL 秋水仙碱+200 μg/mL 尿酸盐) 及豨桐丸低、中、 高剂量组(100、 200、 400 μg/mL 豨桐丸+200 μg/mL尿酸盐)。 上述药物预作用2 h 后, 加入尿酸盐刺激30 min(用于IκBα 检测) 或2 h (用于p65、 NF-κB 与DNA 的结合活性检测)。 收集细胞, 冰预冷PBS 缓冲液(pH=7.4)洗涤3 次后, 按照文献[7] 方法提取总蛋白(用于IκBα检测) 或核蛋白(用于p65、 NF-κB 与DNA 的结合活性检测), 于-70 ℃下保存备用。 然后, BCA 法检测蛋白浓度。
2.7 细胞中IκBα 表达及胞核中p65 表达检测 采用Western blot 法。 取细胞总蛋白或核蛋白提取物, SDSPAGE 电泳后转移蛋白至PVDF 膜, 5%脱脂奶粉于室温下封闭1 h, 然后分别与IκBα、 p65、 β-actin、 Lamin B1 抗体在4 ℃下共同孵育过夜, 再与相应的Ⅱ抗于室温下共同孵育1 h, 加入ELC 试剂显影、 检测。
2.8 p65 与DNA 结合活性检测 取提取的胞核蛋白, 按照Trans AMTMNF-κB p65 活性检测试剂盒说明书进行检测,于450 nm 波长处测定吸光度。
2.9 统计学分析 通过SPSS 18.0 软件进行处理, 数据以) 表示, 组间比较采用单因素方差分析。 P<0.05 有显著性差异。
3 结果
3.1 提取物制备 1 000 g 豨桐丸共得到固体提取物208 g,提取率20.8%。 HPLC 法测得奇壬醇、 金丝桃苷含有量分别为1.36、 0.22 mg/g。
3.2 豨桐丸对RAW264.7 细胞活力的影响 25 ~
400 μg/mL豨桐丸细胞活力与对照组比较均无显著差异(P>0.05), 故本实验确定剂量100、 200、 400 μg/mL。
3.3 豨桐丸对IL-1β 水平、 p65 与DNA 结合活性的影响表1 显示, 与对照组比较, 模型组IL-1β 水平、 p65 与DNA 结合活性显著升高(P<0.01); 与模型组比较, 豨桐丸(200、 400 μg/mL) 组两者显著降低 (P <0.05, P <0.01)。
表1 豨桐丸对IL-1β 表达、 p65 与DNA 结合活性的影响s, n=3)
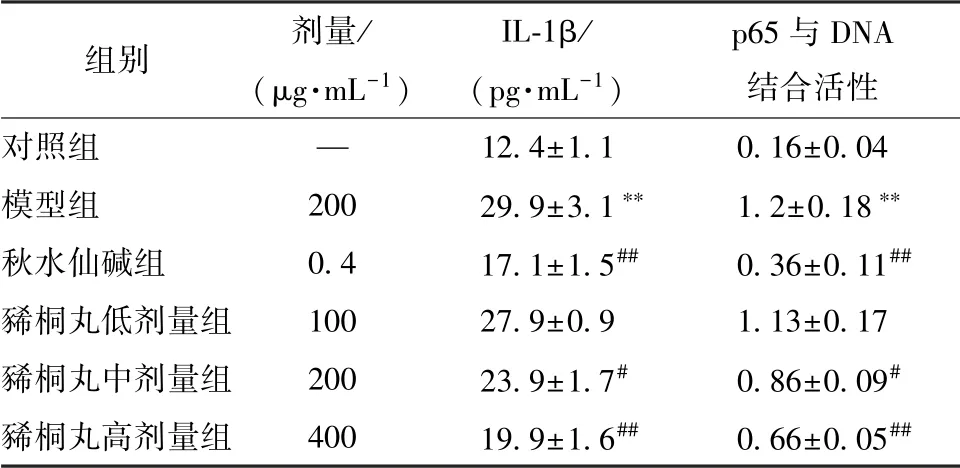
表1 豨桐丸对IL-1β 表达、 p65 与DNA 结合活性的影响s, n=3)
注: 与对照组比较, **P <0.01;与模型组比较,#P <0.05,##P<0.01
组别 剂量/(μg·mL-1)IL-1β/(pg·mL-1)p65 与DNA结合活性对照组 — 12.4±1.1 0.16±0.04模型组 200 29.9±3.1** 1.2±0.18**秋水仙碱组 0.4 17.1±1.5## 0.36±0.11##豨桐丸低剂量组 100 27.9±0.9 1.13±0.17豨桐丸中剂量组 200 23.9±1.7# 0.86±0.09#豨桐丸高剂量组 400 19.9±1.6## 0.66±0.05##
3.4 豨桐丸对IκBα、 p65 表达的影响 表2、 图1 显示,与对照组比较, 模型组IκBα 表达显著降低(P <0.01),p65 表达显著升高(P <0.01); 与模型组比较, 豨桐丸(200、 400 μg/mL) 组前者表达显著升高(P<0.01), 后者表达显著降低(P<0.05, P<0.01)。
表2 豨桐丸对IκB、 p65 表达的影响, n=3)

表2 豨桐丸对IκB、 p65 表达的影响, n=3)
注:与对照组比较, **P <0.01;与模型组比较,# P <0.05,##P<0.01
组别 剂量/(μg·mL-1)IκBα/β-actin p65/Lamin B1对照组 — 0.14±0.02 0.51±0.12模型组 200 0.01±0.002** 2.98±0.19**秋水仙碱组 0.4 0.11±0.02## 0.81±0.1##豨桐丸低剂量组 100 0.01±0.003 3.04±0.14豨桐丸中剂量组 200 0.06±0.02## 2.41±0.11#豨桐丸高剂量组 400 0.09±0.03## 1.21±0.18##
4 讨论
大量研究证实了IL-1β 在痛风炎症过程中的关键作用[8], 它可促进中性粒细胞向尿酸盐沉积的部位迁移, 从而诱导痛风急性发作; 也可激活多种炎性细胞中的转录因子NF-κB, 诱导大量炎性介质基因, 如细胞因子、 黏附分子、 趋化因子等的转录; 还与关节局部破骨细胞活化、 神经元介导机体对炎性疼痛的过度敏感等病理变化密切相关[9]。 临床试验也表明, IL-1β 拮抗剂, 如rilonacept[10]、anakinra[11]和canakinumab[12]均表现出良好的抗痛风疗效,故拮抗IL-1β 产生或功能被认为是治疗痛风的有效手段。
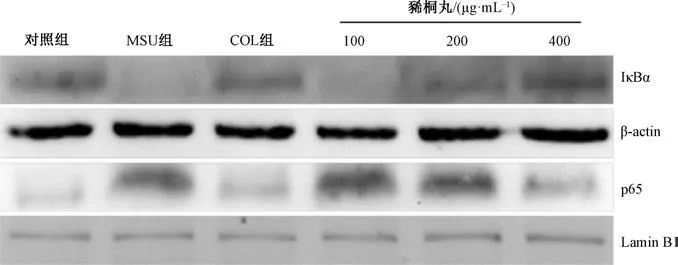
图1 各组IκB、 p65 表达
尿酸盐诱导IL-1β 产生的分子机制已被基本阐述清楚[13], 关节局部沉积的尿酸盐可被滑膜成纤维细胞、 巨噬细胞等识别而被吞噬, 该病理过程主要由TLR2/TLR4-MyD88 信号分子介导[14]。 当尿酸盐刺激信号转入细胞内后, 一方面可激活IKK, 使IκB 发生泛素化降解, 进而使p65 蛋白游离并进入细胞核, 最终诱导大量炎性介质基因的转录, 如细胞因子、 黏附分子、 趋化因子等[3]; 另一方面,它可活化NLRP3 炎性体, 激活caspase-1, 后者将无活性的pro-IL-1β (31 kD) 剪切成有活性 的IL-1β 成熟体 (17 kD)[15]; IL-1β 被分泌到细胞外后, 可与众多炎性细胞表面的IL-1R 结合, 导致NF-κB 激活, 最终诱导与放大尿酸盐激发的炎症信号。
本实验表明, 尿酸盐刺激后巨噬细胞培养液中有大量IL-1β, 提示它诱导了巨噬细胞IL-1β 基因转录表达; 预先给予豨桐丸处理后, 其培养液中IL-1β 水平明显减少, 提示该制剂显著抑制了尿酸盐诱导巨噬细胞中IL-1β 基因的转录表达。 进一步发现, 尿酸盐刺激可导致巨噬细胞中IκB表达明显减少, 表明尿酸盐诱导了巨噬细胞中其蛋白泛素化降解。 静息状态下, IκB 与NF-κB (p65/p50 二聚体) 相结合, 抑制了后者活化, 一旦IκB 降解, 则使p65 发生核转移而启动促炎基因的转录表达。 本实验发现预先给予豨桐丸处理后再用尿酸盐刺激时, RAW264.7 细胞核中p65表达及p65 与DNA 结合活性均明显降低, 表明该制剂可抑制了尿酸盐诱导的p65 核转移及转录活性。
综上所述, 豨桐丸可降低尿酸盐刺激的巨噬细胞表达IL-1β, 其机制可能与抑制NF-κB 活化密切相关, 以期为该制剂临床治疗痛风提供参考, 为研发相关新药提供依据。
