中药注射剂类过敏反应机制的研究进展
2019-08-26杨艺帆谢家骏宋艳荣黄怡文
杨艺帆, 谢家骏, 陈 锰, 宋艳荣, 黄怡文
(上海中医药大学创新中药研究院, 上海201203)
中药注射剂是中药现代化的一种创新型制剂, 它突破了中药传统给药方式, 具有生物利用度高、 作用迅速的特点, 在临床疾病治疗上有着独特优势[1]。 但随着中药注射剂临床广泛应用, 关于不良反应的报道也日益增多, 其中过敏样症状发生频率较高, 其中有77%是由类过敏反应造成的[2]。
类过敏反应症状涉及全身多个系统, 包括皮肤、 黏膜、消化、 循环等, 与I型过敏反应症状相似, 临床上难以区分。 药物I型过敏反应与类过敏反应同属于速发型过敏反应, 通常发生在给药后30 min 内[3], 但两者激发机制不同, 前者是由特异性IgE 介导的免疫反应, 反应程度与剂量无关, 主要取决于个体差异和遗传背景; 后者并不属于抗原抗体结合的免疫反应, 故不需要潜伏期和致敏过程,首次给药即可产生过敏样症状, 并具有一定量效关系, 而且不同药物引发类过敏反应的途径也有所差异。
目前, 临床对易引发I型过敏反应的药物可采取皮肤敏感试验或脱敏治疗等方法来预防[4], 但类过敏反应尚未找到行之有效的预防手段, 关于其发病机制的文献报道也较少。 因此, 开展对中药注射剂类过敏反应机制的研究,不仅可为其非临床安全性评价研究提供理论依据, 而且对针对其机制制订预防措施、 开发防治药物等均具有积极意义。 本文对目前几种类过敏反应的机制途径进行概述, 并列举近几年中药注射剂相关研究情况, 以期为今后进一步探索提供参考。
1 中药注射剂对肥大细胞脱颗粒的直接作用
肥大细胞是导致过敏样症状发生的最重要的效应细胞,广泛分布于血管组织及平滑肌、 神经、 腺体周围[5], 其胞质颗粒中储存了多种炎性介质, 释放后可在靶组织内诱发速发型过敏反应。 临床中所涉及到的速发型过敏反应包括I型超敏反应、 类过敏反应2 类, 其最主要的区别在于IgE是否参与。
I型超敏反应由特异性IgE 介导, 抗原可诱导IgE 聚集, 并与肥大细胞表面高亲和力受体FcεRI结合[6], 使胞内段及衔接蛋白LAT 的酪氨酸(Y) 磷酸化。 一方面, 通过生长因子受体结合蛋白2 (Grb2) 激活MAPK 相关信号通路, 或者通过PI3K-AKT 途径间接激活, 最终促使磷脂酶A2 (PLA2) 活化, 促进花生四烯酸等活性物质生成;另一方面, 可通过激活磷脂酶C 的γ 链(PLCγ) 介导磷脂酰肌醇途径, 引起蛋白激酶C (PKC) 激活以及胞内钙离子浓度升高诱发肥大细胞脱颗粒, 释放活性介质作用于效应部位, 从而引起过敏反应[7]。
对于非IgE 依赖的类过敏反应, 机体内腺苷、 补体C3a、 C5a、 神经肽、 细胞因子、 趋化因子、 其他炎症产物等均可直接刺激肥大细胞脱颗粒[8]。 除了这些内源性介质外, 一些外源性物质, 如compound 48/80 (C48/80)、 P 物质(神经肽类物质)、 清开灵注射剂、 注射用维生素K1 等也可直接刺激肥大细胞脱颗粒[9], 其作用途径与IgE 介导的超敏反应不同, 并非通过传统免疫性反应的受体FcεRI启动信号转导, 而是由细胞表面其他多种受体介导, C48/80 等物质可激活磷脂酶D (PLD) 催化其主要底物磷脂酰胆碱(PC), 生成直接产物磷脂酸(PA) 和间接产物二酰甘油脂(DAG)、 溶血磷脂酸(LPA), 其中PC 为细胞膜磷脂成分, PLD 激活可使其大量水解而改变膜性质, 从而激活G 蛋白偶联受体(GPCR)[10], 激活的GPCR 能促使磷脂酰肌醇-3-激酶(PI3K) 合成继而激活PLCγ1, 4, 5-二磷酸磷脂酰肌醇(PIP2) 水解生成1, 4, 5-三磷酸肌醇(IP3) 和DAG, 以及Ca2+内流并激活PKC, 导致肥大细胞脱颗粒[11]; 直接激活G 蛋白, 通过G 蛋白α、 β、 γ 3 个亚基进一步向下传递信号, 激活磷脂酰肌醇途径, 最终促使细胞内的Ca2+浓度升高, 诱发脱颗粒反应[12]。 同时, PLD激活生成的PA、 DAG、 LPA 是重要的第二信使物质, 与细胞脱颗粒、 钙动员、 特异的蛋白激酶激活等有关[10], 这些外源性碱性肽化合物之所以会诱发类过敏反应, 是因为它在生物体内被水解时会部分残留在细胞表面, 这些带有负电荷的残余物对G 蛋白有激活作用, 从而诱导脱颗粒[11]。 肥大细胞表面分布着多种受体, 在肥大细胞激活中起着重要作用, 是启动级联反应程序诱导肥大细胞脱颗粒的起始。
最新研究发现, 肥大细胞上的MRGPR 是药物诱发类过敏反应的重要受体, 其基因序列属于Mas 相关基因家族,具有7 次跨膜螺旋区域的特性, 故属于GPCR 范畴[13]。2006 年, Tatemoto 等[14]发现该家族中主要分布在人体肥大细胞上的基因MrgX2, 并且检测到C48/80、 P 物质、 肥大细胞脱颗粒肽等基本促分泌素, 可使表达有MrgX2 的肥大细胞脱颗粒, 并且剂量依赖性升高胞内Ca2+浓度; 实验筛选发现, MrgX2 具有非选择性, 多种物质都能通过该受体介导肥大细胞活化。 除了人源性基因外, 还发现了其在小鼠肥大细胞上的同源基因Mrgprb2 和大鼠同源基因Mrgprb3[15], 这些基因的发现促进了对该受体基于整体试验研究的发展。 MRGPR 在感觉神经元、 肥大细胞等易引起疼痛瘙痒的细胞中呈特异性高度表达, 并且与可引起过敏反应等效应的物质具有高度亲和力[16], 它可被促分泌素等阳离子物质(炎性肽、 药物等) 激活, 诱导细胞脱颗粒; 当用C48/80 刺激mMRGPRB2 基因敲除, 但IgE 信号通路正常的小鼠时, 其组胺释放、 炎症、 支气管痉挛等症状消失,表明MRGPR 特异性参与类过敏反应, 而非IgE 介导的免疫应答[17], 故建议开发该受体在类过敏反应中的研究。
类过敏反应的发生非常迅速, 故在反应发生的几分钟内相关指标就会被检测到, Li 等[18]发现, 通过静脉注射进入血液循环的致敏物质主要是与外周组织中肥大细胞相互作用, 从而直接诱发活性介质释放。 由于整体试验难以实现对单一靶细胞作用的独立研究, 故目前主要是通过体外细胞实验来验证该机制的激活情况。 现在可用于类过敏研究的细胞模型非常多, 暂无统一标准, 较常使用的模型包括动物腹腔液中直接分离得到的肥大细胞、 RBL 系列大鼠嗜碱性细胞系, 还可用小鼠肥大细胞瘤细胞系P815、 人外周血嗜碱白血病细胞系Ku812 等进行研究[19]。 另外, 利用药物与肥大细胞共同孵育所释放的活性介质变化情况, 可显示药物诱导肥大细胞脱颗粒的能力, 故该方法大多用于药物类过敏反应的初期筛选。
肥大细胞脱颗粒释放的炎性介质可分为2 类: 一类为预先合成并贮存在分泌性颗粒中的介质, 包括组胺、 硫酸软骨素、 肝素、 类胰蛋白酶等; 另一类是新合成的介质,主要为脂类的花生四烯酸代谢产物, 包括白三烯、 前列腺素D2、 血小板活化因子(PAF)、 多种细胞因子(TNF-α、IL-4、 IL-5、 IL-6、 IL-8、 IL-13 等)[8]。 其中, 组胺半衰期短, 作为早期诊断类过敏反应的指标之一, 它在临床上被誉为急性过敏监测的“金标准”[3]; 类胰蛋白酶是肥大细胞中含有量最高的中性蛋白酶, 作为嗜碱性颗粒中含有量最丰富的标记蛋白, 它能特异性表明肥大细胞是否发生脱颗粒反应, 其半衰期长, 但灵敏度较低[20]; β-氨基己糖苷酶是标记肥大细胞脱颗粒反应的特异性蛋白, 其释放与肥大细胞脱颗粒程度一致, 与组胺释放呈正相关, 在体外细胞实验中灵敏度较好, 这3 种脱颗粒产物是目前评价肥大细胞脱颗粒反应最常用的指标。 罗霞等[21]利用RBL-2H3细胞研究几种中药注射液的致敏性时发现, RBL-2H3 细胞与药物孵育后, 上清液中释放出的β-己糖苷酶、 组胺含有量有所增加, 释放量由高到低依次为双黄连注射液、 穿琥宁注射液、 柴胡注射液, 其结果与临床有关中药注射液引起类过敏反应的报道基本一致, 表明这些中药注射液可通过直接刺激肥大细胞脱颗粒来诱发类过敏反应; 关翠雯等[22]使用相同方法对注射液辅料的致敏性进行评价, 发现吐温80 能直接刺激RBL-2H3 细胞脱颗粒, 而PEG400、PEG600、 聚氧乙烯蓖麻油在研究的浓度范围内不能直接刺激细胞脱颗粒, 表明中药注射液的类过敏反应与所添加的辅料有一定相关性, 并且作用机制不尽相同, 不能仅参考体外评价结果, 而需要通过寻找特异性指标来建立更全面的筛选体系。 另外, 研究者还发现了肥大细胞脱颗粒反应发生与胞内Ca2+浓度变化息息相关, 韩森等[23]给予RBL-2H3 细胞注射用双黄连, 发现胞内Ca2+浓度有所升高, 并呈明显的剂量依赖性, 与β-己糖苷酶检测结果一致, 说明它也可作为鉴定类过敏反应的辅助指标; 吴秀等[24]通过Ca2+浓度变化来评价中药注射剂类过敏反应, 发现该方法具有可行性。
对于肥大细胞上的MRGPR, Liu 等[25]对盐酸青藤碱诱导的类过敏反应机制进行研究, 利用基因敲除小鼠及SiRNA 转染技术, 在体内外试验中都证明该成分重要致敏机制是能激活肥大细胞表面MRGPRX2, 从而介导PLC 分子信号通路, 激发Ca2+动员和脱颗粒。 槲皮素具有很好的抗敏作用, 并且可抑制药物引起的类过敏反应, Ding 等[26]发现, 槲皮素能抑制Mrgprx2 激活, 减少Ca2+内流, 降低C48/80、 P 物质等诱导的活性介质释放, 表明MRGPR 是致敏、 抗敏作用的重要靶点, 对毒性研究及药物研发都有着重要意义。
2 中药注射剂对补体途径的激活作用
补体激活引起的肥大细胞脱颗粒是类过敏反应发生的重要机制之一, 也是目前研究最成熟的机制途径。 补体是一组血浆蛋白质, 约有20 余种, 自然条件下以无活性的酶原形式存在, 被激活后分解产生有活性的片段, 其激活一般涉及3 条途径, 见图1。
2.1 经典途径 由抗原抗体复合物激活, 补体分子C1q 识别特定氨基酸残基活化后与C1r、 C1s 组成C1 复合物[27],可专一性地分解补体C4、 C2, 被激活的片段C4b、 C2a 共同构成经典途径中显示酶解活性的C3 转化酶。 然后, 促使C3 裂解产生C3b, 并形成C3bC4bC2a (C5 转化酶) 启动下游级联反应[8]。
2.2 凝集素途径 由甘露糖凝集素(MBL) 和聚糖素启动, 专一性地识别病原体表面碳水化合物, 其中MBL 是一种钙依赖结合蛋白, 结构上与C1q 相似[28], 其识别糖链后激活相关丝氨酸蛋白酶(MASP), 具有类似C1s 的活性,MASP-1、 MASP-2 分别相当于经典途径中的Clr、 C1s, 结合后分解补体C4、 C2, 合成C3 转化酶, 与经典途径的反应过程相似[29]。 凝集素途径发挥作用涉及的病原体主要为细菌、 病毒、 真菌、 寄生虫等[30], 故在药物致类过敏反应研究中较少涉及此途径。
2.3 旁路途径 上述途径产生的C3 转化酶可使C3 分解为C3a、 C3b, 后者与B 因子分解的片段Bb 构成的复合物成为旁路途径的C3 转化酶, C3b 在其诱导下形成C5 转化酶,可将C5 裂解成C5a 和C5b 片段, 其中前者C5a 是过敏毒素, 而后者在补体级联反应中起到关键作用[8]。
2.4 反应机制 补体激活的3 条途径都是由一系列蛋白水解反应驱动, 即将酶原转化成活性酶, 最终形成C3 转化酶, 引发后续级联反应, 可切割C3 至C3a、 C3b, 并且促进更多C3 分子生成以放大C3b 的作用, 后者参与生成C5转化酶, 能将C5 分解为C5a、 C5b, 反应与C3 类似, 同时C5b 会继续介导生成C5b-9 复合物, 为宿主防御反应中的膜攻击复合体(MAC), 可通过结合到细胞膜上嵌入磷脂双分子层中, 诱导细胞上形成孔状结构, 使胞内物质外渗,最终裂解释放出活性介质[24]。 反应中生成的C3a、 C5a 是补体系统引发类过敏反应的主要物质, 称为过敏毒素, 可通过激活介导肥大细胞表面各自的受体来诱导细胞早期脱颗粒释放组胺等活性介质, 同时促进迟发相介质趋化因子释放, 引起血管通透性增加, 并使得平滑肌细胞收缩, 所涉及的通路包括磷脂酶Cβ(PLCβ) 介导的Ca2+动员、 PKC激活, 以及PI-3 K、 细胞外信号调节激酶(ERK) 激活,其中C5a 诱导的信号通路主要是PLCβ相关通路, 而C3a通过3 条通路都可进行信号转导[31-32]。
补体系统的激活在类过敏反应中至关重要, 其作用已被多项研究所证实, 它涉及更多系统的反应, 故难以用细胞模型评价, 而大多通过整体动物模型或血清进行研究。目前, 由于类过敏反应的指导原则还未制定, 所以没有统一标准的动物模型, 常用于类过敏反应的动物, 主要包括小鼠、 大鼠、 豚鼠、 比格犬、 小型猪, 以及猕猴属的恒河猴、 食蟹猴等。 整体动物试验主要是通过药物作用后检测特征补体分子释放的变化情况, 用于反映系统的激活情况。
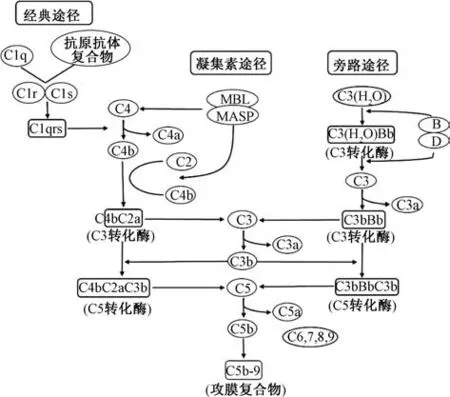
图1 补体激活途径
补体激活后产生的过敏毒素C3a、 C5a 与靶细胞表面受体结合, 激活靶细胞, 促使其脱颗粒释放过敏介质, 故血液中两者含有量, 以及靶细胞表面C3aR、 C5aR 表达也能在一定程度上反映补体激活情况。 补体系统的最终环节会生成攻膜复合物C5b-9, 未插入细胞膜的复合物与S 蛋白(玻璃体结合蛋白) 结合而形成无活性复合体SC5b-9, 因此测定血清中其含有量能直接反映出补体系统激活情况。刘雪莹等[33]将正常人体血清与参麦、 生脉注射液孵育, 发现2 种中药注射液均能使血清中SC5b-9 含有量升高, 证明其激活了补体系统, 该方法简洁高效, 可用于初步验证研究; 陈莉婧[34]也利用该方法验证了不含吐温80 的清开灵注射液不能激活补体系统, 并通过RBL-2H3 细胞证实它是通过直接刺激肥大细胞脱颗粒引发的类过敏反应, 而且主要作用成分是栀子和金银花; 刘婷[35]利用Beagle 犬进行类过敏试验, 对鱼腥草注射液的致敏成分和反应机制进行研究, 通过测定血清组胺、 C5b-9 含有量, 确定其中的主要致敏物质为助溶剂吐温80, 而与鱼腥草蒸馏液本身无关,并且吐温80 类过敏反应机制与补体激活有关, 同时给药后10 min C5b-9 含有量显著升高, 与类过敏反应特征吻合,可作为类过敏反应早期预警指标; Gao 等[36]在研究双黄连注射液的类过敏反应机制时发现, 给予C3a、 C5a 受体抑制剂后, 后者可明显减弱小鼠足部蓝染程度, 而前者没有该作用, 表明双黄连诱发的类过敏反应主要是通过补体系统释放的过敏毒素C5a, 提示抑制过敏毒素特异性受体后可减弱类过敏反应程度, 有望作为预防和治疗类过敏的新方法。
药物激活补体系统诱发类过敏反应主要是通过经典途径和/或旁路途径, 经由级联反应生成过敏毒素诱发肥大细胞脱颗粒[37]。 不同途径参与反应的补体因子有所差异, 同时会产生一些特征性片段, 通过分子生物学方法来检测其含有量变化可判断具体途径参与情况。 Szebeni[38]发现, 补体因子C4d、 Bb 可作为补体经典激活途径和旁路激活途径的特征产物, 测定这2 个指标可反映这两种途径的激活程度, 其中前者是补体经典活化途径中C4 裂解后的产物, 也是补体系统中含有量较高的成分, C4 水解为C4b、 C4a,前者α 链上活性硫酯键与附近含氨基或羟基的分子共价结合后水解为C4c、 C4d, 包含硫酯位点的后者能与毛细血管基膜Ⅳ型胶原、 内皮细胞共价结合, 并较持久地存在, 使其容易检测到, 是评价补体经典途径的代表性指标[39]; B因子特异性地参与旁路途径水解反应产生特征因子Bb, 组成旁路途径的C3 转化酶为C3bBb, 与另2 种途径不相同,Bb 因子是补体旁路途径的代表性指标。 由于目前所研发的补体因子检测试剂盒只能检测人体样本, 故张嘉等[40]采用人血清样本与吐温80 孵育, 检测到C4d 因子含有量无明显变化, 而Bb 因子释放量明显增加, 表明吐温80 可通过激活旁路途径来诱发类过敏反应, 并发现采用不同血清样本时其补体系统的激活程度有所差异, 推测类过敏反应发生与补体、 机体对类过敏物质的敏感性等因素有关, 这也可解释为何并非所有患者在用药后都会出现类过敏反应。
3 其他途径
研究人员发现, 凝血系统和激肽释放酶-激肽系统也可能在类过敏反应中发挥作用, 两者与补体系统同为补体-凝血级联通路组成部分, 并且其激活释放的凝血酶与缓激肽在肥大细胞表面也存在特异性受体, 可介导脱颗粒反应的发生, 这也加大了与类过敏反应相关研究的可行性。
3.1 凝血系统 凝血系统包括外源性、 内源性途径, 其中后者是从凝血因子Ⅻ开始的, 它在血浆中以酶原的形式存在, 当与细胞表面负离子接触时构象发生重排而自动激活,生成FⅫa 启动内源性凝血级联反应, 同时生成凝血酶和纤维蛋白[41]; 纤维蛋白促使凝血酶激活凝血因子ⅩⅢ加速纤维蛋白单体的交联聚合, 生成纤维蛋白多肽[42], 进而引起凝血, 并导致肥大细胞的脱颗粒反应, 释放组胺, 引起血管通透性增加; 凝血酶在类过敏反应中同样发挥着很重要的作用, 它参与气道炎症反应, 并促进成纤维细胞增生[43], 是通过激活肥大细胞表面蛋白激酶受体来发挥作用的; 蛋白激酶受体(PRA) 也属于G 蛋白偶联受体, 包括PAR1~4 型[44], 其中凝血酶能识别PAR-1、 3、 4 激活信号转导途径, 引发的级联反应能促使肥大细胞释放组胺、 蛋白酶、 细胞因子, 以及IL-4、 IL-5 等多种活性介质, 从而引起血管通透性增加, 导致皮肤黏膜水肿等过敏性反应[45], 而PAR-2 是胰蛋白酶和类胰蛋白酶的受体, 与肥大细胞脱颗粒反应密切相关[46]。
3.2 激肽释放酶-激肽系统 凝血因子Ⅻ活化后, 能触发激肽释放酶-激肽系统生成内源性血管活性介质缓激肽(BK) 而发生级联反应。 活化后形成的因子XIIa 够作用于前激肽释放酶使激肽释放酶原(PK) 水解, 得到蛋白激酶A (PKa), 切割高分子激肽原(HK) 从而生成缓激肽;BK 是最有效的血管扩张剂之一, 能诱导释放内源性血管舒张因子, 如NO、 前列环素(PGI2) 等; 缓激肽生物活性是通过介导细胞表面缓激肽受体实现的, 其受体属于G 蛋白偶联受体家族, 包括缓激肽受体1 型(BKR-1)、 缓激肽受体2 型(BKR-2) 2 个亚型, 缓激肽能与后者以高亲和力结合, 瞬时激活磷脂酶Cr1, 从而促使Ca2+内流引发肥大细胞脱颗粒, 而且该信号转导能引起血管通透性增加, 并释放花生四烯酸、 细胞因子、 环磷酸腺苷、 雌激素、 糖皮质激素等介质, 参与各种过敏、 急性疼痛、 急性炎症、 水肿等病理反应, 而前者表达在正常生理条件下很低, 但激活后迅速上调, 使得组织损伤或炎症增加[47-48]。
3.3 研究进展 Xu 等[49]利用蛋白质组学、 代谢组学综合分析血塞通注射液的类过敏反应, 鉴定出13 种蛋白质和28 种代谢产物, 以此寻找潜在的生物标志物, 并通过ELISA 法作进一步验证, Gpx1 (谷胱甘肽过氧化酶-1) 为直接刺激途径标志物, Sc5b9、 C4d、 Bb 为补体途径标志物, F13 (凝血因子ⅩⅢ) 为凝血系统标志物, F12 (凝血因子Ⅻ)、 Kng1 (激肽原-1) 为激肽释放酶-激肽系统标志物。 结果显示, 给予血塞通注射液后Gpx1, Sc5b9、 C4d 表达上调, F12、 Kng1 表达下调, F13 表达无明显变化, 表明该制剂通过直接刺激、 补体途径、 激肽释放酶-激肽系统来诱发类过敏反应, 但未引起凝血系统反应。
4 结语
中药注射剂在临床使用中有其独特的优势性, 作为中药创新剂型因其生物利用度高而在业内受到广泛欢迎, 在20 世纪80 年代品种曾达到1 400 种之多[40], 但随着临床普遍使用, 有关该制剂不良反应的报道也日渐增多, 并由此引发监管机构高度关注, 进而出现对其临床使用安全性的信任危机[50], 以过敏样反应发生率最高, 有77%是由类过敏反应引起的, 其症状表现与I型过敏反应极其相似。类过敏反应是一种非免疫性反应, 出现在首次用药时, 发生机制非常复杂, 相关研究尚处在探索阶段, 故难以复制合适的动物模型, 设置特异的评判指标, 故开展中药注射剂类过敏反应机制的研究对寻找特异性强、 敏感性高的生物标志物有着重要意义, 对推动药物非临床类过敏评价体系的建立, 进而有效保障中药注射剂临床安全性也起着关键作用。
目前, 中药注射剂非临床类过敏机制研究中面临着许多问题: 一是类过敏反应涉及的通路需要检测体内相关因子水平变化才能验证, 但目前市售的相关试剂盒大多只针对人体, 故而非临床研究时只能利用离体试验或寻找间接指标进行替代, 造成结果可靠性降低, 很大程度上限制了药物临床前类过敏反应机制研究的进展; 二是中药注射剂药物成分和作用机制极其复杂, 而市售产品质控程度较低,不同厂商、 批号间存在成分组成及其比例波动较大的情况,甚至难以取得能用于类过敏研究的品种, 研究人员只能利用工具药、 注射用辅料等较为简单成分对类过敏机制进行研究, 难以准确评定类过敏反应强度及其作用机制。 因此,应进一步提高对非临床中药注射剂类过敏反应机制研究重要性的认识, 推动中药注射剂质量控制标准的提升, 加快中药注射剂对动物体内类过敏反应相关因子检测试剂盒的研发和生产, 从而为深入阐明其发生机制, 进而建立快速、敏感、 特异、 稳定、 适用性好的相关评定方法奠定基础。
