异甘草素对结直肠癌细胞增殖、 侵袭和迁移的影响
2019-08-26王志国黄贤明王其亮窦晓静
王志国, 黄贤明*, 赵 雁, 王其亮, 窦晓静, 王 俊, 卢 娜
[1. 青岛市中医医院(海慈医疗集团) 急诊科, 山东 青岛266003; 2. 青岛市中医医院(海慈医疗集团)血液透析室, 山东 青岛266003; 3. 青岛市中医医院(海慈医疗集团) 药剂科, 山东 青岛266003]
结直肠癌是一种常见的消化道恶性肿瘤, 其发病率在全球范围内位于前三位, 其发生的主要因素有遗传、 环境、 生活方式等, 目前常规治疗方法大多为手术、 放疗、 化疗等, 但常出现术后复发和转移、 对放疗不敏感、 化疗抵抗性等现象, 临床疗效不理想[1], 故寻找安全有效的治疗方法和新药成为近年来研究的热点。 目前, 中药及其提取物治疗癌症备受关注[2]。
异甘草素是从甘草中提取出的一种异黄酮类成分, 具有抗氧化、 抗炎、 抗肿瘤作用, 并能扩张动脉, 起到保护心脏、 大脑的作用[3], 可抑制多种消化道肿瘤活性, 如结肠癌、 胃癌等[4], 但其在结直肠癌中抗癌机制目前尚不清楚。 MAPK/ERK信号通路在多种细胞中具有调控细胞增殖、 凋亡、分化、 侵袭、 迁移等非常重要的作用[5-6]。 研究表明在结直肠癌发生发展过程中与MAPK/ERK 信号通路异常激活密切相关[7], 在肝细胞中异甘草素可通过调控MAPK/ERK、 JNK/MAPK 等信号通路激活来发挥抗炎作用[8]。 因此, 本实验探讨异甘草素对结直肠癌细胞、 MAPK/ERK 信号通路的影响, 以期研究其作用机制。
1 材料
异甘草素(含有量大于98%)、 二甲基亚砜购自美国Sigma 公司; 人结直肠癌细胞株HCT116、HT29 购自中国科学院昆明动物研究所; RPMI 1640 培养基、 胎牛血清、 胰蛋白酶、 青霉素、 链霉素购自美国Gibco 公司; Matrigel 购自美国BD 公司; Transwell 小室购自美国Corning 公司; MTT 检测试剂盒、 细胞蛋白裂解液购自上海碧云天生物工程有限公司; Trizol 试剂购自美国Invitrogen 公司;Annexin V-FITC/PI 凋亡检测试剂盒购自日本TaKaRa 公司; BCA 蛋白定量试剂盒、 ELC 发光检测试剂盒购自美国CST 公司; cleaved caspase-3、pJNK、 JNK、 pERK1/2、 ERK1/2、 pP38、 P38 抗体及辣根过氧化物酶标记的二抗购自美国Novus Biologicals 公司。
2 方法
2.1 细胞培养 HCT116、 HT29 细胞培养于含10%胎牛血清的RPMI 1640 培养基(含1% 青霉素、 链霉素双抗) 中, 置于37 ℃、 5%CO2培养箱中培养。
2.2 细胞毒性检测 采用MTT 法。 收集处于对数生长期的HCT116、 HT29 细胞, 以完全培养基将细胞密度调整为5×105/mL, 在96 孔细胞培养板中每孔接种200 μL 细胞, 置于37 ℃培养箱中继续培养, 待细胞贴壁后加入含异甘草素10、 20、 40、60、 80、 100、 120 μmol/L 的培养基, 对照组加入等量培养基, 每个浓度设置3 个复孔。 异甘草素处理48 h 后, 添加20 μL MTT 溶液, 置于37 ℃培养箱中继续孵育4 h, 除去培养液后再加入150 μL 二甲基亚砜, 避光充分混匀, 振荡反应至结晶紫完全溶解, 于570 nm 波长处测定光密度(OD) 值, 计算抑制率, 公式为抑制率= [(1-实验组OD 值/对照组OD 值) ] ×100%, 再计算IC50值。
2.3 HCT116 细胞凋亡检测 采用流式细胞术。取对数生长期的HCT116 细胞, 0.25%胰蛋白酶消化后制成单细胞悬液, 接种于6 孔板中, 密度1×104/mL, 置于37 ℃培养箱中继续培养, 细胞贴壁后分别加入含异甘草素10、 15、 20 μmol/L 的培养基, 对照组加入等量培养基, 各组细胞培养48 h后通过Annexin V-FITC/PI 凋亡检测试剂盒检测细胞凋亡率。 收集各组处理后的细胞, PBS 洗涤2 次,约400 μL 结合缓冲液混匀, 再依次加入Annexin VFITC、 PI 各5 μL, 室温下避光孵育15 min, 流式细胞仪测定HCT116 细胞凋亡率。
2.4 HCT116 细胞中蛋白表达水平检测 采用Western blot 法。 将HCT116 细胞以5×104/mL 的密度接种于6 cm 培养皿中, 置于37 ℃培养箱中培养24 h, 将终浓度10、 15、 20 μmol/L 的异甘草素加到培养基中继续培养48 h, 收集细胞, 加入细胞裂解液, 冰上裂解30 min, 离心并提取细胞总蛋白。BCA 试剂盒对所提取的蛋白进行定量测定, 取35 μg 总蛋白进行10% SDS-PAGE 电泳, 半干法将凝胶上的蛋白转移至PVDF 膜上, 将膜加到含5%脱脂奶粉的封闭液中封闭4 h, 依次加入一抗cleaved caspase-3 (1 ∶1 000 倍稀释)、 pJNK (1 ∶800 倍稀释)、 JNK (1 ∶800 倍稀释)、 pERK1/2 (1 ∶500倍稀释)、 ERK1/2 (1 ∶500 倍稀释)、 pP38 (1 ∶1 000 倍稀释)、 P38 (1 ∶1 000 倍稀释), 4 ℃下孵育过夜, TBST 洗涤3 次, 加入二抗(1 ∶3 000倍稀释), TBST 洗涤3 次后, ECL 化学发光试剂盒进行发光, 转移至暗室中, 在成像仪中曝光拍照,以GAPDH 为内标, 通过Image J 图像分析系统分析各条带灰度值, 以相对灰度值表示待测蛋白cleaved caspase-3、 pJNK、 JNK、 pERK1/2、 ERK1/2、 pP38、 P38 蛋白相对表达。
2.5 HCT116 细胞迁移、 侵袭检测 采用Transwell 实验。 在冰上以不含血清的培养基稀释Matrigel 胶, 将稀释好的基质胶以每孔40 μL 的密度铺于Transwell 小室的上室中, 将小室放到24 孔板中, 置于37 ℃培养箱中静置, 待基质胶完全风干后取出。 将各组HCT116 细胞饥饿24 h, 0.25%胰蛋白酶消化, PBS 洗涤3 次, 无血清培养基重悬细胞, 制成单细胞悬液。 在Transwell 上室加入200 μL细胞悬液(密度为2×105/mL), Transwell 下室中加入含终浓度0、 10、 15、 20 μmol/L 异甘草素的培养基(含10%胎牛血清), 置于37 ℃培养箱中孵育48 h。 取出Transwell 小室, 吸去上室液体,棉签擦去上室未侵袭的细胞, 在Transwell 小室的下室加入500 μL 甲醇固定15 min, 0.1%结晶紫染色15 min, 去离子水洗涤数次后晾干, 倒置显微镜下随机选取5 个视野, 拍照, 计数, 以穿膜细胞数表示HCT116 细胞侵袭能力; Transwell 上室不加Matrigel 基质胶涂层以检测细胞迁移能力, 步骤同上, 并以穿膜细胞数表示HCT116 细胞迁移能力。
2.6 统计学处理 通过SPSS 21.0 软件进行处理,多组差异比较采用单因素方差分析, 组间差异比较采用SNK-q 检验。 以P<0.05 表示差异具有统计学意义。
3 结果
3.1 异甘草素对HCT116、 HT29 细胞的毒性 图1 显示, 不同浓度异甘草素处理48 h 后, 随着其浓度增加对HCT116、 HT29 细胞增殖的抑制率逐渐升高, 在10 ~120 μmol/L 范围内表现出明显的细胞毒性作用, 并呈浓度依赖性, 对两者的IC50分别为22.45、 23.69 μmol/L。 本 实 验 选 择10、 15、20 μmol/L 异甘草素作用于HCT116 细胞, 进行后续研究。
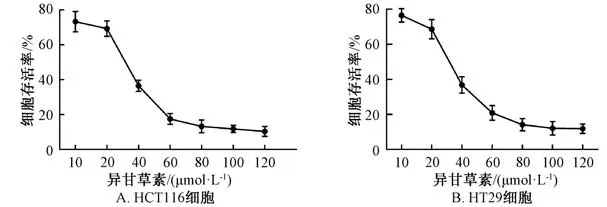
图1 异甘草素对各细胞的毒性Fig.1 Toxicities of isoglycyrrhizin on various cells
3.2 异甘草素对HCT116 细胞凋亡的影响 图2显示, 与对照组比较, 异甘草素组cleaved caspase-3 蛋白表达显著升高(P<0.05); 与对照组比较,异甘草素组细胞凋亡率显著增加(P<0.05), 并呈浓度依赖性。
3.3 异甘草素对HCT116 细胞迁移、 侵袭的影响图3 显示, 与对照组比较, 异甘草素组细胞迁移、 侵袭能力显著下降(P<0.05)。
3.4 异甘草素对HCT116 细胞中MAPK/ERK 信号通路的影响 图4 显示, 随着异甘草素浓度增加,pJNK、 pERK1/2、 pP38 水 平 逐 渐 降 低, pJNK/JNK、 pERK1/2/ERK1/2、 pP38/P38 比值亦然, 与对照组比较差异有统计学意义(P<0.05)。
4 讨论
结直肠癌发病率、 死亡率在世界各国均较高,是影响人类健康和生命的高发性恶性肿瘤之一。 患者死亡率较高的主要原因是复发和远端转移, 故能有效抑制结直肠癌细胞增殖、 转移是关键所在[9]。异甘草素是甘草中含有量较高的一种黄酮类成分,具有广泛的抗病毒、 抑制脂质过氧化、 抗自由基、抗炎、 抗肿瘤等活性, 而且不良反应较少[10], 另外甘草酸、 甘草次酸、 甘草苷也有一定活性[11],该成分可通过靶向调控表皮生长因子受体, 抑制肺癌细胞增殖[12]; 下调细胞血管内皮生长因子表达,抑制乳腺癌诱导的血管生成[13]; 抑制JNK/AP-1信号通路激活, 抑制前列腺癌细胞的侵袭能力[14];降低miR-374a 表达, 抑制异常Akt 信号传导, 从而增加PTEN 表达, 并抑制乳腺癌细胞增殖和转移[15]。 近期研究显示, 异甘草素能通过下调环氧合酶-2 和一氧化氮合酶的表达来阻碍结肠癌发生[16]; 本实验以不同浓度异甘草素干预人结直肠癌细胞, 发现该成分能呈浓度依赖性地抑制结直肠癌细胞的增殖、 转移和侵袭, 并诱导细胞发生凋亡。
caspase-3 作为凋亡执行蛋白, 在细胞凋亡过程中发挥关键作用。 研究表明, 异甘草素能调控肝癌细胞、 脑胶质瘤干细胞、 黑色素瘤细胞中caspase-3 活性, 上调cleaved caspase-3 表达, 诱导细胞凋亡[17-19]; 本实验发现, 异甘草素干预结直肠癌HCT116 细胞后, cleaved caspase-3 表达增强,表明该成分可通过上调其表达来促进结直肠癌细胞凋亡。
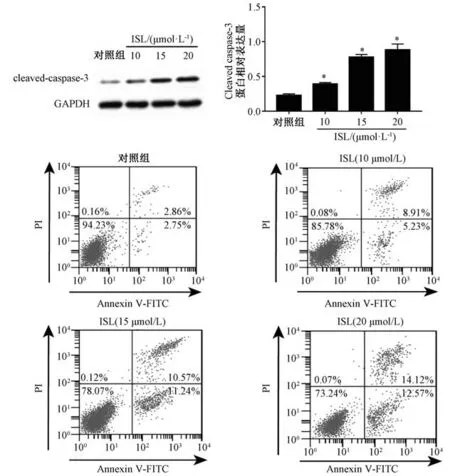
图2 异甘草素对HCT116 细胞凋亡的影响Fig.2 Effects of isoglycyrrhizin on HCT116 cell apoptosis
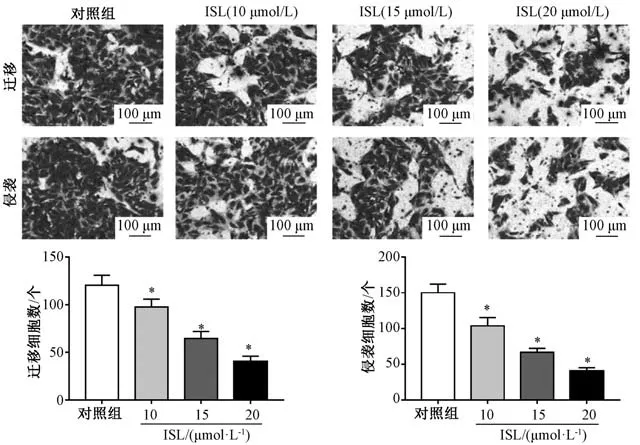
注: ISL 为异甘草素。 与对照组比较,*P<0.05
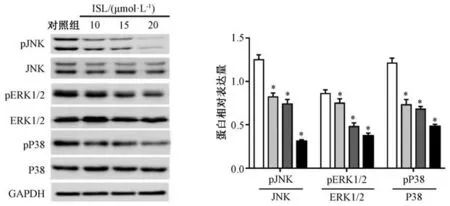
图4 异甘草素对MAPK/ERK 信号通路的影响Fig.4 Effects of isoglycyrrhizin on MAPK/ERK signaling pathway
MAPK/ERK 信号通路参与多种肿瘤细胞增殖、分化、 凋亡、 侵袭、 转移等, 包括JNK、 ERK1/2、P38 等关键分子, 当这些分子发生磷酸化后可调控相关基因的表达, 进而影响细胞周期、 cleaved caspase-3、 基质金属蛋白酶等表达, 介导细胞发生增殖、 凋亡、 转移等过程[20]。 研究表明, 甘草苷能通过调节ERK1、 ERK2 及ERK1/2、 MEK-2 等表达来调控MAPK/ERK 信号通路激活水平, 抑制子宫腺肌病病灶细胞的异常增殖, 减缓子宫腺肌病进展[21]; 异甘草素能下调PIK3/Akt 和P38MAPK 信号转导通路活性, 抑制细胞中基质金属蛋白酶MMP-2、 MMP-9 表达, 以及乳腺癌MDA-MB-231细胞侵袭能力[22], 同时通过细胞外信号ERK 调节激酶介导的诱导抗氧化基因Nrf2 的激活, 从而起到肝脏保护作用[23], 还能通过抑制ERK1/2、 p38磷酸化来抑制MAPK 信号转导途径活化, 改善葡聚糖硫酸钠诱导的结肠炎[24]。 本实验以不同浓度异甘草素处理HCT116 细胞后, 经Western blot 检测发现JNK、 ERK1/2、 P38 磷酸化水平明显降低,表明该成分通过抑制MAPK/ERK 信号通路激活来抑制结直肠癌细胞的增殖、 侵袭和迁移, 并诱导细胞凋亡, 与Hu 等[25]报道一致。
综上所述, 异甘草素可抑制结直肠癌细胞的增殖、 侵袭和迁移, 诱导细胞发生凋亡, 其作用机制可能与抑制JNK、 ERK1/2、 P38 磷酸化水平及MAPK/ERK 信号通路激活有关。 本实验可为寻找异甘草素防治结直肠癌的潜在药物靶点提供依据,但仍需后续研究作支持。
