姜黄素固体分散体单层渗透泵控释片的制备和处方优化
2019-08-26胡春霞张智强
严 巍, 胡春霞, 张智强
(1. 郑州澍青医学高等专科学校, 河南 郑州450064; 2. 天津药物研究院药业有限责任公司, 天津300301)
姜黄素是姜黄、 莪术、 郁金等中药的主要成分, 具有抗动脉硬化、 抗肿瘤、 抗炎、 抗氧化、 保护心肌等多种药理活性[1-6], 几乎无毒副作用。 但该成分具有遇光易氧化、 水溶性较差、 胃肠道吸收受限, 口服吸收生物利用度低等缺点[7-9], 故为了提高姜黄素临床应用效果, 需要对其进行制剂学研究。
固体分散体技术可有效提高药物溶解度及生物利用度, 韩刚等[10-11]报道, 将姜黄素制备成固体分散体后其溶解度显著提高, 生物利用度提高至690%, 但其血药浓度波动过大, 可能会对机体器官造成损伤。 姜黄素在胃肠道各段均有吸收, 吸收窗较广[12-13], 制备成缓释制剂后有助于药物在体内充分吸收, 进而为提高生物利用度奠定基础; 陈曦等[14]发现, 姜黄素自微乳微孔渗透泵控释片需用到大量的表面活性剂和助表面活性剂; 郑少华等[15]采用HPMC K4M 制备姜黄素缓释片, 但它易受外肠道pH 等因素影响, 体内外相关性较差[16-19]。渗透泵片以零级释放动力学为主要特征, 而且体内外相关性较高, 是一种理想的缓控释制剂[20-24]。 因此, 本实验制备姜黄素固体分散体单层渗透泵控释片, 并进行处方优化, 以期减少给药次数、 提高用药顺从性、 降低血药浓度峰谷波动,为相关制剂研发提供实验参考。
1 材料
1.1 仪器 U3000 型高效液相色谱仪 (配置DAD 检测器, 戴安中国有限责任公司); BP210D型电子天平 [十万分之一, 赛多利斯科学仪器(北京) 有限公司]; TDP-6 型单冲压片机(吉首市中湘制药机械厂); BY-300A 型包衣锅(上海黄海药检仪器有限公司); RCZ-6C3 型智能溶出试验仪(郑州南北仪器设备有限公司); Fluko 型磁力搅拌器(弗鲁克流体机械制造有限公司);BPZ-6120-2B 型真空干燥箱(上海一恒科学仪器有限公司)。
1.2 试药 姜黄素原料药(批号12041505, 含有量>98%, 成都普思生物技术有限责任公司); 姜黄素对照品(批号110823-201004, 中国食品药品检定研究院)。 羧甲基纤维素钠(CMC-Na, 批号151015, 聚合度800~1 200, 江苏艾康生物医药研发有限公司); 聚乙烯吡咯烷酮K30 (PVP K30,国药集团化学试剂有限公司); 微晶纤维素(MCC101, 批号150920, 河南华悦化工产品有限公司); 乳糖(批号20141210001, 型号80 目, 药用级, 西安天正药用辅料有限公司); NaCl (批号AD20160426, 陕西盘龙医药物流有限公司);PEG4000 (批号T20160510, 南通奥诺化工有限公司); 醋酸纤维素(结合酸54.5% ~56.0%, 国药集团化学试剂有限公司); 硬脂酸镁 (批号20161012, 曲阜市天利药用辅料有限公司); 邻苯二甲酸二丁酯(DBP, 批号20151115S, 天津市大茂科技化工有限公司)。
2 方法与结果
2.1 姜黄素含有量测定
2.1.1 色谱条件 Angilent Extend C18色谱柱(150 mm×4.6 mm, 5 μm); 检测波长421 nm; 流动相乙腈-4.0%醋酸(50 ∶50); 柱温40 ℃; 体积流量1.0 mL/min; 进样量20 μL。
2.1.2 线性关系考察 精密称取姜黄素对照品10.00 mg, 置于10 mL 量瓶中, 乙腈超声5 min,静置至室温后乙腈-4.0%醋酸(50 ∶50) 定容至刻度, 即得1.0 mg/mL 贮备液, 量取1.0 mL 至10 mL量瓶中, 乙腈-4.0% 醋酸(50 ∶50) 定容,摇匀后得100 μg/mL 对照品溶液, 流动相进一步配制成45.0、 22.5、 15.0、 1.5、 0.05 μg/mL, 在“2.1.1” 项色谱条件下进样测定。 以溶液质量浓度为横坐标(X), 峰面积为纵坐标(Y) 进行回归, 得方程Y=28.778X+20.815 (r=0.999 9), 在0.05~45.0 μg/mL 范围内线性关系良好。
2.1.3 供试品溶液制备 取10 片渗透泵片, 除去包衣膜, 研钵中研细。 取0.5 g (相当于姜黄素36 mg) 转移至25 mL 量瓶中, 加入20 mL 乙腈超声溶解, 流动相定容至刻度, 0.45 μm 微孔滤膜过滤, 精密量取续滤液1.0 mL 至100 mL 量瓶中, 流动相定容, 摇匀, 即得。
2.1.4 方法学考察 取“2.1.3” 项下供试品溶液, 在“2.1.1” 项色谱条件下进样测定6 次, 测得姜黄素峰面积RSD 为0.41%, 表明仪器精密度良好。 于5 d 内在“2.1.1” 项色谱条件下进样测定, 每天1 次, 测得姜黄素峰面积RSD 为0.93%,表明溶液在5 d 内稳定性良好。 按 “2.1.3” 项下方法平行制备6 份供试品溶液, 在 “2.1.1”项色谱条件下进样测定, 测得姜黄素含有量RSD为1.27%, 表明该方法重复性良好。 取研磨后粉末, 精密加入对照品溶液 (15.0 μg/mL) 0.5、1.0、 1.5 mL, 按“2.1.3” 项下方法制备供试品溶液, 在“2.1.1” 项色谱条件下进样测定, 测得姜黄素平均加样回收率为99.32%, RSD为1.25%。
2.2 释放度测定 采用2015 年版《中国药典》四部附录(0931) 第二法桨法。 以900 mL 超声处理的蒸馏水为渗透泵片释放介质, 转速100 r/min,温度(37±0.5)℃, 预定时间点自动取样3 mL,并自动补加3 mL 空白释放介质, 避光操作,0.45 μm微孔滤膜过滤后, 在“2.1.1” 项色谱条件下进样测定, 并绘制体外释药曲线。
2.3 固体分散体单层渗透泵控释片制备
2.3.1 固体分散体[10]取姜黄素原料药2.0 g、PVP K30 8.0 g, 置于三角烧瓶中, 加入200 mL 无水乙醇, 50 ℃下磁力搅拌4 h 至溶液体系澄清, 于50 ℃下旋转蒸发除去有机溶剂, 即得。 粉碎后过80 目筛, 敞口置于干燥器中保存。
2.3.2 渗透泵片片芯 辅料均过80 目筛, 制备100 片, 方法为取固体分散体(18 g)、 CMC-Na、渗透活性剂NaCl、 MCC (3 g) 等混合均匀, 加入乳糖至0.5 g/片。 选择90%乙醇作为黏合剂制备片芯软材, 方法为过20 目筛后置于45 ℃真空干燥箱中过夜干燥, 20 目整粒, 加入1%硬脂酸镁, 压制后得到直径为1.1 cm 的圆形片芯, 每片含姜黄素36 mg, 片芯硬度(50±10) N。
2.3.3 包衣液 称取醋酸纤维素2.0 g、 邻苯二甲酸二丁酯0.4 g, 加到100 mL 包衣溶剂中(丙酮∶水=85 ∶15), 超声10 min, 加入适量PEG 4000,搅拌均匀, 即得。 包衣参数为体积流量4 mL/min,转速35 r/min, 温度45 ℃, 达到预定片重后通风30 min。 45 ℃下, 将姜黄素渗透泵片置于烘箱中老化12 h。
2.4 单因素试验
2.4.1 填充剂种类 固定其他处方不变, 考察淀粉、 蔗糖、 乳糖(质量分数均为24%) 对释药速率和12 h 内累积释放度的影响, 结果见图1。 由图可知, 淀粉作为填充剂时释药前期较快, 但12 h后累积释放度最低; 蔗糖总体释药速率和12 h 内累积释放度均低于乳糖, 而且后者本身流动性和可压性均较优, 故选择乳糖作为填充剂。
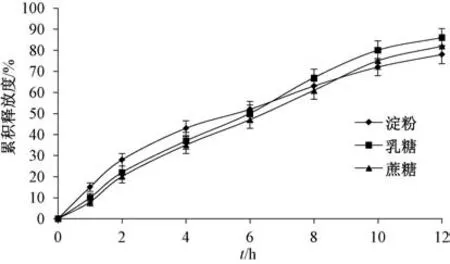
图1 填充剂种类对药物释放的影响Fig.1 Effects of filler kind on drug release
2.4.2 渗透活性剂种类 固定其他处方不变, 考察甘露醇、 NaCl、 KCl (质量分数均为24%) 对释药速率和12 h 内累积释放度的影响, 结果见图2。由图可知, 渗透泵片释药速率和12 h 内累积释放度依次为NaCl>KCl>甘露醇, 故选择NaCl 作为渗透活性剂。
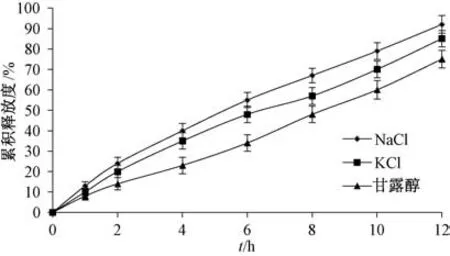
图2 渗透活性剂种类对药物释放的影响Fig.2 Effects of permeation enhancer kind on drug release
2.4.3 NaCl 用量 固定其他处方不变, 考察NaCl用量30%、 36%、 42%对释药速率和12 h 内累积释放度的影响, 结果见图3。 由图可知, 当NaCl 用量为150 mg 时, 释药速率和12 h 内累积释放度均较低; 210 mg 时, 前期释药较快, 但12 h 内累积释放度不高。

图3 NaCl 用量对药物释放的影响Fig.3 Effects of NaCl consumption on drug release
2.4.4 CMC-Na 用量 固定其他处方不变, 考察CMC-Na 用量3%、 5%、 7%对释药速率和12 h 内累积释放度的影响, 结果见图4。 由图可知, 随着CMC-Na 用量增加, 释药速率和12 h 内累积释放度也逐渐提高。
2.4.5 PEG 4000 用量 固定其他处方不变, 考察PEG 4000 用量10%、 15%、 20%对释药速率和12 h内累积释放度的影响, 结果见图5。 由图可知, 随着PEG 4000 用量增加, 释药速率和12 h 内累积释放度也逐渐提高。
2.4.6 包衣增重 固定其他处方不变, 考察包衣增重4%、 6%、 8%对释药速率和12 h 内累积释放度的影响, 结果见图6。 由图可知, 随着包衣增重增加, 释药速率和12 h 内累积释放度均呈下降趋势。

图4 CMC-Na 用量对药物释放的影响Fig.4 Effects of CMC-Na consumption on drug release
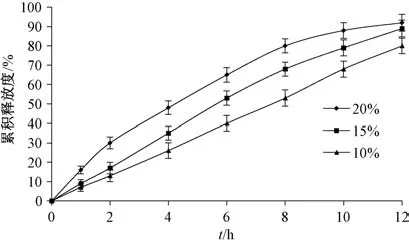
图5 PEG 4000 用量对药物释放的影响Fig.5 Effects of PEG 4000 consumption on drug release
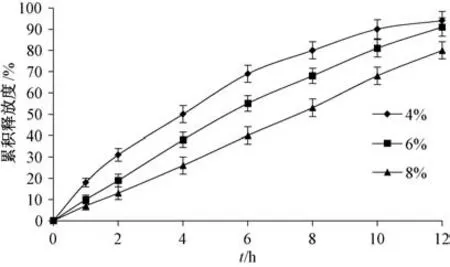
图6 包衣增重对药物释放的影响Fig.6 Effects of coating weight gain on drug release
2.5 正交试验 在单因素试验基础上, 以片芯处方中NaCl 用量(A)、 CMC-Na 用量(B), 以及包衣处方中PEG 4000 用量(C)、 包衣增重(D) 为影响因素, 设计L9(34) 正交试验进行优化, 因素水平见表1。

表1 因素水平Tab.1 Factor and levels
然后, 选择3 个时间点(2、 6、 12 h) 对体外释药进行监控, 分别以累积药物释放度20%、55%、 90%为参考标准, 权重系数均设定为1 (L1、L2、 L3); 对释药曲线进行线性回归, 权重系数设定为3(L4), 计算综合评分L, 公式为L= | L1-20% | ×100×1+| L2-55% | ×100×1+| L3-90% | ×100×1+| L4-1 | ×100×3。 结果见表2, 方差分析见表3。
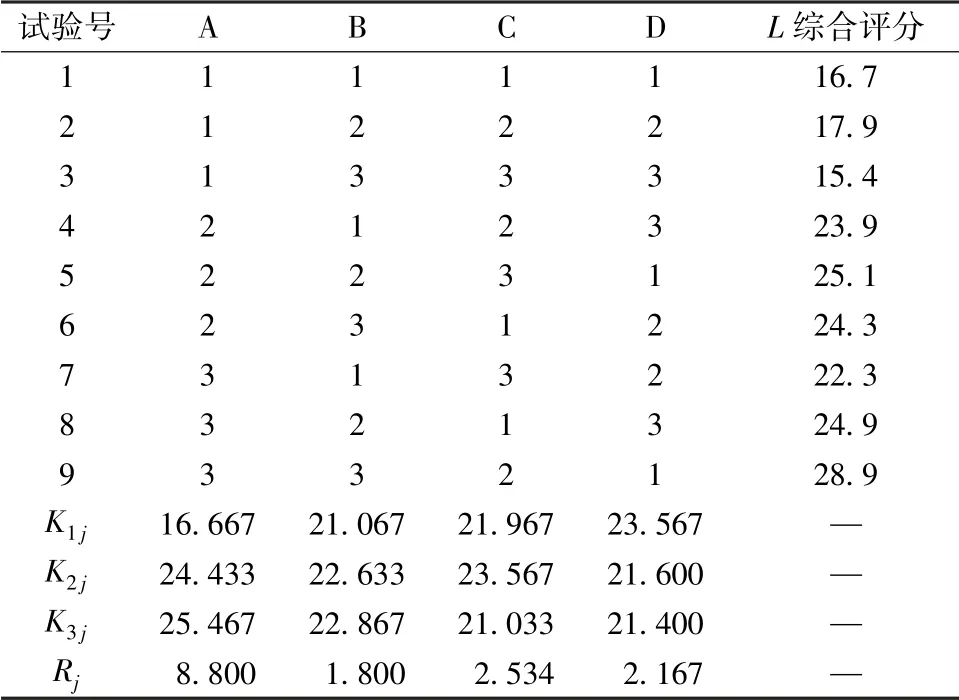
表2 试验设计及结果Tab.2 Design and results of tests
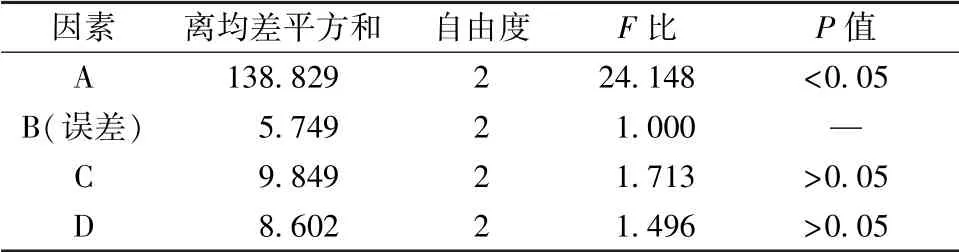
表3 方差分析Tab.3 Analysis of variance
由此可知, 各因素影响程度依次为A>C>D>B, 其中因素A 对体外释药有显著影响 (P <0.05), 最 优 处 方 为 A1B1C3D3, 即 NaCl 用 量170 mg, CMC-Na 用量25 mg, PEG 4000 用量12%, 包衣增重4.5%, 综合评分15.1。
2.6 体外释药行为研究 按照优化处方制备3 批渗透泵片, 释药曲线见图7, 可知处方重复性良好, 12 h 内累积释放度为92.42%。 然后, 分别采用零级、 一级、 Higuchi 模型进行拟合, 结果见表4, 可知零级模型拟合度最高。

表4 药物释放模型Tab.4 Models for drug release
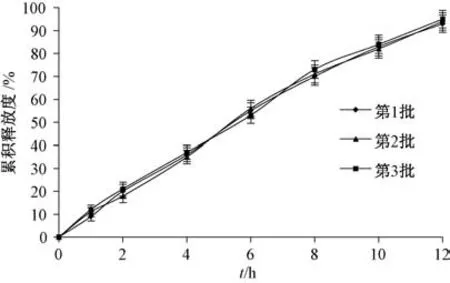
图7 3 批样品释药曲线Fig.7 Drug release curves for three batches of samples
2.7 不同制剂体外释药行为比较 制备固体分散体片100 片, 方法为取固体分散体18 g、 微晶纤维素3 g, 与29 g 乳糖混匀, 以90%乙醇为黏合剂制备软材, 过20 目筛, 置于45 ℃真空干燥箱中干燥过夜, 20 目整粒, 加入1% 硬脂酸镁, 压片, 即得, 每片含姜黄素36 mg; 另取原料药3.6 g、 微晶纤维素3 g, 与43.4 g 的乳糖混匀后同法制备100 片原料药片, 每片含姜黄素36 mg。 根据实际情况, 2 h 前适当增加取样点, 按“2.2” 项下方法测定释放度, 结果见图8, 可知单层渗透泵控释片体外释药行为与固体分散体片、 原料药片相比发生了较大变化。
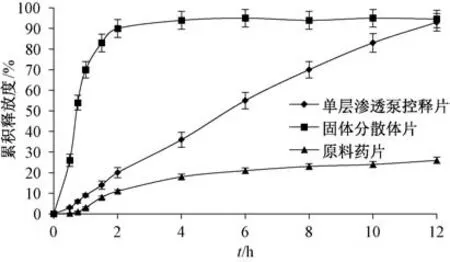
图8 不同制剂释药曲线Fig.8 Drug release curves for different preparations
3 讨论
药物溶解度不仅对渗透泵片处方有较大影响,而且会直接影响药物在机体胃肠道的吸收速度和程度, 进而影响生物利用度。 单层渗透泵片一般适合溶解度良好的药物, 但姜黄素溶解度较差[7], 故制成该剂型时需要进行制剂学改造, 本实验参考前期报道[10]制备姜黄素固体分散体, 溶解度显著提高, 可为其奠定基础。
尽管固体分散体技术提高了姜黄素溶解度, 但仍不能产生足够的渗透压来促进药物释放。 渗透泵片片芯加入一定量渗透剂后遇水时可溶解, 产生渗透压和渗透梯度, 进而促进药物经释药小孔释放。本实验制备渗透泵片时选择乳糖作为片芯填充剂,同时它也可作为渗透剂[21-23], 与渗透活性剂(NaCl) 一起产生渗透压。 为了使在包衣膜内部能自发形成均一、 具有一定黏度的混悬液, 需要在片芯处方中加入适量助悬剂CMC-Na, 同时它遇水溶解时产生的溶胀压与乳糖、 NaCl 产生的渗透压共同, 从而促进药物顺利释放。 为了解决渗透泵片在释药初期的迟释问题, 在片芯中又加入了一定量微晶纤维素, 遇水膨胀后的推动力可促使混悬液较快释放, 有效解决了迟释问题, 同时具有优良的流动性和黏合性, 也可粉末直接压片。
本实验比较了姜黄素原料药片、 固体分散体片、 单层渗透泵控释片体外释药行为, 发现单层渗透泵控释片可显著改善原料药片释药速率过慢、 累积释放度过低的缺点, 同时也有效控制了固体分散体片的释药速率, 取得了预期的释药结果。 另外,单层渗透泵控释片是一种膜控型缓释制剂, 包衣膜中的增塑剂(邻苯二甲酸二丁酯)、 致孔剂、 一定机械强度的包衣层共同控制药物缓慢、 恒速释放,12 h 内累积释放度可达92.42%, 但其药物剂量是否需要调整、 生物利用度如何提高等问题还需作进一步研究。
