MiR-153-3p调控异丙肾上腺素诱导的心肌肥大机制研究
2019-08-24张丽霞周露玙
张丽霞,周露玙,许 胜,王 涛,刘 靖,王 昆
心肌肥大是心脏对多种病理生理刺激的重要补偿反应,如心肌梗死,高血压,瓣膜功能不全和收缩蛋白突变[1]。虽然在早期阶段作为有益的适应性反应,但如果不进行治疗则由于失代偿而逐渐恶化为心力衰竭。尽管已经鉴定出参与心肌肥大过程的许多信号传导途径[2-3],但是对于心肌肥大的潜在分子机制仍然知之甚少,这妨碍了临床实践中对这种心脏病的有效治疗。因此非常希望揭开调节心肌肥大的新分子,从而破译心肌肥大的新机制并制定治疗该疾病的新策略。
微小RNA(microRNA,miRNA)是一类小的内源性非编码RNA分子,通过降解靶mRNA或直接翻译抑制来沉默其同源靶基因[4]。越来越多的证据表明,miRNA在心肌肥大的发病机制中发挥重要作用[5]。例如,我们之前的研究结果表明miR-9[6]和miR-489[7]可以抑制心肌肥大,而miR-23a[8]是一种促进心肌肥大的miRNA。其他研究如miR-133的下调导致显著的心肌肥大[9]。另一方面,单独过表达miR-208a,miR-195,miR-214,miR-24或miR-23a也已显示在动物和培养的心肌细胞中诱导肥大反应[10]。显然,miRNA在心肌肥大的调节中发挥着多种重要作用。MiR-153参与多种疾病的生理过程,如胃癌[11],乳腺癌[12-13],宫颈癌[14],神经胶质瘤[15],骨肉瘤[16]等。并且miR-153-3p被认为是一种新的生物靶标[17],然而其在心肌肥大的作用机制尚未可知,本研究以体外分离培养大鼠心肌细胞为研究对象,利用异丙肾上腺素(isoproterenol,ISO)诱导法建立心肌肥大的体外细胞研究模型,通过转染miR-153-3p antagomir(RNA拮抗剂)研究miR-153-3p在心肌肥大中的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 新生0~3 d的Sprague-Dawley(SD)大鼠,雌雄不限,购自济南朋悦实验动物繁育有限公司[SCXK-(鲁)-2014-0007]。
1.1.2 主要试剂 ISO(上海樊克生物科技有限公司);FITC Phalloidin FITC标记鬼笔环肽(上海翊圣生物科技有限公司);RR820A takara SYBR®Premix ExTaqTMII(Tli RNaseH Plus)(日本TaKaRa公司);DEME培养基(英国Gibico公司);胎牛血清(英国Gibico公司);胰蛋白酶和II型胶原酶(日本TaKaRa公司);TRIzol试剂盒(日本TaKaRa公司);RNA反转录试剂盒(日本TaKaRa公司);lipofectamineTM 3000(美国Invitrogen公司)。
1.2 方法
1.2.1 小鼠心肌细胞的分离及培养 用75%酒精浸泡出生0~3 d的SD大鼠乳鼠,消毒2~3次,于灭菌超净台中用眼科剪取出心脏的心尖大部分,用预冷的磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗2~3遍直至无血细胞残留,之后用剪刀剪碎至无大组织残留,使用胰蛋白酶(10 mg/mL)和II型胶原酶(30 mg/mL)消化法反复消化,每次消化5~6 min后将细胞悬液吸出放入2%的胎牛血清中终止消化,最后将消化后的细胞悬液以800~1 000 r/min转速离心5 min,2次,通过细胞筛除去组织碎片,所提取的细胞置于含5%胎牛血清的DEME/F12培养基中,混匀细胞,种于37 ℃ 5% CO2培养皿中,采用差速贴壁1.5~2 h分离细胞,纤维细胞将贴壁生长,轻轻吸取含未贴壁细胞的培养液,按(0.5~1)×105/mL密度种植细胞于6孔板中或按(1.5~2)×107/mL密度种植于24孔板中,24 h后换液,继续培养进行实验。
1.2.2 ISO诱导心肌肥大实验 培养的心肌细胞换液后,选择6孔板中生长状态良好的乳鼠心肌细胞用不同时间[0(对照组)、8、12、18、24、48 h]梯度的ISO(浓度为10 μmol/L),并将培养基换为2%胎牛血清培养。在同一时间点收集细胞的RNA用荧光定量PCR(real-time quantitative PCR,RT-qPCR)法检测心房利钠肽(atrial natriuretic peptide,ANP),β-肌球蛋白重链(β-myosin heavy chain,β-MHC)和miR-153-3p的表达。收集ISO诱导24 h的细胞进行表面积染色,拍照后使用Image J软件分别测量实验组和对照组细胞大小。
1.2.3 MiR-153-3p拮抗实验 培养的心肌细胞换液后,选择6孔板中生长状态良好的乳鼠心肌细胞用lipofectamine 3000将miR-153-3p的拮抗剂(antagomir)和NC(阴性对照)转入心肌细胞中,转染4 h后换液加入ISO miR-153-3p,分组如下:0 h(空白组),ISO组(药物诱导组),ISO+NC组(阴性对照组),ISO+miR-153-3p antagomir组(实验处理组)。24 h后收集细胞进行表面积染色,拍照后使用Image J软件分别测量实验处理组和阴性对照组细胞大小,并收集细胞的RNA行RT-qPCR法检测ANP,β-MHC和miR-153-3p基因表达。
1.2.4 RT-qPCR 用RT-qPCR法检测。使用Trizol试剂提取各组细胞总RNA,而后按照反转录试剂盒说明书操作,用随机引物合成cDNA,或加入茎环引物反转录miR-153-3p,用SYBR Green荧光RT-PCR法检测反转录产物中心肌肥大标志基因ANP,β-MHC的mRNA表达和miR-153-3p的表达。上述实验均重复3次。RT-qPCR引物序列见表1。
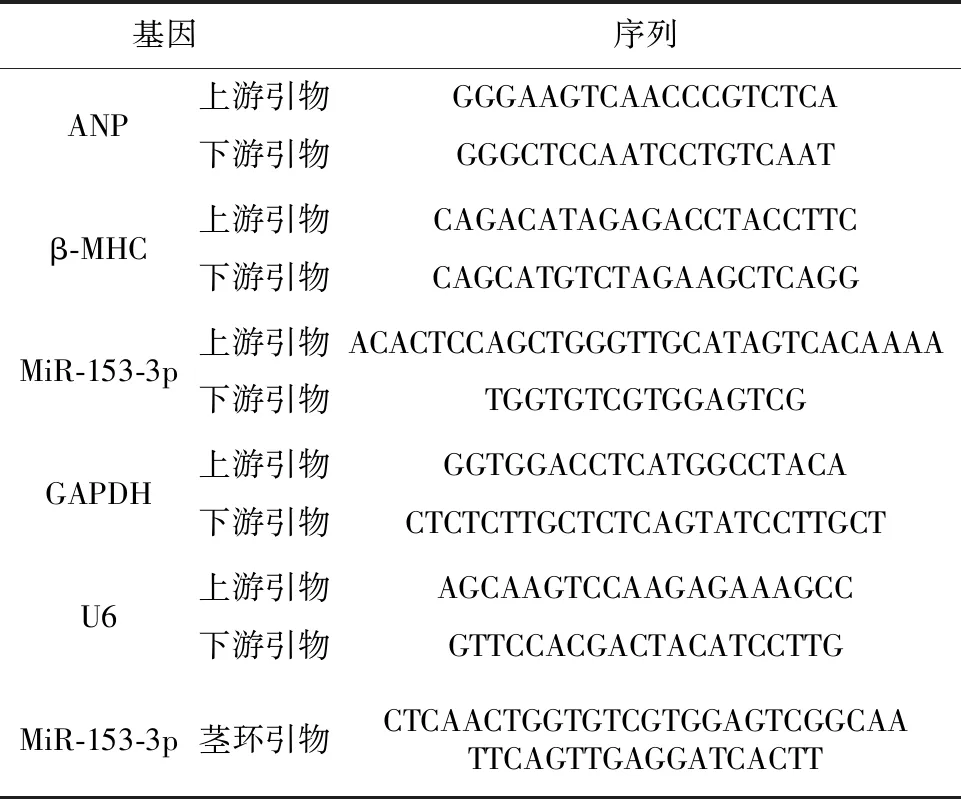
表1 RT-qPCR引物序列
1.2.5 表面积染色 将上述提取的细胞按(1.5~2)×107/mL密度种植于24孔板中,按下述步骤进行染色:①在24孔板中加入赖氨酸包被的盖玻片,按孔调整细胞浓度;②将要染色的细胞用PBS洗2遍,加入0.5~1 mL 3.7%的多聚甲醛固定细胞,室温15 min,用PBS充分洗涤;③用丙酮脱水5 min,用含有0.2% Triton X-100的PBS配制TRITC标记的鬼笔环肽(TRITC-Phalloidin),锡纸避光,室温,染40 min;④用PBS洗3次,以去掉未反应的染料;⑤将贴有细胞一面的盖玻片扣于含DAPI封片液的盖玻片上。
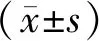
2 结果
2.1 ISO诱导心肌细胞肥大情况 与对照组比较,随着ISO的诱导时间越长心肌细胞逐渐呈现肥大效果,在ISO诱导心肌细胞18 h和24 h后,ANP和β-MHC基因的表达具有显著差异,尤其在24 h诱导肥大效果更加明显(图1A、B,P<0.05),48 h后心肌细胞肥大降低,可能是由于细胞凋亡引起。对ISO诱导24 h的心肌细胞进行表面积染色发现与对照组比较,实验组心肌细胞的表面积显著增加(图2,P<0.05)。
2.2 MiR-153-3p在心肌肥大细胞中的表达情况 与对照组比较,随着ISO的诱导时间越长miR-153-3p的表达逐步升高,在ISO诱导心肌细胞18 h和24 h后miR-153-3p基因的表达具有显著差异,尤其在24 h上升更加明显(图3,P<0.05)。这与上述的心肌细胞肥大验证结果相一致,表明miR-153-3p可能促进心肌肥大。
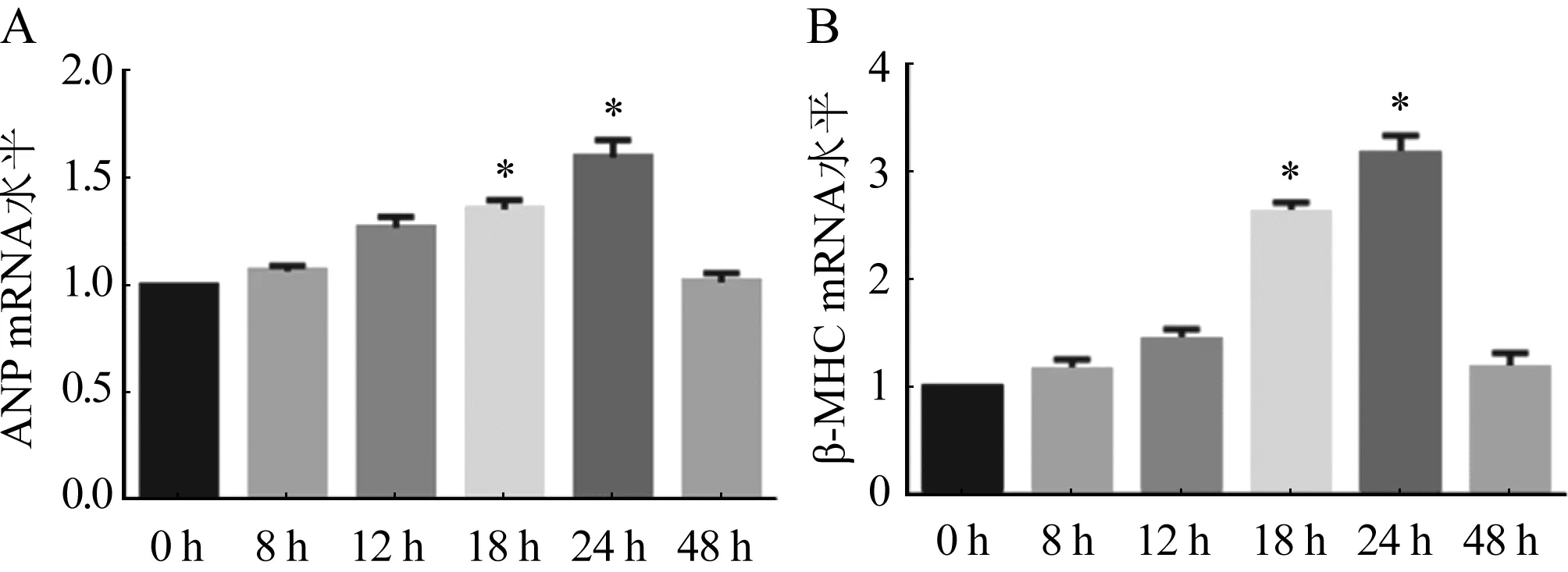
n=3;与对照组相比,*P<0.05图1 不同时间梯度ISO处理组ANP(A)和β-MHC(B)的表达情况
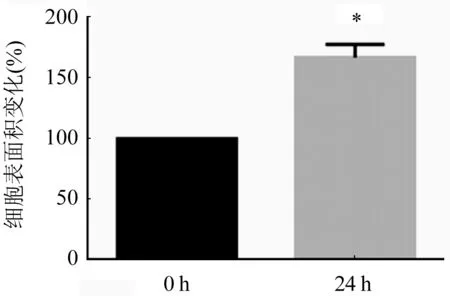
n=3;与对照组相比,*P<0.05图2 ISO诱导24 h后心肌细胞表面积的变化情况

n=3;与对照组相比, *P<0.05图3 不同时间梯度ISO处理组miR-153-3p的表达情况
2.3 MiR-153-3p拮抗实验后对心肌肥大的影响 转染miR-153-3p antagomir 4 h后行RT-qPCR检测,结果发现miR-153-3p的表达降低(图4,P<0.05),表明miR-153-3p拮抗成功,进一步行RT-qPCR检测发现,与ISO组和ISO+NC组比较,ISO+antagomir组的心肌细胞肥大效果显著降低(图5A、B,P<0.05)。心肌细胞表面积的结果也同这一结果相一致(图6,P<0.05),进一步证明miR-153-3p促进心肌细胞肥大。
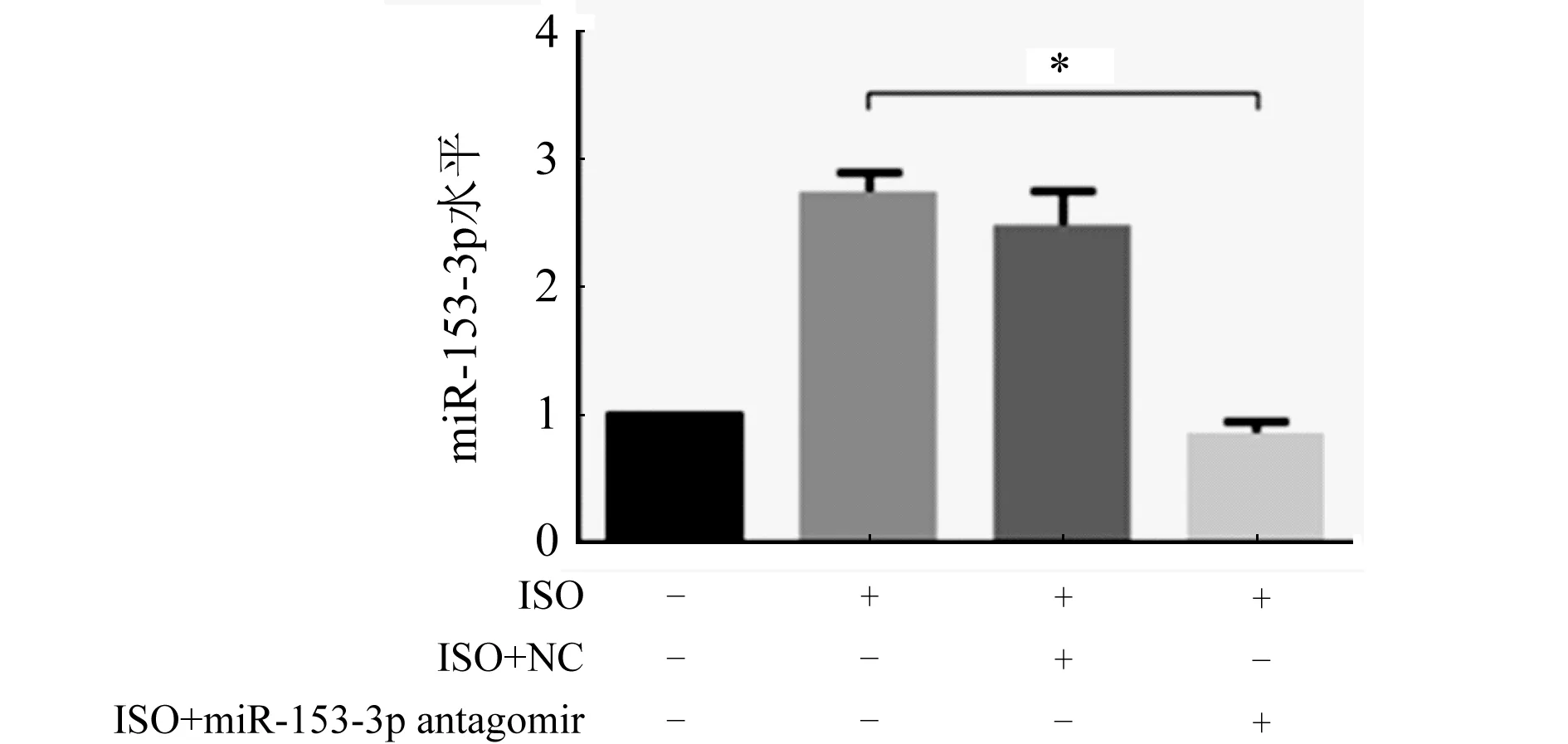
ISO组:ISO诱导24 h;ISO+NC组:先转染NC 4 h后用ISO诱导24 h;ISO+miR-153-3p antagomir组:先转染miR-153-3p antagomir 4 h后用ISO诱导24 h;n=3;与阴性对照组比较,*P<0.05图4 转染miR-153-3p antagomir后的敲低情况
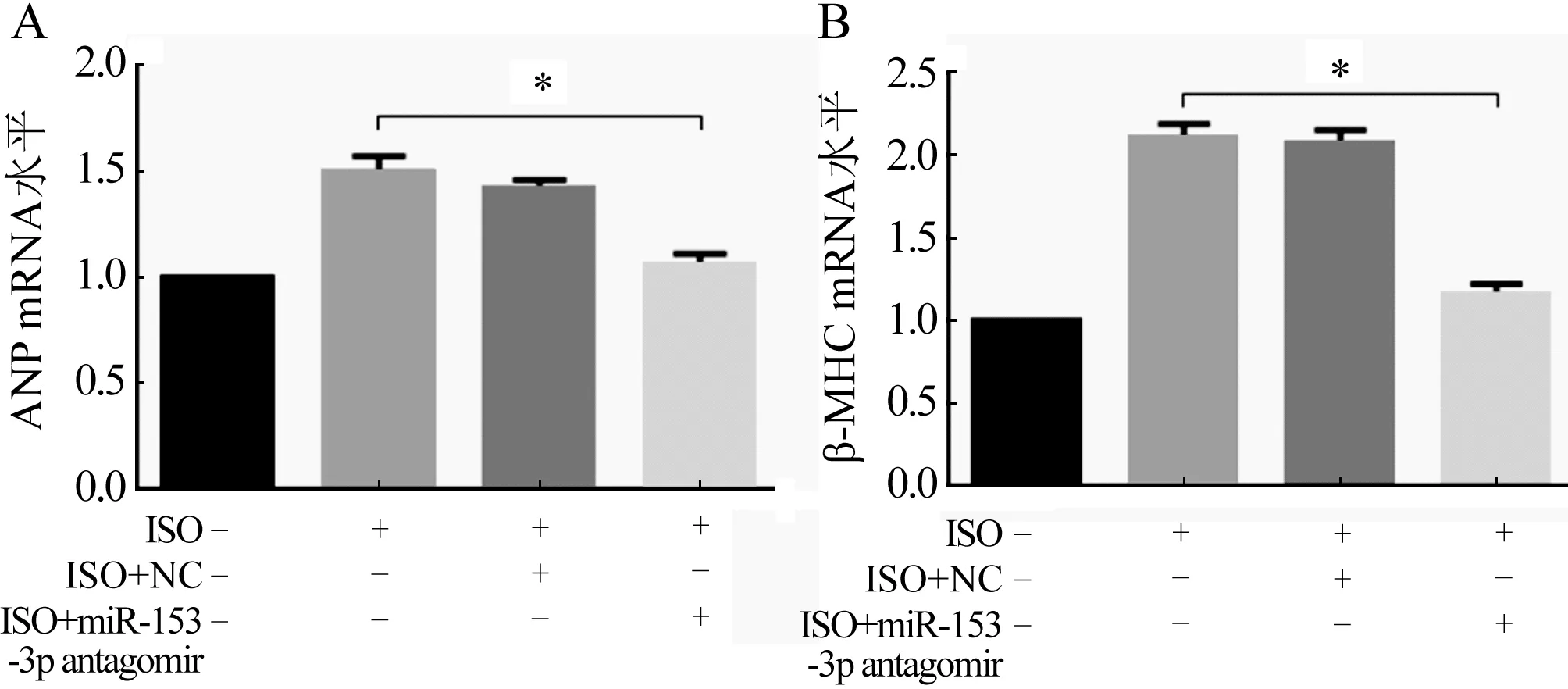
ISO组:ISO诱导24 h;ISO+NC组:先转染NC 4 h后用ISO诱导24 h;ISO+miR-153-3p antagomir组:先转染miR-153-3p antagomir 4 h后用ISO诱导24 h;n=3;与阴性对照组比较,*P<0.05图5 转染miR-153-3p antagomir后ANP(A)和β-MHC(B)的表达情况
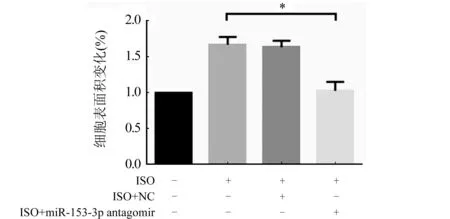
ISO组:ISO诱导24 h;ISO+NC组:先转染NC 4 h后用ISO诱导24 h;ISO+miR-153-3p antagomir组:先转染miR-153-3p antagomir 4 h后用ISO诱导24 h;n=3;与阴性对照组比较,*P<0.05图6 转染miR-153-3p antagomir后心肌细胞表面积的变化情况
3 讨论
心肌肥大是由于神经体液活化引起的应激增加和血流动力学负荷增加而发生的,通常会发展为心力衰竭,死亡率高。最初,心脏经历适应性形态学变化,导致补偿性肥大以维持心输出量。持续性肥大是不可逆转的,并且在长期压力下不可避免地导致失代偿性心力衰竭,引起患者的死亡[18]。
在神经体液因素中,ISO受体及其信号传导通路是诱导心肌肥大的重要因素。该通路一旦被激活,会改变细胞内多个基因和蛋白质的表达量,发生一些列生物化学变化,从而导致心肌肥大的发生。在本研究中,采用了ANP和β-MHC基因作为心肌肥大的发生指标,二者均是与细胞肥大密切相关的基因,在心脏胚胎发育早期或出生后病理状态下高表达,新出生0~3 d SD大鼠心肌细胞在体外可以离体培养7 d,是研究心脏相关疾病的经典模型[19]。
miRNA属于转录后调控,主要通过作为RNA诱导的沉默复合体的一个元件,识别mRNA的3′端非编码区,引起该mRNA降解或者翻译抑制,从而负性调节靶蛋白的表达,发挥其生物学功能。许多miRNAs已被证实是心血管疾病治疗的目标基因,如miRNA23、miRNA24、miRNA199、miRNA98等[20]。MiR-153-3p可以通过多种信号通路参与疾病的发生,如与lncRNAs HIF1A-AS2相互作用促进HIF-1α的上调,从而促进缺氧时人脐静脉内皮细胞的血管生成[21];circRNA_0084043可以通过miR-153-3p/Snail轴促进恶性黑素瘤进展[22];miRNA-153-3p还可以通过靶向黑色素瘤中的SNAI1来抑制细胞增殖和侵袭[23]。本研究通过检测ISO诱导的心肌肥大中的miR-153-3p基因的表达水平,以及检测敲低miR-153-3p对ISO诱导的心肌肥大效果的影响,mRNA水平与表面积结果都显示miR-153-3p可能促进由ISO诱导的心肌肥大。因此,我们的研究结果揭示了miRNA在控制心肌肥大发展中的新信号机制。
考虑到miR-153-3p能够通过多种信号通路参与疾病的发生,并且miRNA属于转录后调控,其作用机制主要是通过它对相关靶基因的转录调控实现的,在本研究的基础上,寻找miRNA的靶基因从而研究它们之间的相互作用机制及相关靶基因对心肌肥大的作用,将会为进一步明确miRNA的作用机制,阐明心肌肥大的相关生理、病理过程发生、发展机制起到重要的促进作用[24]。
