HIFU消融子宫肌瘤后浆肌层损伤对消融治疗有效性及安全性的影响
2019-08-23陈锦云刘一诺莫绍江陈文直
魏 庆,陈锦云,2*,刘一诺,莫绍江,张 蓉,2,陈文直
(1.重庆医科大学生物医学工程学院 省部共建国家重点实验室培育基地—重庆市超声医学工程重点实验室 重庆市生物医学工程学重点实验室 重庆微无创医学协同创新中心,重庆 400016;2.重庆医科大学附属第一医院超声消融治疗中心,重庆 400042)
HIFU消融已广泛用于治疗子宫肌瘤,且疗效较为确切,但其安全性仍为业界关注重点[1-2]。超声波具有反射、折射等物理特性,可在一定程度上引发子宫内膜、腹壁皮肤、盆底筋膜等损伤[3-5]。HIFU消融子宫肌瘤术后增强MR T1WI可见子宫肌层灌注全时段矢状位或轴位无灌注区域达子宫浆肌层[6]。本研究探讨HIFU消融子宫肌瘤后浆肌层损伤对消融治疗有效性及安全性的影响。
1 资料与方法
1.1 一般资料 选取2013年1月—2017年12月于重庆医科大学附属第一医院接受HIFU消融的400例子宫肌瘤患者,年龄21~55岁,中位年龄40岁。纳入标准:①育龄期妇女,临床及影像学确诊为子宫肌瘤,术后3个月内无生育计划;②单发子宫肌瘤,4 cm≤病灶最大径≤10 cm;③分别于消融术前及术后3天内接受MR检查(包括平扫及增强扫描),且影像学资料完整。排除标准:①既往有子宫肌瘤HIFU消融或其他手术史;②带蒂浆膜下肌瘤及带蒂黏膜下肌瘤;③宫颈肌瘤;④不愿或不能接受随访者。患者均知晓HIFU消融治疗风险,并签署知情同意书。
1.2 仪器与方法 采用海扶刀JC型聚焦超声肿瘤治疗系统,超声换能器中心组合有超声显像探头,换能器频率0.8 MHz,显像超声频率3.5 MHz,循环脱气水耦合[6]。消融治疗时患者俯卧,前腹壁与水槽内的循环脱气水接触;给予镇痛、镇静处理。根据患者耐受情况及术中治疗靶区超声灰度变化,结合CDFI及CEUS表现判断消融效果,适时终止治疗[7-8]。
1.3 评价指标及分组 HIFU消融术前,基于MR T2WI平扫及增强扫描矢状位及轴位图像观察肌瘤位置,并根据肌瘤与浆膜、内膜的关系进行分类;测量子宫肌瘤上下径、横径及前后径,采用椭球体公式计算肌瘤体积[4],体积(cm3)=0.523 3×横径(cm)×上下径(cm)×前后径(cm);同时测量肌瘤前缘至前腹壁的距离。记录术中消融功率(W)、总剂量(kJ)。基于HIFU消融术后盆腔平扫及增强扫描图像,分别测量术后肌瘤体积及肌瘤无灌注区体积(non-perfused volume, NPV),并计算消融率:消融率(%)=NPV(cm3)/肌瘤体积(cm3)×100%。根据术后MR T1WI增强扫描子宫肌层灌注全时段矢状位或轴位图像上子宫浆肌层是否出现灌注缺损,分为损伤组和完整组;并在MR T1WI增强扫描矢状位或轴位图像上选择浆膜层环状强化缺损最大处,横向或纵向测量其最大长度(即灌注缺损最大径)。计算能效因子(energy efficiency factor, EEF)[9]。HIFU术后严密观察并发症,并按照国际介入放射治疗学会(Society of Interventional Radiology, SIR)标准[10]对相关并发症进行分级。
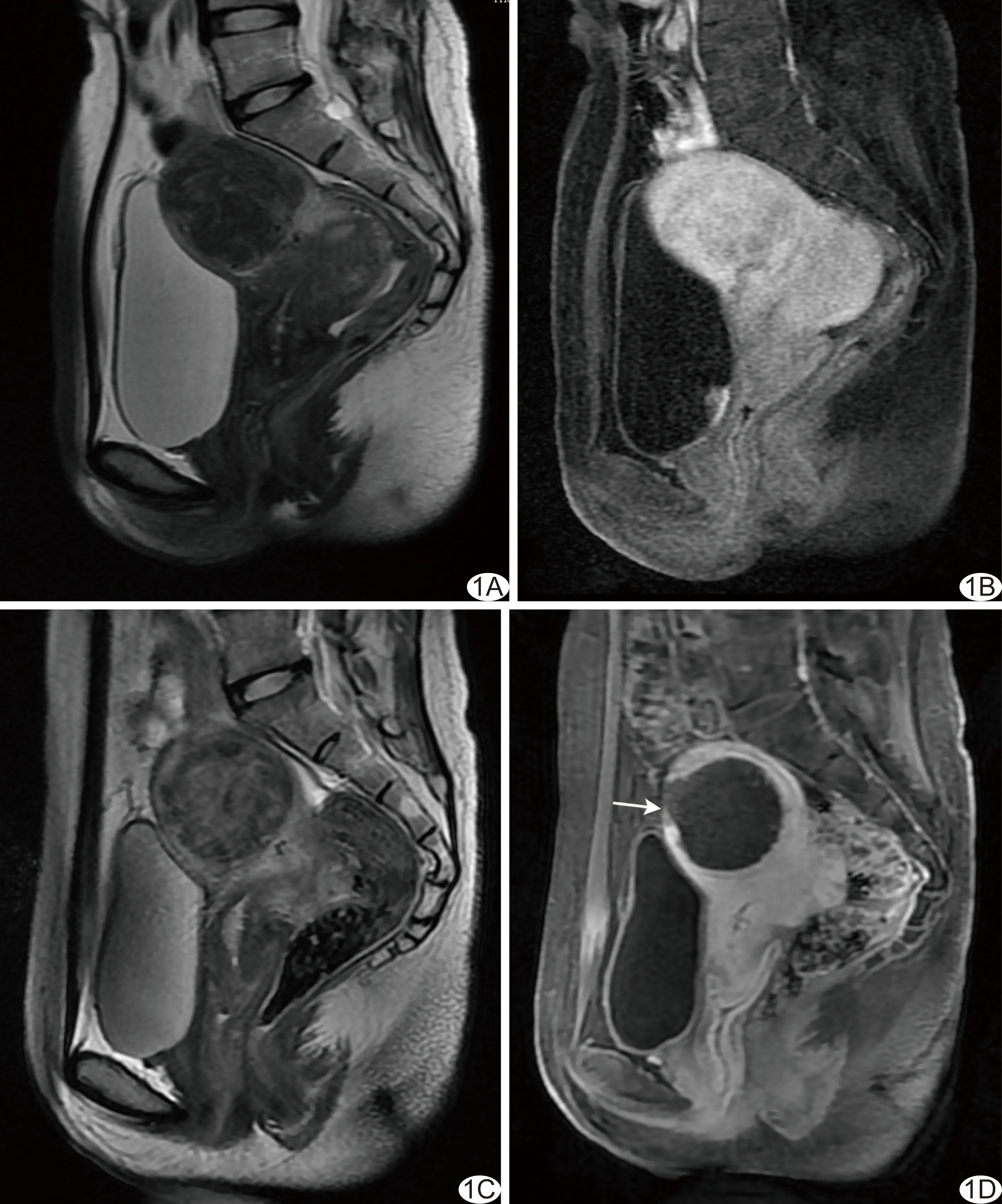
图1 子宫前壁肌壁间肌瘤突向浆膜,HIFU消融治疗前后MRI表现 A、B.术前T2WI平扫示子宫前壁肌层内类圆形病灶突向浆膜(A),T1WI增强扫描示病灶强化水平与子宫肌壁相似(B); C、D.术后T2WI平扫示类圆形病灶边界清晰,周边肌层信号连续(C),T1WI增强扫描病灶内无强化,子宫浆肌层环状强化区域内见最大径约37 mm局部缺损(箭)
1.4 统计学分析 采用SPSS 22.0统计分析软件。非正态分布计量资料以中位数(上下四分位数)表示,2组间患者年龄、体质量指数(body mass index, BMI)、子宫肌瘤体积、肌瘤前缘至前腹壁的距离、HIFU消融功率、总剂量、NPV、消融率及EEF比较采用Mann-WhitneyU检验。计数资料以百分率表示,2组间子宫肌瘤位置、类型、术后并发症及患者术后妊娠率比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
400例中,前壁肌瘤174例(174/400,43.50%)、后壁肌瘤93例(93/400,23.25%)、侧壁肌瘤105例(105/400,26.25%)、宫底肌瘤28例(28/400,7.00%);其中16例(16/400,4.00%)为黏膜下肌瘤,123例(123/400,30.75%)为浆膜下肌瘤,261例(261/400,65.25%)为肌壁间肌瘤。
HIFU消融术后,310例子宫浆肌层完整(完整组),90例子宫浆肌层损伤(损伤组),浆肌层损伤发生率为22.50%(90/400);浆膜层灌注缺损最大径为3.92~66.30 mm,平均(25.93±14.84)mm,见图1。
2组患者年龄差异无统计学意义(Z=-0.691,P=0.489),损伤组BMI明显高于完整组(Z=-2.271,P=0.023)。宫底肌瘤浆肌层损伤发生率最高,为28.57%(8/28),其后依次为前壁(49/174,28.16%)、侧壁(20/105,19.05%)及后壁肌瘤(13/93,13.98%)。浆膜下肌瘤浆肌层损伤发生率43.09%(53/123),其次为肌壁间肌瘤(37/261,14.18%);而黏膜下肌瘤(16/16,100%)未见浆肌层损伤。2组子宫肌瘤体积、肌瘤前缘至前腹壁的距离差异均无统计学意义(P均>0.05),而子宫肌瘤位置(χ2=8.380,P=0.039)、类型(χ2=44.918,P<0.001)差异有统计学意义。见表1。
2组间HIFU消融功率差异无统计学意义(Z=-1.859,P=0.063)。损伤组总剂量明显低于完整组(Z=-2.983,P=0.003)。NPV差异无统计学意义(Z=-1.508,P=0.132)。损伤组消融率明显高于完整组(Z=-2.805,P=0.005),EEF明显低于完整组(Z=-3.975,P<0.001)。见表2。
HIFU消融术后并发症情况见表3。未出现SIR C~F级并发症。术后完整组3例发生SIR B级并发症(3/400,0.75%),其中1例术后发热经对症治疗后体温恢复正常,2例骶尾部疼痛患者服用非甾体类抗炎药后症状缓解、消失;其余均为SIR A级并发症,术后1周内患者不适症状均自行消失。2组间各并发症发生率差异均无统计学意义(P均>0.05)。
损伤组HIFU消融术后5例(5/90,5.56%)妊娠,其中3例(3/90,3.33%)分娩;完整组7例(7/310,2.26%)妊娠并分娩。2组术后妊娠率差异无统计学意义(χ2=1.596,P=0.206),未见妊娠及分娩相关不良事件发生。
3 讨论
对于突向子宫浆膜生长的子宫肌瘤,为避免超声能量对附近肠管造成热损伤,HIFU消融时需保留一定安全距离[11-12],但术后增强MRI显示非靶区子宫浆肌层灌注缺损仍较常见。MRI可清晰显示子宫各层次结构和子宫肌瘤的相对位置分布,增强扫描显示HIFU消融术后出现无灌注状态提示组织发生凝固性坏死[13]。然而无灌注区并不能等同凝固性坏死,动脉短暂痉挛或动脉栓塞后血管供血区也可表现为无灌注[14]。HIFU消融治疗子宫肌瘤的安全策略为肌瘤假包膜内消融;在这一策略下,肌瘤体积消融率约为80%[1,4,15]。本研究损伤组及完整组子宫肌瘤消融率分别为(86.91±17.78)%和(80.93±16.25)%,与既往研究[1,4,15]相符。本研究400例中,22.50%(90/400)出现子宫浆肌层局部环状强化缺损,由于缺少病理对照,此征象是否为组织凝固性坏死、MRI所示局部浆肌层灌注缺损的意义及其病理学转归尚需进一步研究。
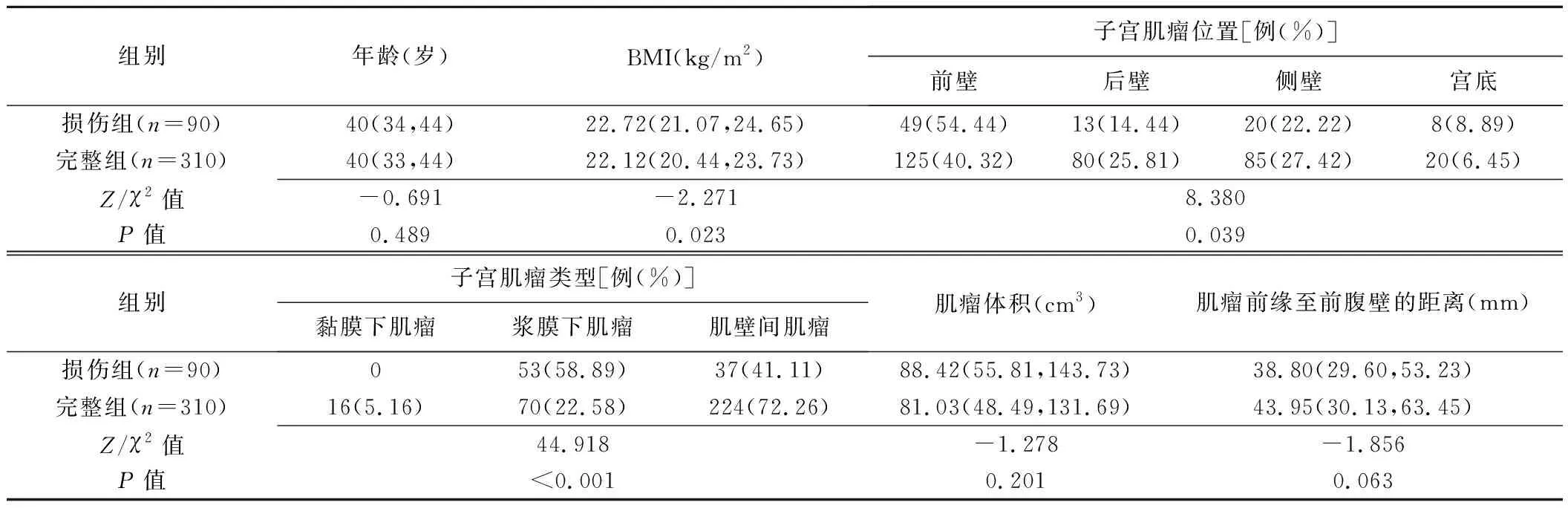
表1 2组患者年龄、BMI及HIFU消融术前子宫肌瘤MRI特征比较

表2 2组患者HIFU消融参数及消融治疗有效性评价指标比较[中位数(上下四分位数)]
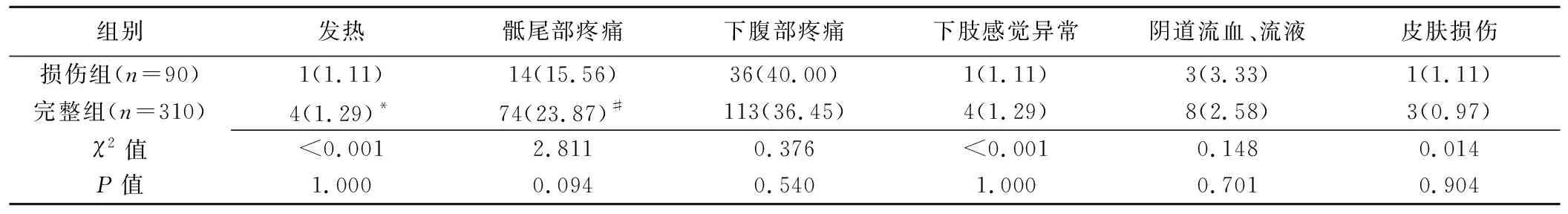
表3 2组患者HIFU消融术后并发症比较[例(%)]
注:*:其中1例为SIR B级;#:其中2例为SIR B级;其余并发症均为SIR A级
本研究2组患者HIFU消融术后妊娠率差异无统计学意义,且在孕期及分娩时均未发生子宫破裂等危重情况,表明MRI所示局部浆肌层灌注缺损与临床不良反应无明显相关性。HIFU治疗接近完全消融子宫肌瘤时,易对子宫浆肌层造成局部损伤,虽然对临床安全性无明显影响,但仍需重视,避免损伤过度导致严重后果。对HIFU消融术后妊娠者需予密切监控。
对HIFU消融所致子宫浆肌层损伤,应明确其原因并积极预防。本研究结果提示子宫肌瘤位置及类型对HIFU消融术后浆肌层损伤影响较大,宫底肌瘤及浆膜下肌瘤浆肌层损伤概率相对较高。此外,超声消融组织具有剂量-效应关系;但本研究中消融剂量并非导致浆肌层损伤的原因,2组间HIFU消融总剂量差异无统计学意义,而易消融肌瘤(消融剂量及EEF低、消融率高)浆肌层局部出现灌注缺损的风险更大。
HIFU消融子宫肌瘤术后增强MRI可能显示子宫浆肌层灌注缺损,尽管无明显相关临床不良事件发生,但仍应积极预防。对高BMI患者位于宫底的浆膜下子宫肌瘤及易消融肌瘤,术前应根据治疗目的、患者生育需求等进行充分评估,制定个体化治疗方案,以减少或避免出现浆肌层局部损伤。
