TEE引导下经胸微创封堵治疗先天性心脏病
2019-08-23任永凤蒋爱清刘晓燕
任永凤,王 洲,李 健,陆 静,蒋爱清,刘晓燕,冯 景
(亳州市人民医院超声科,安徽 亳州 236800)
我国常见出生缺陷中,先天性心脏病(congenital heart disease, CHD)占1/3,其发病率约为0.11%~2.3%[1]。发病率居前5位的CHD类型依次为室间隔缺损(ventricular septal defect, VSD)、房间隔缺损(atrial septal defect, ASD)、动脉导管未闭(patent ductus arteriosus, PDA)、肺动脉狭窄及法洛四联症[2-4],除法洛四联症外均为简单类型CHD,开胸心内直视外科矫治术创伤大、手术时间长且并发症多;DSA引导下经导管介入封堵术适用范围有限且存在放射性损伤,对于小儿无法在非全身麻醉下完成,现已逐渐被新式微创介入封堵治疗替代[5]。近年来,TEE引导下经胸或经导管介入封堵术逐渐显现其优势[6-7]。本研究探讨TEE引导下经胸微创封堵术治疗CHD的临床价值。
1 资料与方法
1.1 一般资料 回顾性分析2016年6月—2018年9月就诊于我院并接受TEE引导下经胸微创封堵治疗的50例CHD患者,其中男24例,女26例,年龄1~49岁,中位年龄17岁。纳入标准:①缺口残缘>3 mm;②残缘与主动脉瓣、三尖瓣、二尖瓣瓣根的距离满足封堵条件。排除标准:①出现右向左分流、复杂性心脏病、严重瓣膜病;②合并CHD以外的其他心脏疾病。50例中,单纯膜周部VSD 23例,肌部VSD 6例,中央型ASD 12例,膜周部VSD合并中央型ASD 1例,PDA 8例。见表1。
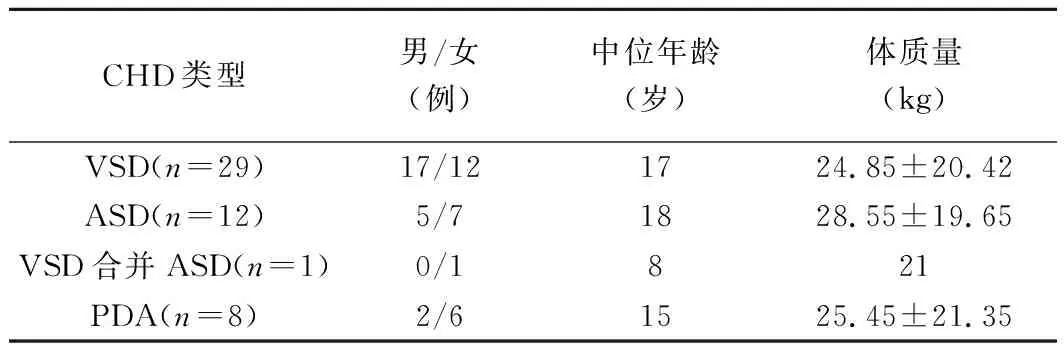
表1 不同类型CHD患者性别、年龄及体质量
1.2 仪器与方法 采用GE Vivid i及SonoSite Edge便携式超声诊断仪,S7-3及S8-3多平面经食道探头,探头频率4~8 MHz,行TEE检查并引导介入操作。
1.2.1 TEE检查 嘱患者平卧,在全身麻醉下将探头经口腔插入食管。标准扫查切面包括食管中段四腔心、五腔心切面,左心室长轴切面,双心房切面,上、下腔静脉切面,食管上段大动脉短轴切面及右心室流出道切面。封堵前再次明确CHD类型、位置、缺损大小、ASD/VSD残缘长度及与三尖瓣、二尖瓣、主动脉瓣、肺动脉瓣间的距离,以便进一步明确适应证并选择适合的封堵器(上海亚创生物医疗设备公司)。
1.2.2 穿刺点位置判断 常规取剑下长约3 cm切口,剪开胸骨下部及剑突,打开心包并悬吊。对VSD及PDA在右心室流出道无血管区、ASD在右心房无血管区以手指轻触确定震颤最明显部位后,以外科镊轻压不同位置,并观察TEE表现,如超声提示该处与VSD或ASD距离最近且与房间隔、室间隔最接近垂直、PDA角度最小,即可确定为穿刺点。
1.2.3 超声引导下穿刺及封堵 对VSD患者,于实时TEE引导下将穿刺导管经心脏缺损处送入左心室,将交换导丝置于左心室内,回撤导管,送入输送鞘后回撤导丝,沿输送鞘将封堵器送入左心室,释放封堵器左盘后回撤输送鞘,使左盘与室间隔贴合。以超声观察封堵伞与室间隔及周围瓣膜的位置关系、确定位置良好后,将封堵器腰部嵌入VSD,而后继续回撤输送鞘,释放封堵器右盘。对PDA患者,将穿刺导管送入肺动脉并经动脉导管送至降主动脉,其他介入操作同VSD。对ASD患者,于实时TEE引导下经胸穿刺右心房表面,将导管经ASD送入左心房。在超声监测下经鞘管将封堵器送至左心房,打开封堵器左心房侧伞(图1A),并于超声监视下缓慢回撤左心房侧伞,使伞面紧贴房间隔,多切面超声观察伞面附着良好后,固定输送杆,继续回撤鞘管,打开封堵器右心房侧伞,见封堵器呈“工”字型展开(图1B)后,反复推拉输送杆,以判断封堵器位置固定情况。
1.3 评价及随访 术中记录介入手术时间。术后即刻行TEE评价封堵效果。除标准扫查切面外,于重点部位(如封堵伞、周围瓣膜、大动脉等)调整角度(0°~180°),观察封堵器位置、形状、边缘、有无残余分流、附近瓣膜功能及对冠状静脉窦等有无影响。分别于术后1、3、6个月随访复查TEE,并通过心电图检查有无心律失常、传导阻滞等异常。
2 结果
49例封堵成功,1例膜周部VSD封堵失败,成功率98.00%(49/50);经胸封堵VSD、ASD及PDA手术时间为30~90 min,平均(65.15±20.58)min。
49例封堵成功患者中,11例术后即刻TEE可见残余分流;术后1、3、6个月复查均见封堵器位置正常,分流消失,无封堵导致的瓣膜反流,且心电图检查未见心律失常及传导阻滞。
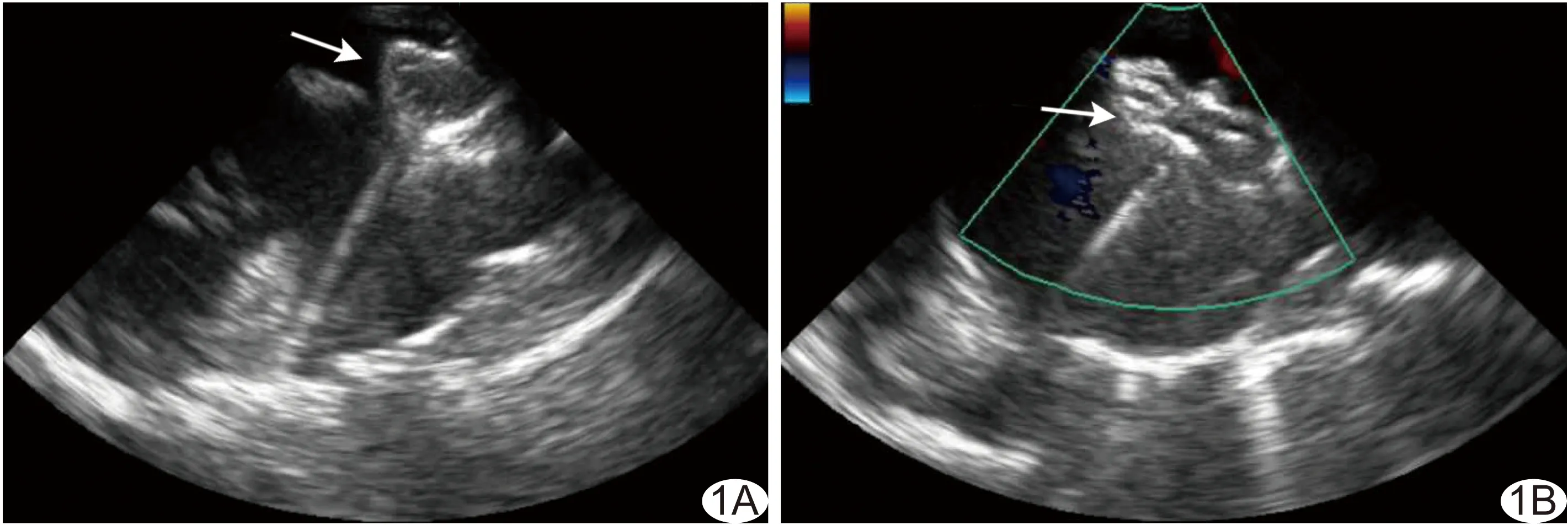
图1 患儿男,15岁,ASD A.TEE引导下隔封堵器左心房侧伞释放(箭); B. TEE引导下封堵器伞呈“工”字型展开(箭)
3 讨论
CHD为致死性较高的心脏疾患,微创封堵术在治疗简单类型CHD中逐渐获得青睐。随着技术进步及设备更新,在地市级医院开展TEE引导下微创介入封堵治疗简单类型CHD显示出一定可行性及推广价值[8-9]。Amplatzer双盘封堵器的问世使介入封堵成为治疗CHD的重要方式[10]。既往采用DSA引导治疗,患者和术者均长时间暴露于X线下,尤其是CHD患者多为小儿,各器官正处于发育阶段,更应注重减少放射损伤;而低龄及低体质量患者血管内径相对较小,受限于封堵器的规格,可能不适合进行封堵。TEE引导下CHD封堵术不仅可避免放射损伤,而且一旦封堵失败或出现其他危险状况,可立即进行开胸直视下外科修补术,可最大限度地保障患者安全。介入封堵前严格按照体质量标准(>5 kg)筛选患儿,有利于避免对食道造成损伤[11]。本组年龄最小的患儿仅1岁、体质量10 kg,介入封堵效果良好。
术前判断缺损口大小、位置及残缘情况从而指导封堵伞型号的选择十分重要。本组1例膜周部VSD经胸介入封堵治疗后2天因封堵伞脱落而转为外科开胸手术,于右肺动脉内取出封堵伞后行修补术;分析封堵失败原因,可能为膜周部VSD缺损口较大,且部分与三尖瓣隔瓣粘连,术中为避免封堵伞对瓣膜的影响而选择偏心型封堵伞,且型号偏小,释放后伞面倾斜,虽未即刻出现明显分流,但后期伞面受血流及隔瓣活动影响致使封堵伞移位而脱落。本组对12例中央型ASD及1例膜周部VSD合并中央型ASD患者均封堵成功,提示对ASD采用经胸微创封堵可有效减低因封堵伞与房间隔角度较大而致封堵失败的风险。
选择与缺损口角度最小、距离最近的穿刺点是封堵成功的关键[12]。本组选择穿刺点时均遵循此原则,TEE在其中起到了关键作用[13];23例膜周部VSD、6例肌部VSD及1例膜周部VSD合并中央型ASD,VSD封堵成功率达96.67%(29/30),与国内报道[14]基本一致。术前精确判断残缘、术中正确引导是VSD封堵成功的重要保障。此外,残余分流与封堵伞周围漏也是衡量介入封堵成功与否的关键。边缘漏主要是封堵伞位置不佳或封堵伞偏小有关;残余分流超声多表现为位于伞体的弯曲、短线状分流,随血细胞黏附及后期封堵伞周围组织细胞生长多可自行消失。本组11例出现残余分流,术后1、3、6个月随访复查均示残余分流消失。经胸微创室间隔缺损封堵术中国专家共识[14]指出,残余分流束<1 mm、血流速度<2 m/s时对血流动力学影响不大,可不予处理而仅随访观察;如分流束>1.5 mm、血流速度>3 m/s,则易产生机械性溶血,应更换封堵器。张璟等[15]报道经胸封堵20例肌部VSD成功,无相关并发症。肌部VSD边缘为肌性组织,且室间隔受瓣膜影响小,超声视野好,有利于介入封堵。本组6例肌部VSD封堵顺利,效果良好。随着非对称性、零边、细腰大边等封堵器的出现,经胸介入封堵的适用范围将进一步扩大[16]。
本组8例PDA经胸介入封堵均获成功。术中TEE可指导选择封堵器,同时引导导管送达指定位置,防止对心室壁造成损伤或导致管腔梗阻,还有助于判断封堵伞放置情况,并通过多切面观察判断有无残余分流及对左肺动脉、降主动脉有无影响。由于封堵器的特殊结构,介入封堵PDA的相对于VSD及ASD封堵更为简便,术后超声评估是判断是否封堵成功的关键。婴幼儿PDA植入封堵器后动脉导管最窄处直径大多增宽,患儿年龄越小越明显,选择封堵器时,应大于超声评估PDA最窄处4~6 mm,同时还要考虑主动脉端的大小,避免因伞盘造成主动脉狭窄。此外,PDA介入封堵时应避免封堵器过分向肺动脉端牵拉,造成医源性左肺动脉狭窄,TEE在其中具有重要作用。本组8例PDA均未出现管腔损伤或因伞盘造成肺动脉或主动脉狭窄。
TEE在CHD介入封堵治疗中能够清晰显示心内结构而不影响手术视野,可实时监测穿刺过程。总体上,TEE引导下介入封堵治疗CHD具有适用范围广、手术时间短、术后恢复快,且无辐射、无对比剂毒性、无需体外循环及输血等诸多优势,具有一定临床应用及推广价值。
