同种异体软骨脱细胞基质在关节软骨缺损中的应用研究
2019-08-22金诺王璐张洲铭同瑾李德超
金诺 王璐 张洲铭 同瑾 李德超
软骨自身修复能力非常有限,创伤、代谢和炎症均可引起不可逆的软骨损伤,最终导致关节软骨缺损,严重影响患者的健康和生活质量。目前,关节软骨缺损的临床治疗方法主要有关节镜技术,软骨移植等,但至今仍没有一种临床方法可以实现关节软骨的再生[1]。随着利用间充质干细胞(MSC)治疗难治性疾病的研究和临床应用不断涌现,通过组织工程的方法修复关节软骨缺损成为目前的研究热点[2]。
脱细胞基质支架是通过将生物组织通过脱细胞的方法获得的低免疫排斥性的组织工程支架。其低免疫原性和良好的生物相容性成为组织工程的又一研究热点[3]。经过脱细胞处理的真皮、心包、角膜、血管、膀胱 食管、小肠黏膜基质、骨、肝脏、肌肉、肌腱、腹壁等作为相应组织的组织工程支架在动物实验中均显示出良好的应用前景[4-8]。然而,脱细胞过程中引发的毒性试剂残留以及支架理化性能的改变仍限制了脱细胞基质的使用。尤其是关节缺损区往往为力学承载区和快速损耗部位,对材料的理化性能要求颇高,因此对组织工程支架的性能有着更苛刻的要求。
此研究优化了软骨脱细胞基质的制备方法,在去除同种异体软骨脱细胞基质免疫原性的同时维持了支架的理化性能,并通过兔膝关节缺损模型验证了材料的关节缺损修复效果。
1 材料与方法
1.1 细胞原代培养
新西兰大白兔(新生2 周)(第四军医大学口腔医院实验动物中心)肌肉注射过量戊巴比妥钠(吉林华牧)猝死后取材。取兔耳浸泡于75%酒精中30 min,磷酸盐缓冲盐水(PBS)浸洗3 遍。去除耳部皮肤及耳软骨骨膜,彻底游离兔耳软骨。将兔耳软骨剪成约1 mm×1 mm×1 mm大小的碎片。用含青霉素(100 U/ml)和链霉素(100 mg/ml)的PBS反复冲洗3 次。软骨样品加入含有0.2%胶原酶II型(Gibco,美国)含10%胎牛血清(Hyclone,美国)的低糖DMEM培养基(Gibco,美国),在摇床,37 ℃,120 r/mim,孵育12 h。消化完成后的软骨细胞悬液使用200 目的滤网过滤后,1 000 r/min离心5 min;弃上清,重悬细胞。软骨细胞培养液:15%胎牛血清,L-谷氨酰胺(272 mg/ ml;Sigma,美国),抗坏血酸2-磷酸酯(50 mg/ml;Sigma,美国),10 ng/ml碱性磷酸酶10 ng/ml碱性成纤维细胞生长因子(b-FGF,intitrogen,美国)的DMEM-低糖培养基。孵箱内原代培养48 h后初次换液,其后隔天换液。显微镜(Leica,德国)下观察细胞生长情况,细胞融合率达80%~90%时,用胰酶(0.25%;索莱科技有限公司)消化传代[9]。
取实验兔胫骨,剪断胫骨两端,用DMEM培养基反复冲洗骨髓腔,收集含有骨髓间充质干细胞的培养液后离心,加入新的骨髓干细胞培养液:10%胎牛血清(Hyclone,美国)的α-MEM培养基(Gibco,美国),重悬,原代培养48 h后初次换液,其后隔天换液。待细胞贴壁生长到培养瓶底部面积的80%~90%时传代。
1.2 软骨脱细胞膜片的制备
取二代软骨细胞,以1×107/cm2的密度接种在10 cm细胞培养皿中,加入软骨细胞培养液,隔天换液。高密度培养3 周后,取出软骨细胞膜片。数码相机拍照后进行常规HE染色和DAPI染色,在光学显微镜和荧光显微镜下观察并拍照。用细胞刮刀轻轻刮起细胞膜片,并用PBS漂洗3 次,5 min/次;然后加入10 ml的1%SDS脱细胞液,置于37 ℃,120 r/min恒温摇床内孵育,在30 min,1 h 和4 h时换SDS,孵育24 h后,弃去脱细胞液,PBS漂洗3 次,5 min/次;加入适量的1% Triton-X100,30 min后倒掉脱细胞液,再加入适量的PBS摇床上120 r/min漂洗24 h,之后加入5 ml,0.5 mg/ml脱氧核糖核酸酶。PBS 漂洗脱细胞膜片3 次,15 min/次,在用PBS浸泡24 h[10]。
1.3 扫描电镜
软骨脱细胞基质放入6 孔板内,无菌钢环压住膜片,加入BMSC细胞悬液,将MSC细胞与脱细胞基质共同培养在培养皿中(MSC+),植入细胞第10天,将孔板中的培养基吸掉,固定、脱水、-80 ℃冷冻,冷冻干燥24 h。冻干后的单纯软骨脱细胞基质和负载细胞后的软骨脱细胞基质喷金后SEM观察表面形态。
1.4 软骨向分化相关基因的检测
脱细胞膜片CO60放射48 h消毒,待用。实验分3 组,在普通培养皿上培养的BMMSCs(BMMSCs组);软骨脱细胞基质放入6 孔板内,无菌钢环压住膜片,加入BMMSCs细胞悬液,与软骨脱细胞基质共培养但未接触的BMMSCs(BMMSCs-组);软骨脱细胞基质表面接触生长的BMMSCs(BMMSCs+ 组)。培养箱内孵育将3 组分别培养至3、 5、7和21 d后将各组BMMSCs用E.Z.N.A.Total Kit I提取试剂盒(OMEGA, 美国)提取样本总 RNA,酶标仪测总 RNA 浓度, PrimeScript RT Master Mix反转录试剂盒(TakaRa,日本)反转录生成 cDNA 后。取样本 cDNA 进行使用 PrimeScript RT Master Mix(Perpect Real Time)试剂盒(TakaRa,日本)反应体系行Real-time PCR。反应条件:95 ℃预变性30 s;PCR反应95 ℃ 3 s,60 ℃ 30 s,循环40 次(表 1)。

表 1 实时定量PCR引物序列
1.5 动物分组及模型构建
将新西兰大白兔按0.05 ml/kg肌肉注射里陆眠宁诱导麻醉,10 min后耳缘静脉按0.1 ml/kg注射1%戊巴比妥注射液进行全身麻醉。碘伏消毒后铺单,推开髌骨韧带后于右腿膝关节外侧做矢状切口,分层剥离暴露膝关节关节面。用直径为4 mm的环锯在股骨膝关节面制造制造直径为4 mm,深度为4 mm的骨和软骨全层缺损,期间用生理盐水进行冲洗降温。对照组:关节缺损空白对照;实验组:将冻干灭菌的软骨脱细胞基质膜片植入关节缺损部位。复位髌骨韧带,分层缝合伤口进行缝合。术后连续按0.5 ml/kg肌肉注射0.5 g/ml先锋3 d。术后12 周取材,观察软骨缺损区修复情况。
1.6 HE及免疫组化染色
用4%多聚甲醛固定软骨细胞膜片和软骨脱细胞基质,石蜡包埋切片后行HE染色(脱蜡至水后,将切片放入苏木精染液中15 min,自来水洗5 min,用1%盐酸酒精分化20 s,自来水漂洗2 min;弱碱性水返蓝45 s;自来水漂洗10 min后开始伊红染色,细胞质染10 min;脱水透明后,用中性树胶封片)和DAPI荧光染色并在-80 ℃冰箱过夜后冻干机冻干24 h。
处死动物取出膝关节样本后,4%多聚甲醛固定48 h后浸泡在10%EDTA(雷根生物有限公司)脱钙液脱钙3 个月,脱钙完成后石蜡包埋,切片(厚度:5 μm)。HE染色并用兔HITC试剂盒(中杉金桥)进行COL-II染色,步骤参考说明书。
1.7 统计学处理
2 结 果
2.1 软骨脱细胞基质的制备
肉眼观察软骨细胞膜片呈毛玻璃状(图 1A),经脱细胞处理后呈透明胶冻样物质(图 1D)。HE染色可见软骨细胞膜片中的复层细胞结构以及大量细胞外基质(图 1B),而软骨脱细胞基质的HE 染色显示软骨细胞全部去除,软骨陷窝结构清晰,细胞外基质成分完整,形成一个多孔网状结构(图 1E)。DAPI染色也可见软骨细胞膜片中的大量细胞核染色(图 1C),而脱细胞膜片内无细胞核染色(图 1F)。说明本方法可良好去除组织内的细胞成分(抗原成分),并完整保存细胞外基质的构架和理化性能。
2.2 软骨脱细胞基质可诱导BMMSCs软骨向分化并分泌细胞外基质
通过实时定量PCR检测:I型胶原 (COL-I)、II 型胶原 (COL-II)、X型胶原(COL-X)、软骨蛋白聚糖(Aggrecan)、 SOX-9在BMMSCs、BMMSCs-和BMMSCs+组的转录水平,发现: BMMSCs+组中COL-I的表达量显著低于BMMSCs、BMMSCs-组(P<0.01),而BMMSCs-组中COL-I的表达量又明显低于BMMSCs组。说明软骨脱细胞基质可通过接触或非接触的方式抑制BMMSCs的成骨向分化。接触时间的延长对其成骨抑制作用并无明显作用。
BMMSCs+组中COL-II的表达量显著高于BMMSCs、BMMSCs-组(P<0.01),而BMMSCs-组中COL-II的表达量又明显低于BMMSCs组。说明软骨脱细胞基质可通过接触或是非接触的方式促进BMMSCs的软骨向分化。且软骨脱细胞基质对BMMSCs可起持续的软骨向诱导作用。在接触前期,接触时间越长,其诱导作用越强。
BMMSCs+组中COL-X的表达量显著低于BMMSCs、BMMSCs-组(P<0.05),而BMMSCs-组中COL-X的表达量又显著低于BMMSCs组。说明软骨脱细胞基质可通过接触或是非接触的方式抑制BMMSCs的软骨肥大和骨向分化。Aggrecan是软骨的主要结构大分子,3 组间并未见显著差异,说明软骨脱细胞基质对Aggrecan的合成并无显著促进作用。COL-II、Aggrecan基因表达升高的同时SOX-9也随之增高且表达量显著高于BMMSCs-、BMMSCs组。软骨脱细胞基质软骨脱细胞基质可能是通过SOX-9通路通过接触或是非接触的方式促进BMMSCs的软骨向分化(表 2)。

表 2 软骨向分化相关基因的表达
扫描电镜观察可见软骨脱细胞基质表面粗糙度良好,显示出良好的亲水性,并可见部分细胞陷窝(图 2A)。将BMMSCs种植与DCM表面7 d后的可见细胞黏附于DCM支架表面,并长入软骨陷窝内。DCM上大量细胞生长状态良好,可见伪足伸出,并可见大量细胞外基质分泌(图 2B)。以上结果显示软骨脱细胞基质支架生物相容性良好,无明显细胞毒性,与DCM接触可促进BMMSCs分泌细胞外基质。
2.3 软骨脱细胞基质促进兔关节缺损的修复
术后12 周取材对照组在软骨缺损区仍可见明显的中央凹陷区及缺损界限(图 3A)。HE染色也可见对照组缺损区新生软骨与周围正常软骨质间有明显界限(图 3B),软骨下骨质骨化不全。免疫组织化学染色显示缺损区表面Ⅱ型胶原表达量尚可但不均一(图 3C)。
与对照组相比,实验组软骨缺损基本修复,表面覆盖软骨较完整,缺损区软骨与周围软骨边界移行良好(图 3D)。HE染色见实验组缺损区新生软骨与周围正常软骨质地相似并融合良好,且软骨下骨质恢复良好(图 3E)。实验组软骨缺损区表面Ⅱ型胶原表达丰富且均匀,与周围正常软骨的表达量基本一致(图 3F)。
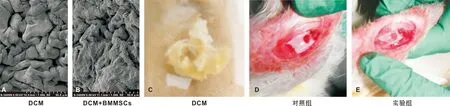
图 2 DCM用于兔膝关节缺损的修复

图 3 DCM可良好修复兔关节缺损
3 讨 论
成熟的软骨没有血管、神经组织和淋巴管,因此,如有损伤,其自我修复能力非常有限,损伤往往最终导致严重的软骨病变,如关节炎和关节退变等[1]。目前骨缺损的治疗方式包括自体或异体软骨移植。但是自体骨移植存在很多问题如:来源有限、供区损伤和增加患者痛苦等缺点。而异体软骨移植也有与宿主存在排斥反应和来源受限等问题。不过随着组织工程学的兴起和发展,关节骨软骨缺损的修复将成为可能[11]。
软骨组织工程是通过植入结构和功能上类似软骨的支架,促进关节软骨的修复和再生。细胞外基质(ECM)即组织中除细胞以外的所有成分,其中的胶原,非胶原糖蛋白 弹性蛋白 糖胺多糖等都具有重要的生物学性能,对细胞形状,细胞的迁移、增值、分化和代谢等有着直接的影响,其本身即是一种良好的组织工程支架材料。实验表明组织脱细胞基质可以为干细胞提供良好的生长环境,并在诱导干细胞的定向分化,最终达到组织再生的目的[10,12]。但是脱细胞不全以及脱细胞试剂的残留是导致免疫排斥反应和材料毒性是修复失败的原因。本研究用过体外扩增软骨细胞数量,促进软骨细胞分泌细胞外基质,并通过脱细胞等方法去除同种异体移植物的免疫原性来制造组织工程软骨支架。研究发现,通过体外培养的软骨膜片脱细胞彻底,免疫原性和细胞毒性极低,并且可以良好保持软骨细胞外基质的理化性能和软骨诱导活性。BMMSCs是骨髓来源的具有多向分化潜能的干细胞,可分化为成骨细胞、软骨细胞、骨骼肌细胞等多种细胞。关节损伤后,关节下方的骨髓腔则会就近提供BMMSCs参与组织修复[13-14]。因此该研究选择将BMMSCs与软骨脱细胞基质共同培养来模拟体内关节软骨修复情况,从而客观反映材料的生物相容性及对BMMSCs分化的影响[15]。SEM观察到BMMSCs在软骨脱细胞基质表面粘附良好,不但维持了BMMSCs的增殖能力还促进了BMMSCs分泌细胞外基质。qPCR发现BMMSCs与软骨脱细胞基质接触时COL-II表达量显著高于BMMSCs-、BMMSCs组,并且在前期随着时间增加,诱导能力还有所增强。COL-II是软骨的重要组成部分,是BMMSCs软骨向分化的标志蛋白。SOX-9是BMMSCs软骨向分化的重要转录因子[16],研究发现BMMSCs与软骨脱细胞基质接触时SOX-9的表达在BMMSCs+组同样较高,并且在前期随着时间增加,表达量持续提高,因此软骨脱细胞基质可能是通过SOX-9通路诱导了BMMSCs的软骨向分化。COL-I和COL-X为BMMSCs的骨向分化以及软骨肥大的标志蛋白,二者表达在BMMSCs+中明显降低且较BMMSCs-、BMMSCs组低,表明软骨脱细胞基质抑制了BMMSCs的软骨肥大和骨向分化。通过SEM也观察到软骨脱细胞基质可促进BMMSCs的外基质合成和分泌。
之后观察了同种异体软骨脱细胞基质在修复新西兰大白兔关节缺损中的治疗效果。结果发现实验组的关节表面较对照组更加平整,与周边正常软骨结构融合更好。说明软骨脱细胞基质不但可以促进关节缺损区的软骨修复,还可以快速诱导软骨下骨支持结构的形成。推测脱细胞基质膜片是通过在缺损区快速形成软骨后,通过软骨内骨化来促进软骨下骨支持结构形成的。此种修复方式也符合正常关节生长发育的生理模式。关节脱钙后通过HE染色和COL-II的免疫组织化学染色观察了软骨缺损区结构微观修复情况,结果发现实验组新生软骨与正常软骨结构相似并与周围软骨较多融合,软骨下骨组织恢复更好,COL-II表达量更高,表达量接近周围正常软骨。
综上所述,软骨脱细胞基质是一种可以诱导BMMSCs软骨向分化的优良组织工程支架。通过改进,大大降低了同种异体软骨脱细胞基质的免疫原性和细胞毒性,在体内关节缺损的修复中取得了满意的治疗效果,为同种异体软骨脱细胞基质在关节缺损的临床应用提供了良好的理论支持。
