转化生长因子β3促进兔牙髓干细胞成骨向分化的体外实验研究
2019-08-22艾力麦尔旦艾尼瓦尔张晓莉卡米力江买买提明日孜瓦古力阿木提木合塔尔霍加
艾力麦尔旦·艾尼瓦尔 张晓莉 卡米力江·买买提明 日孜瓦古力·阿木提 木合塔尔·霍加
牙髓干细胞(dental pulp stem cells,DPSCs)是外胚间充质来源的具有多向分化潜能的成体干细胞[1],随着组织工程技术的日益发展,其在各类支架材料和生长因子诱导下成骨向分化相关的研究愈来愈深入。转化生长因子-β(transforming growth factor β,TGF-β)是具有多重效能的生长因子超家族,参与调控机体胚胎发育、组织再生和免疫系统等众多方面[2]。TGF-β3 作为TGF-β超家族的一员,在细胞增殖、分化、信息传递、代谢和凋亡的调节中起重要作用,是组织工程研究中比较理想的细胞因子[3]。本课题组前期研究已证实TGF-β3对体外培养的兔牙髓干细胞(rabbit dental pulp stem cells,rDPSCs)增殖无影响但对其成骨向分化能力有一定促进作用,并在20~100 ng/ml范围内呈浓度依赖关系,以80 ng/ml效果最佳[4]。本实验探讨用80 ng/ml TGF-β3诱导rDPSCs,并将其成骨作用与矿化液(含10%FBS, l%双抗的DMEM高糖培养液中加入10 mmol/L β-甘油磷酸钠、100 nmol/L地塞米松、50 mg/L抗坏血酸)和常规培养的rDPSCs做对比研究,探讨rDPSCs体外在TGF-β3作用下成骨向分化的效果及其作用机制。
1 材料与方法
1.1 主要试剂与仪器
健康新西兰幼兔3 只,3~4 周龄,体重1.5~2.0 kg,雌雄不限(由新疆医科大学实验动物中心提供)。胎牛血清、磷酸盐缓冲液(PBS)、青链霉素、胰蛋白酶、高糖DMEM培养基 (Hyclone,美国);TGF-β3(Peprotech,美国);碱性磷酸酶(ALP)染色液(北京索莱宝);OCN一抗(Abcam,美国);COL-I一抗(Novus Biologicals,美国);Runx-2一抗(北京博奥森);茜素红S、L一抗坏血酸(Sigma,美国);β一甘油酸磷酸钠、地塞米松(武汉博士德)山羊抗兔二步法检测试剂盒(北京中衫金桥);实时荧光定量PCR仪(RT-qPCR)(Bio-Rad,美国);倒置显微镜(Leica,德国)。
1.2 rDPSCs分离及培养
盐酸利多卡因快速过量注射兔耳缘静脉将其处死,无菌条件下取上下颌骨置于预冷的高倍双抗中侵泡20 min,移置于培养皿中PBS冲洗3 次,剪除颌骨分离牙齿并剪掉根尖处1 mm牙体组织,拔髓针拔出牙髓,参照本课题组前期实验方法[5-6],酶解组织块法分离培养原代rDPSCs,每2~3 d换液1 次,待细胞长满培养皿80%~90%后0.25%胰酶消化传代培养。
1.3 免疫细胞化学染色
取生长状态良好的第三代rDPSCs,6×103/L细胞浓度接种于24 孔板中,分组培养第3、5、7、14 d各取1 块培养板,4%多聚甲醛固定50 min,PBS洗3 次,5%进口羊血清封闭30 min,滴加一抗 (稀释比例分别为OCN 1∶1 000,COL-I 1∶300,Runx-2 1∶400)4 ℃孵育过夜(至少16 h),PBS洗3 次,滴加二抗室温避光孵育1 h,PBS洗3 次,DAB显色,苏木素复染,倒置显微镜下观察并拍照,每组实验重复3 次。胞质内出现棕黄色颗粒为阳性结果,颜色越深表明阳性程度越强。
1.4 RT-qPCR
取第三代细胞1×106个/孔接种于6 孔板中分组培养,培养第7、14天,用Trizol法提取细胞mRNA,第一链cDNA逆转录试剂盒合成第一链cDNA模板,以β-actin为内参对照。引物由广州天一辉远公司设计合成(引物序列见表 1),PCR反应条件:50 ℃ 2 min,95 ℃ 10 min,95 ℃ 30 s ,60 ℃ 30 s,40循环。最终数据以2-△△Ct进行分析,Graphpad 7.0软件绘图。
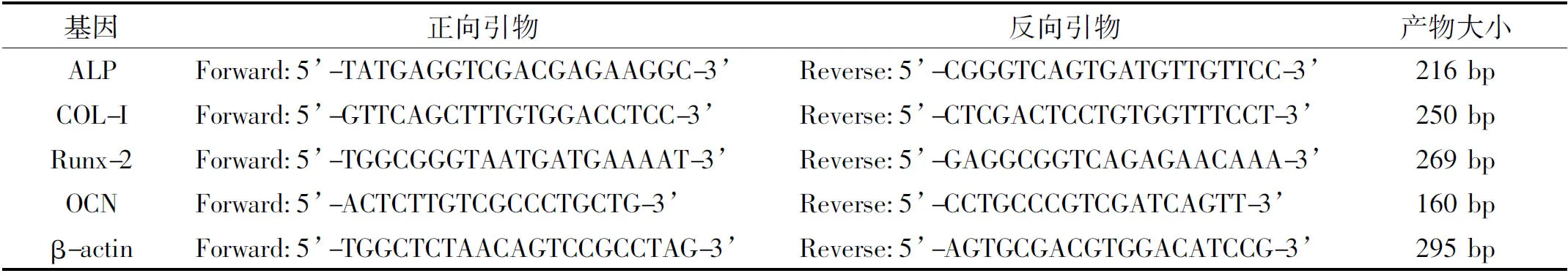
表 1 本研究中PCR基因引物序列
1.5 茜素红染色
取第三代rDPSCs,以2×106/孔浓度接种于六孔板,待细胞贴壁随机分为3 组开始实验,第7、14、21天各组取一块培养板弃培养液,PBS冲洗后用4%多聚甲醛室温细胞固定50 min,PBS洗3 次,现配的1%茜素红染液1 ml室温孵育30 min后蒸馏水轻轻冲洗表面的染液,自然干燥,镜下观察矿化结节并拍照,在50 倍镜下,每个孔随机选取中段5 个视野计算其矿化结节数量并分析各组之间的差异。
1.6 统计学分析
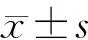
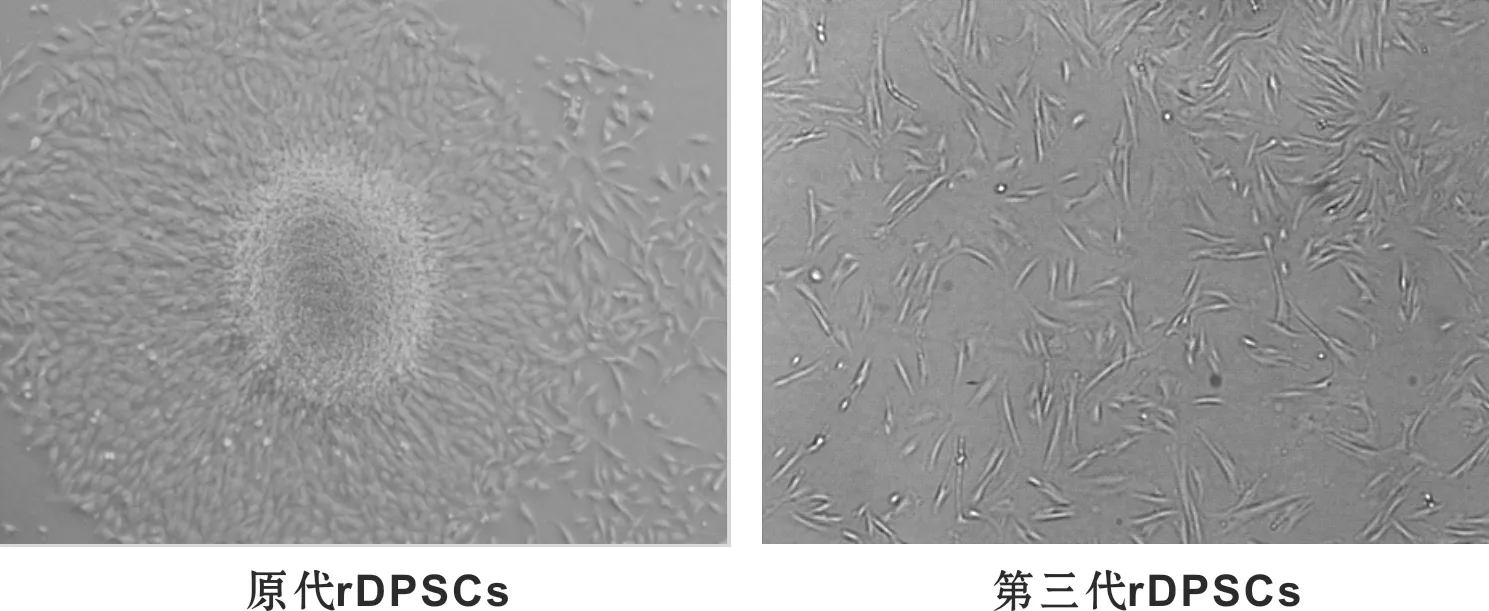
图 1 原代培养3 d的rDPSCs(倒置显微镜, ×50)
Fig 1 Primarly cultured rDPSCs for 3 days (Inverted Microscope, ×50)
2 结 果
2.1 rDPSCs形态学观察
酶解组织块法成功分离获得rDPSCs,48 h即可见组织块周围爬出来的原代细胞(图 1A),细胞贴壁生长,形态多呈梭形和纺锤形,少数呈三角形、多角形。约6~8 d汇合达到80%~90%,进行首次传代,随培养时间和代数增加细胞形态单一呈长梭形(图 1B)。
2.2 免疫细胞化学染色结果
实验组3 d出现COL-I强阳性,Runx-2第7天出现强阳性,OCN第7天出现弱阳性,第14天强阳性;对照组7 d出现COL-I阳性,第7天Runx-2弱阳性,第14天Runx-2强阳性、OCN弱阳性;空白组第7天出现COL-I弱阳性,14 d Runx-2弱阳性,OCN为阴性(图 2)。
2.3 RT-qPCR结果
RT-qPCR结果显示(图 3),各组培养第7天在实验组中ALP、COL-I、Runx-2基因的表达量均高于空白组(其中ALP、COL-IP<0.01,Runx-2P<0.05)ALP,COL-I基因表达量高于对照组(COL-IP<0.01,ALPP<0.05);培养14 d,实验组ALP、COL-I、Runx-2、OCN基因表达均高于空白组(P<0.01),另外,实验组ALP、COL-I基因的表达高于对照组(P<0.05)。
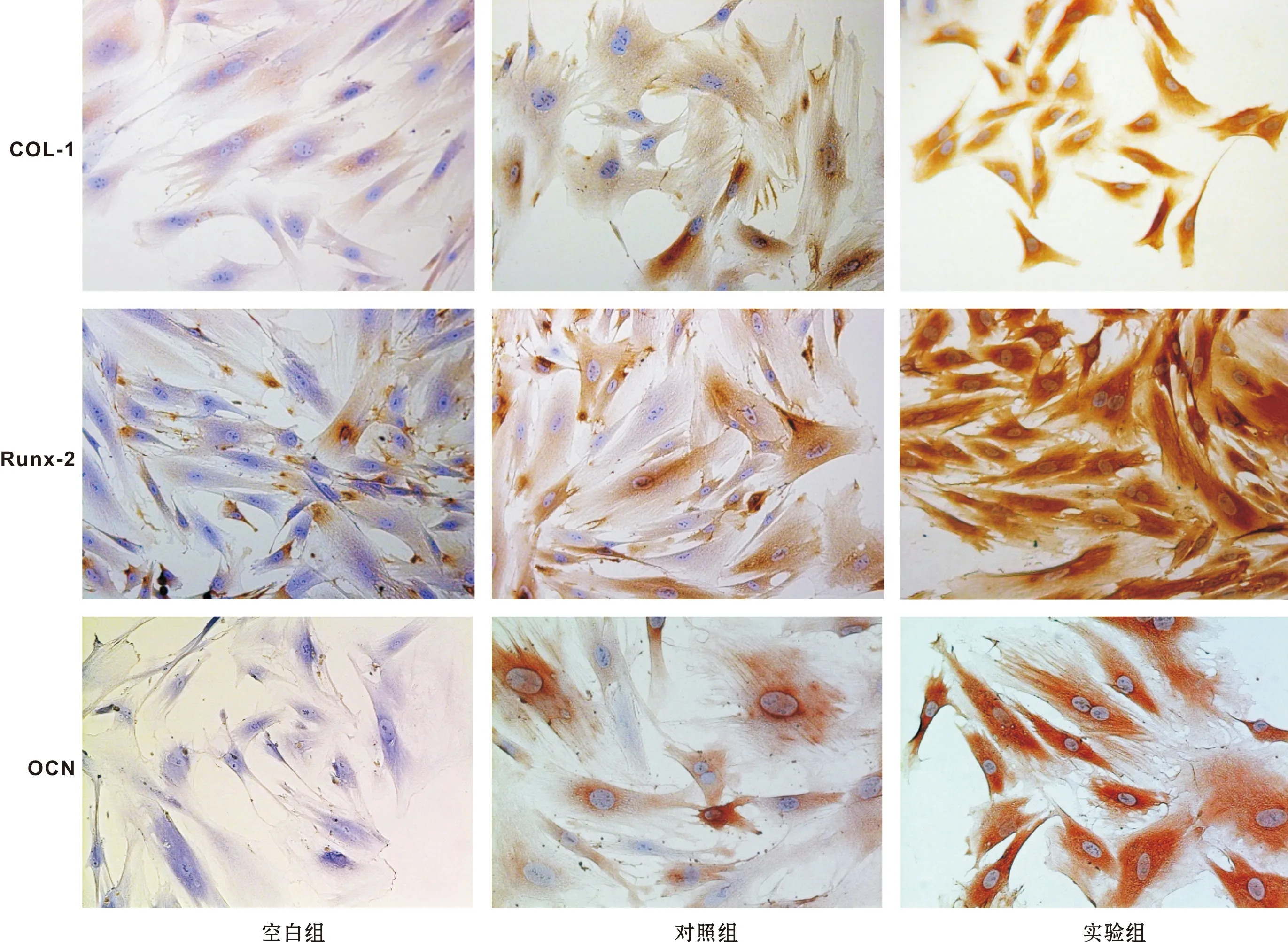
图 2 rDPSCs的COL-I免疫细胞化学染色结果 (×200)
Fig 2 Immunohistochemical staining for COL-I expression of rDPSCs (×200)

图 3 rDPSCs中ALP、COL-I、Runx-2、OCN基因表达情况
2.4 茜素红染色结果
实验组培养第7天细胞排列呈簇状聚集;培养14 d,实验组出现细胞汇合并且细胞排列呈以矿化结节为中心的火山口样、漩涡状,有的呈长线形排列,局部聚集成灶,肉眼观察可见白色结节,茜素红染色即可见多个大小不等的矿化结节,其余两组均无结节。培养21 d,实验组、对照组及空白组均出现矿化结节,实验组矿化结多且明显(图 4)。矿化结节数分别为实验组2.20±0.83,对照组1.20±0.45,空白组0.40±0.54,实验组与其余2 组均有统计学差异(P<0.05)。

图 4 rDPSCs茜素红染色 (×50)
Fig 4 ARS staining of rDPSCs (×50)
3 讨 论
创伤、肿瘤、炎症以及牙源性、牙周源性疾病引起的颌面部骨缺损的修复是骨组织工程面临的重要问题。临床上常用的颌面部修复方法主要是自体骨和异体骨移植修复,其中自体骨移植修复被公认为是金标准,但其有自身的缺点如有限的骨组织量,手术引起的痛苦,免疫问题如炎症和骨吸收等。所以在最短的时间内尽可能全面地修复骨缺损仍然是目前骨组织工程的研究热点。已有研究证实DPSCs相比骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)具有更好的克隆形成能力、增殖能力和成骨向分化能力[7-8],而且DPSCs由颅神经嵴来源的外胚间充质发育而成,与颅颌面骨及牙周组织具有相同的组织来源,因此选取DPSCs作为颅颌面骨缺损修复较骨髓基质干细胞具有更丰富的分化潜能和同源优越性。
目前哺乳类动物已发现3 个TGF-β亚型,即TGF-β1、TGF-β2、TGF-β3。TGF-β3作为较新被发现的TGF-β亚型,其在软骨发生和软骨再生中的重要调节作用相关研究最为成熟[9]。TGF-β3具有抗纤维化作用,能够促进创伤愈合和瘢痕形,参与组织修复的多重过程[10]。Hara等[11]证实2 μg/ml的醋酸氟轻松(FA)和5 ng/ml 浓度的TGF-β3联合人骨髓间充质细胞能促进小鼠的膝关节软骨缺损模型中缺损部位的软骨再生。最近有学者证明了TGF-β3对干细胞成骨向分化和成牙本质向分化过程中的协助作用。Deng等[12]发现25 ng/ml的TGF-β3能够诱导人骨髓间充质干细胞(hBMMSCs)通过激活TGF-β信号通路向成骨向分化从而刺激骨再生。Huojia等[13]证实TGF-β3在10~100 ng/μl范围内能够以剂量依赖的方式促进DPSCs的异位矿化、促进DPSCs成牙本质向分化。但TGF-β3在DPSCs成骨分化和骨形成过程中的作用和机制尚不清楚。通过本研究,证实了TGF-β3体外通过上调成骨标志基因的表达来促进rDPSCs的成骨向分化。
鉴定成骨形成的经典标准有高表达ALP,合成COL-I、形成OCN等骨基质蛋白、体外形成矿化结节。成骨细胞膜表面表达高强度的ALP,是成骨细胞分化的早期指标。COL-I是骨基质的重要组成部分,也是成骨细胞重要的特异性基因。OCN在成骨细胞分化晚期开始活跃,其表达升高说明成骨细胞开始进入矿化期[14-15]。Runx-2又称核心结合因子Cbfα1,是成骨分化和骨形成过程中的重要调节因子,出现在成骨分化的早期,可激活、启动下游包括 ALP、OCN和COL-I等基因的转录和表达,在尚未成熟的成骨细胞中表达最高而随着成骨细胞的成熟其表达下降[15-16]。本实验以ALP、COL-I、OCN、Runx-2为检测指标,RT-qPCR结果显示实验组ALP水平明显高于其余两组并第7天表达量最高,表明实验组成骨向分化水平一周左右就达到峰值。免疫细胞化学结果显示实验组COL-I,Runx-2,OCN表达的时间早且均强于其余两组。ALP、COL-I、Runx-2及OCN基因含量均高于对照组,说明TGF-β3诱导rDPSCs通过上调ALP、COL-I、OCN、Runx-2等的表达从而加速其成骨向分化,效果优于矿化液诱导组。成骨向分化的最终环节是细胞外基质矿化,实验组诱导第14天即出现明显的矿化结节,表明TGF-β3诱导组具有比其余两组更强的体外矿化能力。
综上,通过本研究证实80 ng/ml TGF-β3体外能够促进rDPSC向成骨向分化,有效缩短其成骨时间,为将其运用到颌面部及种植体周围骨缺损的修复及组织工程提供了一定的依据和新的视角。
