电针五脏俞治疗PCPA诱导大鼠失眠的疗效观察❋
2019-08-22李云飞
唐 雷,徐 芬,胡 星,李云飞
(华中科技大学同济医学院附属武汉市中心医院康复科,武汉 430000)
失眠是指无法入睡或保持睡眠状态[1]。调查显示,全球约有31%~56%的人受到失眠困扰[2]。长期失眠不仅会使免疫功能下降,还会增加糖尿病、高血压等疾病的风险[3-4]。近年来,临床上以药物治疗失眠为主,而大多数药物长期服用易产生耐药性和依赖性[5],因此研究非药物治疗的重要性日益凸显[6]。
现代针灸中的电针“五脏俞”疗法是在对失眠发病机制全面认识基础上制定的[7-8]。有研究显示,睡眠剥夺能加快机体新陈代谢,增加自由基,降低超氧化物歧化酶(SOD)活性,并形成大量脂质过氧化物丙二醛(MDA)[9]。此外,失眠症与神经元活性也密切相关,PCPA长时期刺激会导致神经元线粒体功能损伤[10]。脑源性神经营养因子(BDNF)具有促进多种神经元存活和轴突再生、防止发育中神经元凋亡、调节神经递质释放等作用,BDNF表达下调则可能对神经可塑性造成有害影响[11]。NeuN是一种稳定而敏感的成熟神经细胞特异抗原结合物,参与神经系统的发育、分化和功能,常作为成熟神经元存活的主要检测指标[12]。
因此,本文笔者采用电针五脏俞治疗PCPA致大鼠失眠,并从多方面观察其疗效,与常规药物治疗进行对比,探讨其干预失眠的作用机制,为临床电针五脏俞治疗失眠症提供理论基础。
1 材料与方法
1.1 材料
雄性Sprague Dawley大鼠购自华中农业大学实验动物中心,饲养于SPF动物房;PCPA、地西泮购自Sigma公司;RIPA裂解液、TUNEL试剂盒、SOD试剂盒、MDA试剂盒购自Bioswamp公司;BDNF抗体、NeuN抗体、GAPDH抗体购自CST公司;反转录试剂盒购自Takara公司。
1.2 方法
1.2.1 PCPA诱导大鼠失眠模型的建立与评估 模型建立[13]:40只大鼠按随机数字表法分为正常对照组、PCPA模型组、地西泮西药组及电针疗法组4组,适应性喂养1周。PCPA模型组连续2 d腹腔注射PCPA混悬液(30 mg/100 g),若大鼠出现易受声光等激扰而狂躁不安、不让抓握、昼伏夜出节律消失等行为,表明造模成功,而后不予以任何处理。地西泮西药组造模成功后,连续7 d以地西泮(0.9 mg/kg)水溶液灌胃。电针疗法组造模成功后连续7 d针刺治疗大鼠肺俞、心俞、肝俞、脾俞、肾俞,频率60 Hz,治疗时间15 min,强度以针柄轻微颤动为宜。
模型评估:行为学观察,如模型组及干预组大鼠在第1次腹腔注射PCPA后28~30 h间,出现昼伏夜出节律消失,白天活动不止,总睡眠时间减少,且性情烦躁,攻击性增强,整体观察与对照组明显不同,则表明模型复制成功。体质量监测:正常对照组不给予任何处理。各组大鼠分别在实验前、造模第1天、治疗第1天及治疗第7天称量体质量。
1.2.2 大鼠血清SOD活性和MDA含量测定 治疗结束后次日麻醉大鼠,取腹主动脉血5 mL,离心并收集上清,按试剂盒说明操作分别检测SOD活性和MDA含量。
1.2.3 大鼠海马TUNEL染色 治疗结束次日处死大鼠取出海马,4%多聚甲醛固定48 h。各组样本制石蜡切片,脱蜡水化,按试剂盒说明操作分别进行染色并计算细胞凋亡率。
1.2.4 RT-PCR、Western blot检测大鼠海马NeuN、BDNF的mRNA及蛋白表达 治疗结束次日处死大鼠取出海马,一部分样品提总RNA并反转录,行cDNA扩增。条件为95 ℃预变性3 min,95 ℃变性7 s,56 ℃退火延伸30 s,45个循环。剩余海马样品RIPA提取总蛋白。SDS-PAGE后,分别以稀释比1∶500、1∶500、1∶1000加NeuN、BDNF、GAPDH一抗,4 ℃孵过夜;加二抗,采用化学发光仪曝光条带。
1.3 统计学方法
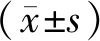
2 结果与分析
2.1 对大鼠行为学与体质量的影响
图1显示,给予PCPA注射大鼠约24 h后对外界声光刺激异常敏感,兴奋性增强,昼夜节律紊乱,表明失眠模型复制成功。地西泮西药组及电针疗法组大鼠经治疗后,精神状态、行为活动趋于正常,昼夜节律逐渐恢复;而PCPA模型组大鼠精神萎靡,饮食不振,昼夜节律恢复较慢;正常对照组大鼠生活、睡眠规律无明显变化。实验前及造模第1天,各组大鼠体质量平稳增长,组间无明显差异。治疗第1天,失眠使大鼠体质量显著下降,除正常对照组外的各组大鼠体质量间无明显差异。而治疗第7天,各组大鼠平均体质量由重至轻依次为正常对照组、电针疗法组、地西泮西药组及PCPA模型组,组间差异性显著,其中正常对照组体质量正常增长,PCPA模型组增长缓慢,电针疗法组、地西泮西药组经治疗后体质量呈恢复性增加。

图1 各组大鼠不同时间点体质量变化比较(g)
2.2 大鼠血清SOD活性和MDA含量的变化
表1显示,与正常对照组比较,PCPA模型组大鼠血清SOD活性、SOD/MDA值降低(均P<0.05),MDA含量升高(P<0.05);地西泮西药组SOD活性与对照组比较差异无统计学意义,但MDA含量、SOD/MDA值分别低于和高于模型组(均P<0.05);电针疗法组SOD活性高于对照组(P<0.05),MDA含量、SOD/MDA值与地西泮西药组比较差异无统计学意义。

表1 大鼠血清SOD活性及MDA含量比较
注:与对照组比较:*P<0.05;与模型组比较:※P<0.05;与地西泮西药组比较:#P<0.05
2.3 大鼠海马TUNEL凋亡染色的变化
图2表2显示,TUNEL检测大鼠海马区凋亡情况显示,正常对照组的大鼠海马神经元仅出现少量凋亡且分布分散,细胞凋亡率最低;PCPA模型组的大鼠海马神经元凋亡数量显著增多且分布密集,细胞凋亡率最高;地西泮西药组、电针疗法组的大鼠海马区阳性细胞数及细胞凋亡率较PCPA模型组均明显降低。
图2 大鼠海马TUNEL检测细胞凋亡的结果

组别正常对照组PCPA模型组地西泮西药组电针疗法组凋亡率(%)7.56±1.2374.89±5.66∗37.84±3.59∗※36.19±3.94∗※
注:与对照组比较:*P<0.05;与模型组比较:※P<0.05
2.4 大鼠海马NeuN和BDNF的mRNA及蛋白表达情况

表3 大鼠海马NeuN及BDNF的mRNA及蛋白表达差异比较
注:与对照组比较:*P<0.05;与模型组比较:※P<0.05;与地西泮西药组比较:#P<0.05
表3图3显示,与正常对照组比较,PCPA模型组大鼠海马中NeuN的mRNA及蛋白表达明显降低(均P<0.05);与PCPA模型组比较,地西泮西药组及电针疗法组经治疗能够显著提高大鼠海马中NeuN的mRNA及蛋白表达,尤以电针疗法组表达水平提升更为明显(均P<0.05)。各组大鼠海马中BDNF的mRNA及蛋白表达情况也同样符合上述规律。
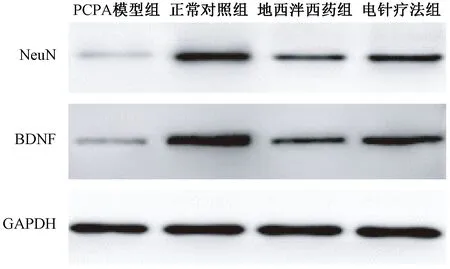
图3 各组大鼠海马NeuN及BDNF的蛋白表达条带
3 讨论
失眠症属于中医“不寐”范畴。不寐发病机制主要以五脏功能紊乱为基础,以五神失守为表现[14]。电针五脏俞治疗失眠,是对失眠发病机制全面认识的基础上结合前期研究结果制定的[15-16]。五脏俞即肺俞、心俞、肝俞、脾俞、肾俞,其对五脏功能有直接双向调理作用[17]。《素问·宣明五气篇》:“五脏所藏:心藏神,肺藏魄,肝藏魂,脾藏意,肾藏志”,说明五脏的生理活动与精神情志密切相关,五脏功能失调导致精神情志失常,继而导致不寐的发生。电针刺激有调节外周神经、镇静作用,使人体脑有所依、神有所归,在临床中配合五脏俞可起到很好的宁神安寐之功[18]。本实验成功复制PCPA致大鼠失眠经典模型,从昼夜不间断观察中我们发现,与PCPA模型组比较,失眠大鼠经电针五脏俞治疗后精神状态、行为活动趋于正常,昼夜节律、体质量增速逐渐恢复,对大鼠失眠状态的整体改观稍优于地西泮西药组,提示电针五脏俞能促进失眠大鼠体内生理功能恢复,改善中枢神经活动。
观察各组大鼠海马TUNEL染色结果可以看出,相较正常对照组,PCPA模型组海马区神经元凋亡严重、凋亡率最高,而电针疗法组神经元细胞相较模型组凋亡程度明显减轻、凋亡率降低,地西泮西药组海马凋亡减弱程度与电针疗法组接近。由此电针五脏俞对失眠大鼠中枢神经的调节保护作用得以初步显现。现代医学认为,通过针刺背俞穴调节植物神经,能影响机体氧化与抗氧化系统平衡[19]。SOD是一种重要的抗氧化剂,外源性补充适量SOD能够有效清除体内过量氧自由基,延缓细胞衰老,最终起到防病治疗的作用[20]。而病理情况下,SOD活性降低,导致氧自由基过量聚集,引发脂质过氧化反应,形成MDA等脂质过氧化产物,损伤生物膜进而使细胞死亡[21]。在本研究中,电针疗法组SOD/MDA值高于PCPA模型组和地西泮西药组,与正常对照组接近。提示电针五脏俞可通过促进机体血清SOD活性和降低MDA合成,从而缓解PCPA致失眠引起的氧化应激、自由基水平上升、机体氧化与抗氧化系统紊乱,再次验证电针五脏俞具有促进大鼠体内生理功能,改善睡眠的效果。肖爱娇等研究同样发现,热敏灸具有缓解PCPA所致失眠大鼠症状的作用,且能显著提高机体SOD活性,降低MDA含量[22]。NeuN是一种稳定而敏感的成熟神经细胞特异抗原结合物,参与神经系统的发育、分化和功能,在大部分神经细胞种类中表达,常作为成熟神经元存活的主要检测指标[12],已被广泛用于神经发育学、病理组织诊断学以及干细胞临床研究等领域[23-24]。BDNF是目前为止研究最多的神经营养因子,其合成于脑,广泛分布于大脑皮质及海马区域,BDNF表达下调会损伤神经可塑性[25]。本实验分别在基因和蛋白水平检测大鼠海马NeuN和BDNF的表达。结果表明,PCPA模型组大鼠海马区NeuN和BDNF的mRNA表达较正常对照组显著下调,而电针疗法组的显著上调;蛋白检测结果与mRNA水平检测基本一致,且电针组2指标变化与西药组比较差异有统计学意义。提示PCPA剥夺睡眠会造成大鼠脑神经元的缺失,使神经元出现死亡,这可能与内源性神经再生受到抑制和神经元严重损伤有关。而通过针刺五脏俞能显著促进BDNF的释放,从而间接刺激神经发生和神经元的生长,提高海马神经元内NeuN的表达,且电针组治疗效果明显高于西药组。以上结果均表明,电针治疗对失眠后脑神经修复发挥着重要作用。
综上所述,笔者认为电针五脏俞促进体内生理功能,改善中枢神经活动的机制是通过内部促进大鼠海马区营养因子BDNF的释放,从而增加脑内能正常表达NeuN的神经元数目,减少神经元细胞凋亡,提高血清SOD活性,下调MDA含量以缓解PCPA造成的机体氧化与抗氧化系统紊乱,使大鼠外在精神面貌愈发转好,昼夜节律、体质量增速愈发恢复,进而达到治疗失眠的目的。电针五脏俞刺激对失眠大鼠脑神经的修复损伤和保护作用稍优于常规西药地西泮,且电针五脏俞操作简便,无不良反应,可使失眠患者摆脱药物治疗烦恼,具有较强的临床实用性,适宜临床推广。至于电针五脏俞刺激提高海马区BDNF及NeuN表达的机制仍需进一步的深入研究。
