肾衰康灌肠液通过内质网应激对HK-2细胞缺氧/复氧损伤的保护作用及机制研究❋
2019-08-22罗芯怡叶乃菁邓荣荣李明权
罗芯怡,叶乃菁,邓荣荣,李明权
(1.成都中医药大学,成都 610075; 2.成都中医药大学附属医院,成都 610075)
急性肾损伤(acute kidney injury,AKI)是常见的急危重症,其死亡率高,缺乏有效的治疗措施,临床以对症处理和肾脏替代治疗为主,缺乏有效的治疗药物,严重威胁影响患者的生命安全和生存质量。缺血性急性肾损伤是急性肾损伤的主要类型,占75%以上[1]。研究表明,内质网应激(endoplasmic reticulum stress, ERS)引起促生存信号通路和促凋亡信号通路调控失衡,导致肾小管上皮细胞过度凋亡,是缺血性急性肾损伤发生发展的关键机制[2-4]。ERS蛋白如内质网功能调节蛋白(GRP78)、内质网源性转录因子(CHOP)等表达增加,可提高ERS状态下细胞处理未折叠蛋白或抵御其他细胞应激的能力[5]。
肾衰康灌肠液是目前以急性肾损伤为适应症的惟一上市应用的中成药,具有确切的临床疗效,但肾衰康灌肠液在细胞层面对急性肾损伤的治疗作用研究缺乏。为验证该药的有效性,本实验采用体外培养人肾小管上皮细胞(HK-2细胞)缺氧再复氧模型模拟肾缺血再灌注损伤,以排除在体各因素的影响,观察细胞凋亡情况及GRP78、CHOP表达的变化,探讨肾衰康灌肠液是否有抗内质网应激治疗缺血性急性肾损伤的作用。
1 材料与方法
1.1 实验动物
健康新西兰SPFWistar级大白兔6只,雌雄各半,体质量 2.0~2.2 kg,购自达硕公司[合格证号SCXK(川)2012-11],动物分笼饲养,保持室内相对湿度(60±5)%,温度20~22 ℃,室内12 h明暗自动切换,自由饮水,标准饲料喂养。
1.2 实验药物
实验药品:肾衰康灌肠液(大黄、黄芪、丹参、红花组成),20 ml×10支/盒,海南天元制药厂提供(批号Z46020083),常温保存。对照灌肠液:PBS溶液,成都中医药大学中心实验室配置,保存于室温中。
1.3 试剂及仪器
实验试剂: CHOP、GRP78抗体均由Abcam公司提供,HK-2细胞、DMEN/F12由Gibco公司提供, CFSE及PI染液由Sigma公司提供,细胞凋亡检测试剂盒由BD公司提供,活性氧检测试剂由Invitrogen公司提供等。 实验仪器:正置、倒置荧光显微镜(BX51,OLYMPUS/日本),流式仪(bio-rad),离心机(ST16R,Thereto/美国),超净工作台(SW-CJ-1FD,苏净安泰),高频数控超声波清洗器(KQ-200TDB,昆山市超声仪器有限公司),电泳系统(PowerPac Basic, Bio-rad/美国),恒温震荡箱(QYC-200型,上海福玛), RT-PCR仪(PIKORed96,美国ThermoFisher仪器有限公司)、冰柜(DW-40 W 100,海尔)等。
1.4 实验方法
1.4.1 含药血清的制备及标本采集 动物饲养于成都中医药大学实验动物中心SPF级实验室,购买后适应性喂养1周,按体质量随机分为正常血清组、空白组、肾衰康灌肠液高剂量组3组各2只。
正常血清组给予正常喂养;肾衰康灌肠液高剂量组给予肾衰康灌肠液灌肠,药量按人与动物体表面积换算得出,高剂量为9.617 ml·kg-1[6-7];空白组给予等量PBS溶液灌肠。肾衰康灌肠液高剂量组和空白组每天灌肠量分4次完成,于第4天上午灌肠1次后,3组兔子分别采血离心取上清、过滤除菌。
以肾衰康灌肠液高剂量组血清与正常血清组血清按比例混合,制备肾衰康灌肠液中剂量组血清(含高剂量组血清50%)和肾衰康灌肠液低剂量组血清(含高剂量组血清25%)。将空白组、肾衰康灌肠液高剂量组、肾衰康灌肠液中剂量组、肾衰康灌肠液低剂量组各组血清冷存。
1.4.2 细胞培养、分组及处理 人肾小管上皮细胞株(HK-2细胞)以含 10%胎牛血清的DMEM/F12培养液在37 ℃、5%CO2、饱和湿度条件下传代培养,同步化24 h。
1.当前在小学生英语的教学领域,有一大部分教师沿用传统英语教学方法,不仅在方法上被时代所淘汰,在教学理念上也非常陈旧和落后,很多农村的教师在新式的教学方法方面几乎没有涉及过信息化教学模式,在他们的教学过程中根本无法有效地在课堂上吸引学生的注意力。在这种情况下,学生学习积极性很难被充分调动。
取2组细胞,空白组常规培养,不预缺氧/复氧处理,也不加含药血清处理;模型组细胞密封处理,以模拟体内细胞缺血再灌注损伤过程,然后检测从造模开始(0 h)0、1、2、3、4、5、6、7 h各组细胞内ROS水平,以推测细胞缺氧复氧的造模时间。
造模时间确定后,随机分为正常培养组、缺氧/复氧组、低剂量组、中剂量组、高剂量组5组。正常培养组加入空白组兔血清(含PBS血清),其余4组密封处理,待造模时间解除密封,以模拟体内细胞缺血再灌注损伤状态。缺氧/复氧组再加入空白组兔血清(含PBS血清),肾衰康灌肠液各剂量组分别再加入其高、中、低剂量含药血清。以上各组血清的体积分数为 0. 1,孵育48 h,并分别于0、4、8、12、24和48 h检测相关指标。
1.4.3 观察指标与方法 细胞ROS检测:测定细胞在造模结束并加入相应血清后在加盖并胶带密封7 h后0、1、2、3、4、5、6、7 h细胞内ROS水平,以推测细胞缺氧复氧的造模时间。操作方法:稀释ROS原液,收集细胞加入一定量的ROS工作液。37 ℃培养箱孵育30 min后,于荧光显微镜下观察绿色荧光;吸弃ROS染液,PBS清洗2次,加入Hoechst33345染液(250X,蓝光),37 ℃培养箱孵育5~10 min,PBS清洗观察荧光。
细胞损伤/凋亡率检测:以CFSE/PI法、流式细胞分析联合Annexin V-FITC/PI法检测5组细胞造模后分别加入空白组、对照组、高剂量组、中剂量组、低剂量组5组血清后0、4、8、12 h的细胞凋亡/死亡情况。操作方法:收集细胞,细胞悬浮液准备,分别染色加入等体积CFSE、 FITC Annexin V和PI工作液,混合均匀于37 ℃孵育10 min,PBS清洗,于荧光显微镜下观察染色结果。
内质网应激相关指标基因检测:采用RT-qPCR法检测对照组、高剂量组、中剂量组、低剂量组4组血清造模后0、4、8、12 h时细胞内ERS标志分子GRP78、CHOP的mRNA。操作方法:将组织块剪成小块,加入定量的Trizol细胞裂解液,然后用超声细胞粉碎仪处理,细胞裂解液变浑浊即可。对于细胞:用PBS溶液将细胞清洗1次,每孔加入400 μL trizol细胞裂解液,吹打使细胞完全裂解;分离,沉淀为RNA,洗涤、溶解RNA,RNA转录为cDNA(引物序列:Actin:上游:5′-CATGTACGTTGCTATCCAGGC-3′,下游:5′-CTCCTTAATGTCACGCACGAT-3′,GRP78:上游:5′-CATCACGCCGTCCTATGTCG-3′,下游:5′-CGTCAAAGACCGTGTTCTCG-3′,CHOP:上游:5′-GGAAACAGAGTGGTCATTCCC-3′,下游:5′-CTGCTTGAGCCGTTCATTCTC-3′),37 ℃孵育40 min,终止反应,85 ℃孵育5 min,cDNA产物稀释20~50倍后使用,保存于-20 ℃,然后将PCR板置于RT-PCR仪上运行。
内质网应激相关指标蛋白检测:半定量western用于检测对照组、高剂量组、中剂量组、低剂量组4组血清造模后0、4、8、12 h时细胞内ERS标志分子GRP78、CHOP的蛋白表达情况。操作方法:收集蛋白样品配制凝胶,上样与电泳,按顺序加入5 μL maker,5-10 μL样品,5 μL loading buffer。加入电泳缓冲液,插好正负极,用90 V 跑完浓缩胶后,调节电压至130 V跑分离胶,待样品接近凝胶底端时关闭电压;转模封闭,将PVCF膜在甲醇中浸泡2 min,然后用转膜液清洗1次(1000 ml转膜工作液的配制:100 ml 10×的转膜液+200 ml 的乙醇 +700 ml的二次水), 4 ℃ 90 V跑1~1.5 h,BSA溶液37 ℃孵育0.5~1 h,不要清洗直接进行一抗孵育。一抗用PBS-T(含0.1%的Tween 20的PBS溶液)按1∶1000稀释,4 ℃过夜或室温孵育1.5 h。然后PBS-T清洗3次,每次5 min。二抗孵育,用PBS-T(含1‰的Tween-20)按1∶1000稀释,室温或37 ℃孵育1 h,然后PBS-T清洗3次,每次5 min,最后显影及定影。
1.5 统计学方法
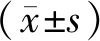
2 结果
2.1 细胞ROS检测
图1~3显示,正常组细胞内未观察到绿色荧光;随着缺氧时间的延长,3 h时模型组(缺氧处理)出现绿色荧光,5 h时模型组ROS绿色荧光信号明显增强(箭头提示处),细胞内活性氧达到最高值;5 h后细胞凋亡明显,无法进行后续实验,故细胞缺氧复氧时间点为密封5 h。
2.2 CFSE/PI染色实验
图4~8显示,造模0 h时的CFSE/PI染色结果表明,各组中红色亮点没有明显增加,即细胞死亡率未出现明显变化;4 h时各组细胞死亡率明显增加,表明细胞模型成功;而在含药血清处理造模细胞12 h时,药物组细胞死亡率明显低于对照组和PBS组,其中高剂量组最为明显,表明该药物的药效具有浓度依赖性;随着培养时间的延长,各组细胞死亡率逐渐回到正常水平,造模效果消失。
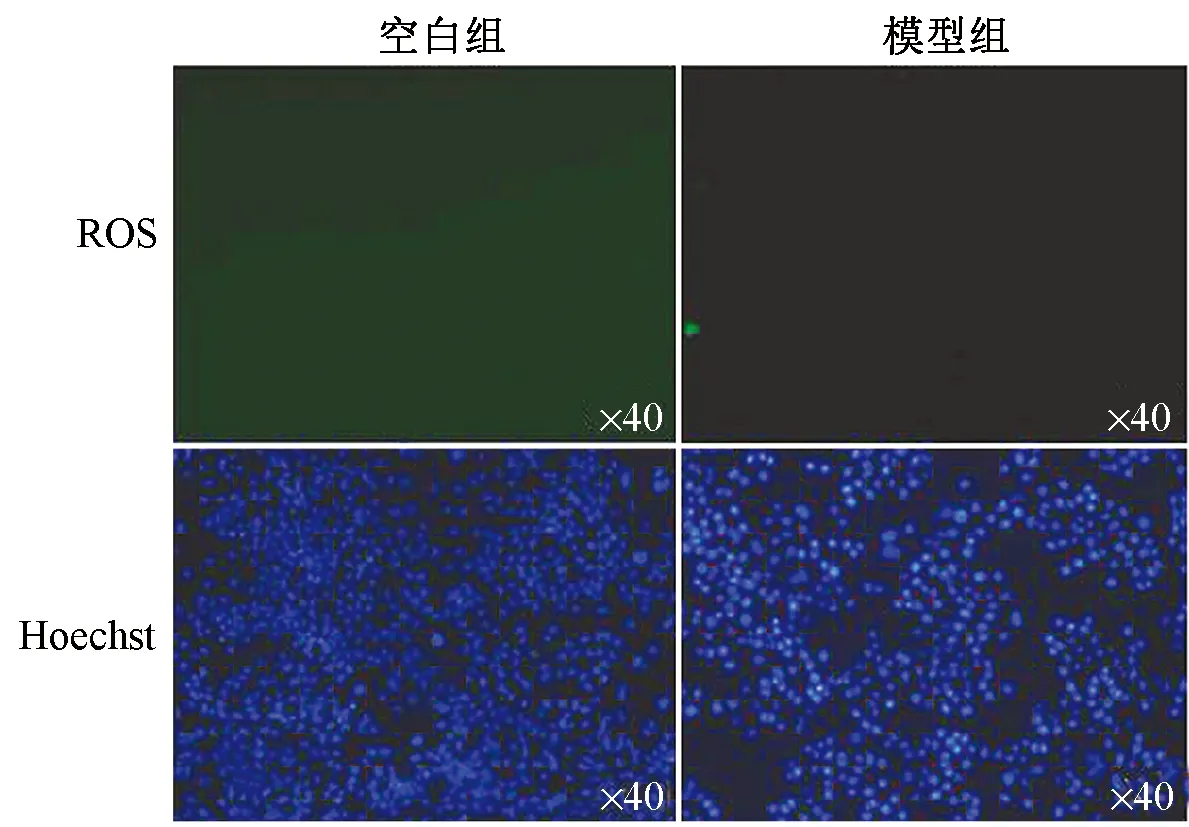
图1 造模0 h时ROS检测比较(×40)
图2 造模3 h时ROS检测比较(×40)

图3 造模5 h时ROS检测比较(×40)

图4 含药血清处理造模细胞0 h后CFSE/PI染色结果比较(×40)
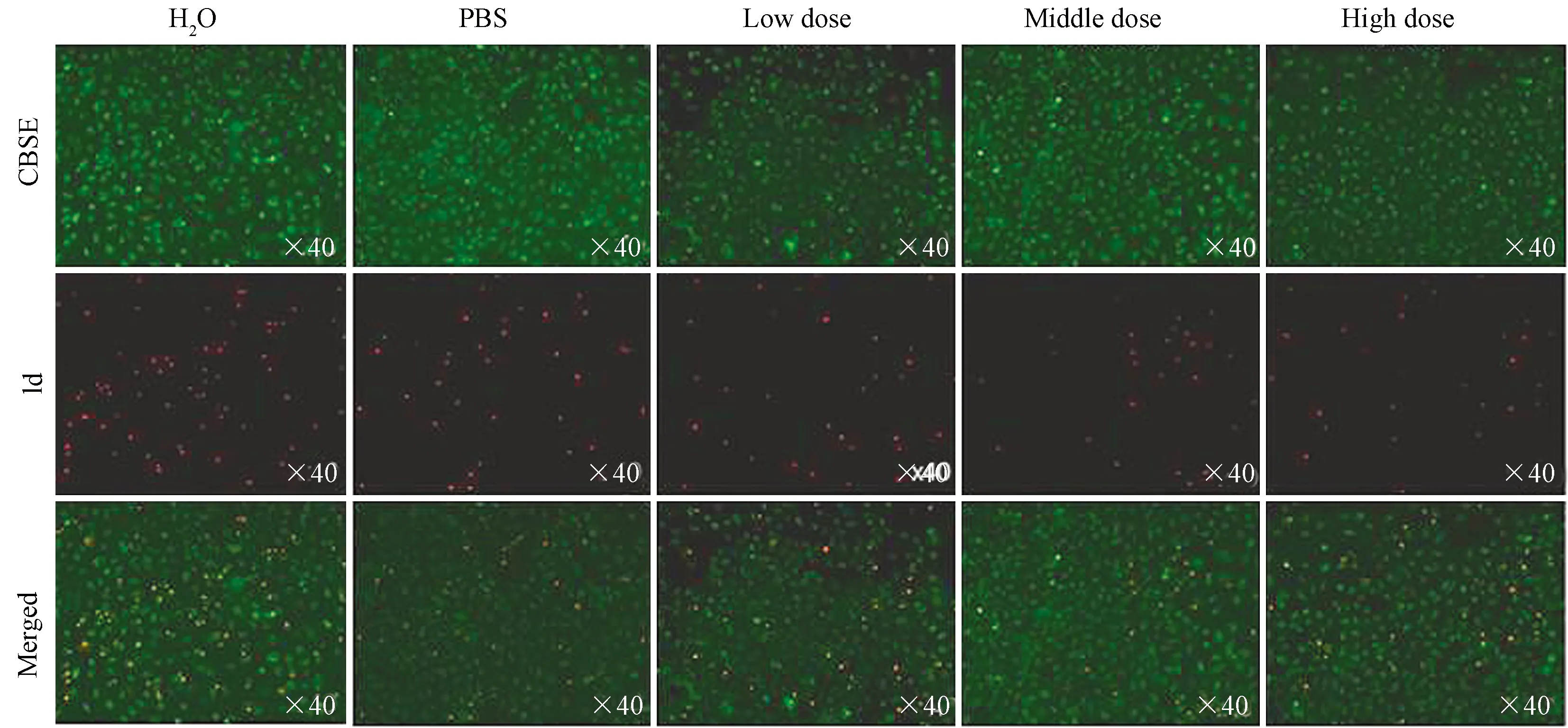
图5 含药血清处理造模细胞4 h后CFSE/PI染色结果比较(×40)
CFSE/PI染色结果表明,该含药血清对缺血再灌注引起的细胞凋亡/死亡有一定的抑制效果,高剂量组药效最佳。CFSE/PI染色法表明,本次实验HK-2细胞缺血再灌注损伤模型建立成功。随着造模后时间延长,细胞凋亡逐渐增加直到24 h,各组凋亡率与空白对照组相当,此时药物作用失效。我们推测肾衰康灌肠液抑制细胞凋亡与药物剂量有关。
2.3 流式细胞分析细胞凋亡情况
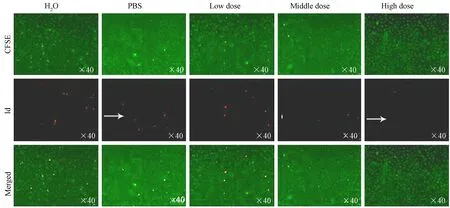
图6 含药血清处理造模细胞12 h后CFSE/PI染色结果比较(×40)

图7 含药血清处理造模细胞24 h后CFSE/PI染色结果比较(×40)

注:*P<0.05,**P<0.01图8 含药血清对各组处理细胞0~24 h、CFSE/PI染色的影响
图9、10显示,为进一步探索肾衰康灌肠液含药血清对缺氧/复氧损伤HK-2细胞的凋亡影响和量化相关指标,我们采用Annexin V-FITC/PI联合流式细胞术,定量分析各组细胞在造模后不同时间点细胞凋亡/死亡率。造模0 h时,各组细胞的凋亡/死亡率均未出现明显变化;从0 h开始到12 h,对照组和PBS组均能检测到大量的细胞凋亡/死亡率;而在24 h后,细胞凋亡/死亡明显恢复,造模效果丧失(48 h数据未展示)。在12 h,3个含药血清组均有明显的凋亡/死亡抑制效果。
上述结果显示,在HK-2细胞中含药血清对缺血再灌注引起的细胞凋亡/死亡具有明显的抑制效果,且这一效果可以持续到缺血再灌注损伤影响消失。
2.4 RT-PCR实验
图11、12显示,在检测基因及蛋白时,因正常组未缺氧/复氧造模检测无意义,故检测时未再检测正常组相关指标,对照组即可对照。含药血清处理模型细胞4 h后,GRP78、CHOP基因表达均下降发生明显变化;从4 h到12 h GRP78升高表达,逐渐恢复至正常水平。相对于PBS组,低、中、高剂量组对HK-2细胞中GRP78、CHOP的基因表达(P<0.05)差异有统计学意义。上述结果显示,含药血清抑制缺血再灌注损伤模型HK-2细胞凋亡与内质网应激有关。
2.5 WB实验
图13显示,GRP78和 CHOP蛋白表达在空白组及实验组,无论高、中、低剂量改变不明显,说明肾衰康灌肠液改变蛋白变化不明显,对抗内质网应激通路中GRP78、CHOP蛋白表达不明确。其中CHOP条带下出现非特异性条带,可能是蛋白降解后产生的小片段堆积在胶底导致,对最后结果无明显影响。

图9 流式细胞术检测Annexin V-FITC/PI细胞凋亡/死亡率
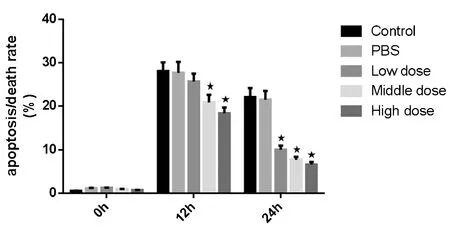
注:*P<0.05图10 不同时间点各组处理的细胞凋亡/死亡率比较

注:*P<0.05图11 相对于PBS组,低、中、高剂量组对HK-2细胞中GRP78的基因表达

注:*P<0.05图12 相对于PBS组,低、中、高剂量组对HK-2细胞中CHOP的基因表达

注:条带分子量β-actin:45 kDa;CHOP:27 kDa;GRP78:78 kDa图13 CHOP、GRP78蛋白表达比较
3 讨论
急性肾损伤(acute kidney injury,AKI)是常见的急危重症,其死亡率高[8],目前尚无有效的治疗药物,严重威胁患者的生命安全和生存质量。成都中医药大学研制的肾衰康灌肠液遵循中医“清热解毒”“活血化瘀”“益气利尿”治则,由大黄、黄芪、丹参、红花组成。方中大黄通下能使病邪有出路,使堆聚在人体的水分和废物能从肠道排出,有助于病人渡过少尿、无尿的危急阶段[9]。同时大黄改善代谢作用显著,现代中药药理研究学表明,大黄有利尿和改善肾功能的作用,可以减少肠道对氨基氮的吸收,利用氨合成蛋白质,抑制体蛋白分解,促进尿素和肌酐随尿液排出体外[10-12]。黄芪能扶正固本、利尿消肿,具有增强机体免疫、双向调节血压、降低蛋白尿、扩张外周血管及增强非特异性免疫作用[12]。其主要成分之一黄芪甲苷,能明显减少缺血再灌注时GRP78的表达,通过抑制ERS保护大鼠缺血/再灌注器官[13];红花、丹参具有活血化瘀的功效,可以扩张血管,解除微血管痉挛,特别是肾小动脉痉挛,防止血细胞聚集,改善微循环,使肾血流量恢复[14-15],抑制人肾成纤维细胞增殖并促进机体代谢,达到改善肾间质纤维化的作用[15]。本药临床治疗急性肾损伤有效率一直在80%以上[16]。
本实验因条件有限无三气培养箱,故采用检测ROS,以推测细胞在缺氧条件下的活性情况,同时证明造模成功。实验结果显示,肾衰康灌肠液对体外培养人肾小管上皮细胞株(HK-2细胞)缺血再灌注损伤后细胞凋亡/死亡有明显改善,验证了肾衰康灌肠液不仅临床治疗急性肾损伤有效,从细胞学角度证明对缺血性急性肾损伤也有治疗作用。
缺血性AKI是主要类型[1],其主要特征是肾小管上皮细胞的凋亡。研究表明[2-4],内质网应激引起促生存信号通路和促凋亡信号通路调控失衡,导致肾小管上皮细胞过度凋亡,是缺血性急性肾损伤发生发展的关键机制。
细胞在多种理化因素(缺氧、饥饿、钙离子平衡失调、化学毒物等)的刺激下,内质网腔内会出现蛋白质的错误折叠及未折叠蛋白质的聚集,这种内质网内在功能紊乱的状态称为内质网应激(endoplasmic reticulum stress, ERS)[17]。内质网为适应正在改变的环境或重新建立一个正常的ER功能,将逐渐形成一种称为未折叠蛋白反应(unfolded protein response, UPR)的信号通路[18]。UPR由3种ER感应蛋白介导,分别是PERK、ATF6和IRE-l,在未发生应激时都以无活性状态与内质网分子伴侣GRP78结合。错误折叠或未折叠蛋白的积聚使GRP78从3种感应蛋白上解离,转而去结合错误折叠或未折叠蛋白。解离后的感应蛋白被活化并启动UPR,包括早期蛋白质合成的广泛抑制、内质网分子伴侣和折叠酶的转录激活等一系列反应,从而降低错误折叠或未折叠蛋白在内质网内的积累,恢复内质网的正常功能,是一个促生存信号途径,故GRP78表达的上调是ERS的标志,在应激条件下对细胞起保护作用[19]。
PERK、ATF6以及IRE-l信号不仅能够启动ERS的生存途径,当过强或时间过长的ERS导致ER功能受损时,这3条信号通路同样能够启动由ERS所介导的凋亡信号通路,诱导细胞凋亡,去除受损伤的细胞。ERS引起的细胞凋亡有一套自身的信号传递通路,称之为内质网相关性死亡(ER-ssociated death,ERAD)途径[20]。目前发现,ERAD相关途径有3条,即内质网源性转录因子(CHOP)、天冬氨酸特异性半肌氨酸蛋白-12(Caspase-12)和c-Ju氨基末端激酶(JNK)[21-23]。故临床研究内质网应激通过CHOP、Caspase-12、JNK 3条通路研究。其中CHOP在真核动物的组织细胞中广泛存在,其编码蛋白与多种细胞功能活动(如增殖、分化、凋亡)密切相关。据研究报道,CHOP基因可通过抑制Bcl-2(凋亡负调节蛋白)诱导细胞发生凋亡,也可通过与促凋亡死亡受体5(DR5)基因5'翼状区结合而增加后者蛋白的表达,而后者是激活caspase家族的重要分子[24-25]。在CHOP基因过表达以及运用CHOP敲除小鼠的实验研究中发现,CHOP蛋白在内质网应激中可诱导细胞周期阻滞及凋亡[26-27]。正常情况下,CHOP几乎不表达,内质网应激时可通过IRE-1、 PERK和ATF6的活化促进CHOP的大量表达,最终引起细胞凋亡。
最后实验结果可见,该实验模型存在内质网应激反应的激活,且内质网应激相关通路参与引起细胞凋亡(GRP78,CHOP基因表达在不同组别有明显不同),肾衰康灌肠液可减少HK-2细胞凋亡率,减轻肾缺血再灌注损伤。但是检测对照组及实验组内质网应激通路中的GRP78、CHOP蛋白表达无明显变化,推测肾衰康灌肠液减轻肾缺血再灌注损伤的机制可能不是通过内质网应激通路中的GRP78、CHOP起作用,可能检测蛋白应考虑从IRE-1、 PERK和ATF6检测,或肾衰康灌肠液治疗是通过内质网应激中其他信号通路起作用的,有待进一步深入研究。
综上所述,本实验证明中药肾衰康灌肠液确实有抗内质网应激治疗HK-2细胞缺氧/复氧损伤的作用。该中药不仅临床有效,且验证了中药复方在细胞层面治疗急性肾损伤的有效性,为急性肾损伤的中医治疗提供了新的理论依据。
