干旱胁迫下过表达TaER小麦的转录组及光合特性分析
2019-08-22李慧娟郑甲成胡银岗
李慧娟,杨 阳,常 平,郑甲成,陈 亮,胡银岗
(西北农林科技大学农学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
小麦(TriticumaestivumL.)是仅次于水稻的世界第二大粮食作物,种植面积最大、分布最广。在我国,由于小麦主栽区气候特征的影响,小麦灌浆期降水量严重不足,最终导致大幅减产,因此抗旱性成为小麦育种的重要指标,而提高蒸腾效率是抗旱性改良的关键。
ERECTA(ER)是调控植物蒸腾效率的1个编码类受体蛋白激酶的基因,通过与大分子物质的相互作用来调节植物的生长发育,并且在植物抵御病菌侵染、干旱、高温等生物和非生物胁迫中也发挥重要作用[1]。Xing等[2]在拟南芥中过表达杨树的ER基因,发现转基因植株生物量、光合速率和长期水分利用效率都有显著提高。Villagarcia等[1]发现在番茄中过表达缺失激酶催化结构域的拟南芥ER基因,对生长造成负面效应的同时降低了对水分亏缺的抗性。针对禾本科作物的研究表明,过表达ER基因的转基因玉米、高粱和水稻也表现出相似的特性[3-4]。此外,Shen等[5]研究发现,拟南芥ER基因对植物的耐热性也有很强的效应。尽管对拟南芥、水稻中ER基因的效应有了比较深入详细的研究,但是目前小麦TaER基因的功能研究尚处于起步阶段,且其转化相关研究还未见报道。
转录组测序技术是近年来兴起的一种针对整个转录网络进行定量分析的测序技术,通过对不同样品所有mRNA的高通量测序,既能够分析不同样品在特定生长发育时期所有基因的表达量,也可以分析相同组织在不同条件下的基因表达差异[6-7],已被广泛应用于植物应对逆境响应等研究。生物或非生物胁迫下,植物为了抵御逆境所造成的伤害,在基因的表达水平、分子代谢及生物代谢途径方面都会发生极显著的变化[8]。植物首先接收并识别由于环境变化而产生的信号,其次,在多种激酶及激素类物质的作用下对信号进行传导,并通过调节相关基因的表达、转录后加工及翻译水平来对逆境进行及时的响应,从而减少逆境对植物生长发育所带来的伤害[9]。因此,转录水平上的改变是植物对环境响应的第一步,通过对逆境下基因表达网络和富集通路的深入分析有助于挖掘与逆境相关的重要基因及代谢途径,从而进一步揭示植物响应胁迫的调控机制。
小麦TaER对抗旱性的效应及作用机制尚不明确,本研究以本实验室前期构建的过表达TaER基因的小麦T3代转基因株系及其野生型为材料,利用转录组测序技术,比较分析转基因株系与野生型在干旱胁迫下的基因表达差异,通过功能富集,深入分析过表达TaER株系在干旱胁迫下所引起的基因表达调控网络,并测定其光合、蒸腾参数,初步阐明TaER基因在干旱胁迫下的应答机制,以期为小麦ER基因的功能研究奠定基础,促进小麦TaER基因应用于小麦的抗旱性改良。
1 材料与方法
1.1 试验材料与处理
以T3代转基因小麦株系[以小麦栽培品种Cadenza为受体,将位于小麦7BS上的TaER基因(NCBI数据库中的编号为JQ599261.2)的cDNA序列连接玉米组成型ubiqutin启动子构建表达载体,经基因枪遗传转化获得]通过目的基因检测及表达水平分析获得的高表达株系L1、L2及其野生型栽培品种Cadenza为材料。
试验于2016-2017年间在西北农林科技大学旱区农业节水研究院抗旱棚内(34°7′ N,108°4′ E)进行。根据完全随机区组设计充分灌溉(well-watered,WW)和干旱胁迫(water-stressed,WS)两种水分处理,每个处理设4次重复。
播种前充分灌溉,越冬、返青、拔节期,WW和WS处理依赖自然降水,期间的降水量为 184.2 mm。拔节后,抗旱棚平时开启,雨天关闭,WS处理停止灌溉,WW处理分别在抽穗和灌浆初期各灌水20 mm。在灌浆中期分别取正常灌水与干旱胁迫下各株系的12个单株的旗叶样品,其中4个单株旗叶样品直接液氮速冻,-80 ℃超低温冰箱保存用于DNA提取,其余8个单株的旗叶等量混样速冻后用于转录组测序总RNA的提取。
1.2 TaER转基因T3代阳性株系的鉴定
CTAB法提取各株系基因组DNA,在目的基因和载体区域分别设计正、反向引物对T3代转基因株系的外源基因进行检测,目的片段大小为354 bp,4个生物学重复。引物序列见表1。由上海生工生物工程有限公司合成。PCR反应体系为10 μL:5.0 μL的2×taqPCR Star Mix,正、反向引物(10 μM)各0.5 μL,0.5 μL的模板DNA(100 ng·μL-1),ddH2O 3.5 μL。反应程序为:94 ℃预变性2 min,94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸20 s,35个循环,最后72 ℃延伸 5 min。PCR产物使用1%的琼脂糖凝胶电泳进行检测,最终确定T3代转基因阳性株系。
1.3 TaER转基因株系的表达量分析
利用qRT-PCR检测目的基因TaER的表达水平,使用Trizol法提取三叶期T3代转基因阳性单株第一叶的总RNA并进行反转录。反应总体积为20 μL,具体各组分参照SuperReal PreMix Color (SYBR Green) Kit荧光定量试剂盒说明书配置。反应程序如下:95 ℃预变性 15 min,95 ℃变性10 s,60 ℃退火30 s,设置40个循环,引物序列见表1。以TaActin为内参基因,用2-△△Ct法计算相对表达量,每个样品3次重复。

表1 PCR及qRT-PCR引物序列Table 1 Primer sequences for PCR and qRT-PCRW
1.4 转录组测序及表达量计算
用Trizol法提取总RNA,使用e-spect蛋白核酸分析仪对RNA质量进行检测,检测合格的样品送至北京诺禾致源科技股份有限公司进行后续建库及测序。将测序获得的序列去除接头序列及低质量reads之后,将clean data比对到水稻参考基因组上,使用HTseq进行表达量的计算。
1.5 差异表达基因的筛选及富集分析
用FPKM值统计基因的表达水平[10],用基于平均值的高斯分布和基于统计量的经验分布通过DEGseq[11]软件进行差异基因的筛选,阈值为FDR≤0.01和│log2(fold change)│≥1,分别对充分灌水和干旱胁迫处理下的野生型与过表达株系的差异表达基因(DEGs)进行分析。
以q value <0.05为阈值,分别利用KOBAS3.0和GOseq[12]对差异基因进行GO(Gene Ontology)功能和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析。
1.6 转录组数据的qRT-PCR验证
为了验证转录组数据的可靠性,以各处理叶片cDNA为样品,选择6个在不同水分处理下的差异表达的基因(表1),用qRT-PCR分析其表达量,3个重复,具体反应及程序参照1.3。
1.7 光合相关指标的测定
用LI-6400便携式光合仪(Li-Cor,Lincoln/NE,USA)测定灌浆期各株系的光合、蒸腾参数,同时参考Martin等的方法[13]测定并计算瞬时水分利用效率。用Excel进行数据的统计与整理,SPSS16.0进行方差分析与多重比较。
2 结果与分析
2.1 目的基因检测及表达量分析
对T3代转基因株系基因组DNA进行多次重复PCR检测。结果显示,转基因阳性植株可以扩增出354 bp的特异片段,而非阳性植株和野生型则未扩增出目的条带;15个株系中,有9个株系为阳性株系(图1),阳性率为60%,表明部分T3代转基因株系尚有分离。野生型标记为WT,T3代转基因株系标记为L。
对获得的阳性转基因株系目的基因的表达量进行定量分析。结果表明,所有阳性转基因株系中外源TaER基因的表达量都不同程度的上调(图2),其中株系L1和L2上调幅度较高,因此以L1和L2株系为材料,进行转录组测序,进一步分析干旱胁迫下过表达TaER的转基因株系与野生型在基因表达及调控网络中的差异。

M:DNA Maker DL2000; 1~16分别为L1、WT、L2、L3、L4、L5、L6、L7、L8、L9、L10、L11、L12、L13、L14和L15。
M:DNA Maker DL2000; 1~16 represent L1,WT,L2,L3,L4,L5,L6,L7,L8,L9,L10,L11,L12,L13,L14 and L15,respectively.
图1 转基因植株TaER基因的PCR检测结果
Fig.1 PCR analysis of transgenic plants forTaERgene
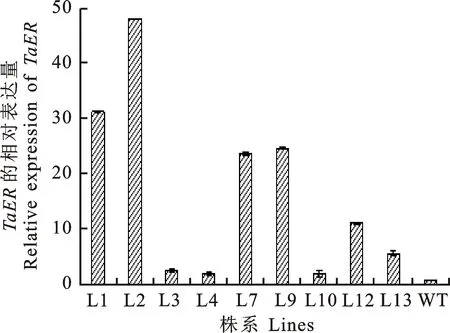
图2 T3转基因株系TaER基因的qRT-PCR检测结果Fig.2 QRT-PCR analysis of TaER gene for T3 transgenic lines
2.2 测序数据的统计及比对情况评估
对2个水分处理下的野生型、L1和L2株系共6个混合样品进行测序,经过原始数据过滤、质控之后,野生型(WT_WW、WT_WS)、转基因株系L1(L1_WW、L1_WS)和转基因株系L2(L2_WW、L2_WS)分别获得76 217 622、61 641 432、61 915 306、74 464 998、79 375 080和61 391 468条clean reads,样品平均GC含量60.44%,Q20比例为94.21%,Q30比例为86.62%,表明测序数据质量良好,可进行下游分析。
将clean reads比对到水稻参考基因组上,结果(表2)显示,6个样品在基因组上都有比较高的比对率,平均比对率为87.76%,最低为87.08%,最高为89.73%。考虑到六倍体小麦遗传背景的复杂性,超过87%的比对结果表明测序结果可靠,可以很好的满足后期的分析需求。
2.3 差异表达基因分析
以FDR≤0.01和│log2(fold change)│≥1作为阈值,野生型为对照组,进行差异表达基因筛选,结果如表3所示,同时通过韦恩图分析四组差异表达基因(图3)。结果表明,充分灌溉下,有1 439个基因在2个转基因株系和野生型之间均差异表达,其中470个上调表达,969个下调表达;干旱胁迫下,有607个基因表现出共同的差异表达,其中352个上调表达,255个下调表达。
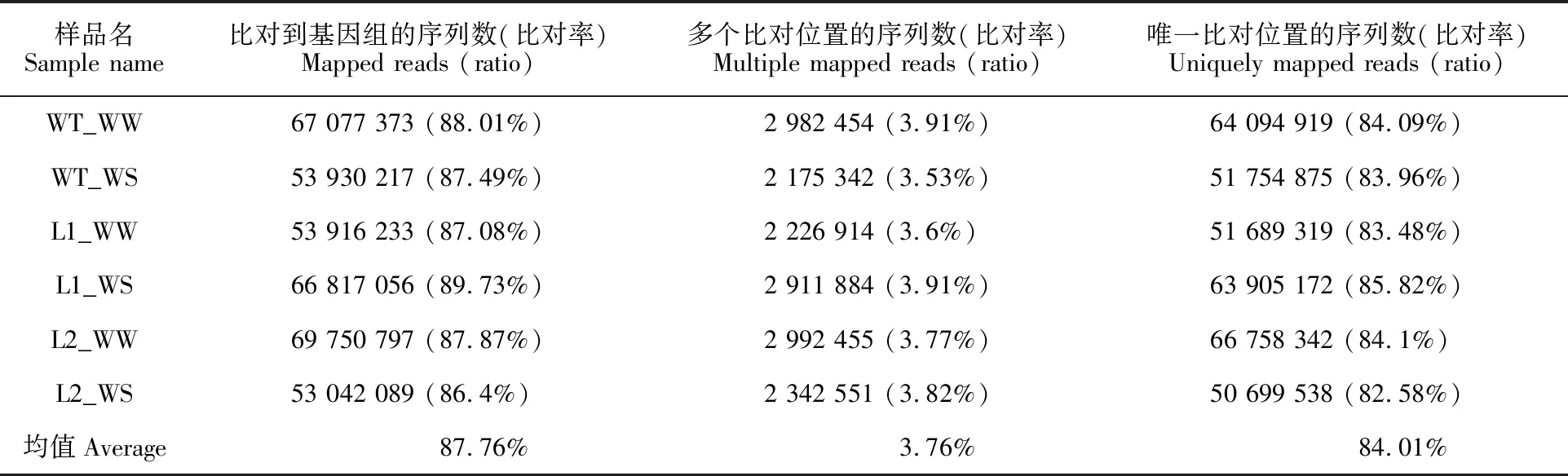
表2 测序数据与参考基因组比对结果统计Table 2 Statistics of sequencing data mapped in reference genome

表3 过表达株系与野生型的差异表达基因数Table 3 Statistics of DEGs between over-expression lines and wild type

图3 差异表达基因的韦恩图Fig.3 Veen plots of DEGs
2.4 qRT-PCR验证
为了验证转录组表达数据的可靠性,选择6个在干旱处理下野生型与转基因株系显著差异表达的基因,用qRT-PCR进行验证。结果(图4、图5)表明,除了TRIAE_CS42_7DS_TGACv1_622753_AA2044770与转录组表达量数据有细微的差别外,其余基因都表现出与转录组数据一致的表达情况,表明转录组数据是客观可靠的。
2.5 差异表达基因的GO和KEGG富集分析
2.5.1 差异表达基因的GO富集分析
对正常灌水处理下的1 439个DEGs进行GO功能分析,差异基因富集到分子功能、细胞组分和生物学过程3个类别的40个GO功能分类。其中,参与生物学过程的基因最多,其次为分子功能,较少的是细胞组分,分别占总数的58.65%、 28.05%和13.29%。富集差异基因数较多的20个GO功能(表4)中,细胞组分中类囊体和类囊体组的DEGs最多,均有28个,其次是光系统(24个)和光合膜(24个);分子功能中DEGs富集最多的是催化活性(502个)、水解酶活性(211个)和氧化还原酶活性(140个);生物学过程中代谢过程(548个)、光合作用(27个)的DEGs数量最多。
对干旱胁迫处理下的607个DEGs进行注释,经分析,DEGs富集到GO数据库的生物学过程和分子功能2个类别,共有30个功能分类。其中,参与到生物学过程的DEGs占9.70%,参与到分子功能的占71.66%。富集差异基因数较多的20个GO功能(表5)中,生物学过程的DEGs较多富集在脂质代谢(34个)和膜脂代谢(12个)过程;分子功能中主要是与催化活性(260个)和水解酶活性(139个)相关的基因。

1~6:TRIAE_CS42_7DS_TGACv1_622753_AA2044770,TRIAE_CS42_7AS_TGACv1_569613_AA1820410,TRIAE_CS42_5BL_TGACv1_409850_AA1366530,TRIAE_CS42_4AL_TGACv1_288169_AA0939290,TRIAE_CS42_5BL_TGACv1_406947_AA1351690,and TRIAE_CS42_2BS_TGACv1_145841_AA0446640
图4野生型和L1株系在干旱处理下差异基因的表达量FPKM值
Fig.4FPKM values of DEGs between wild lineand L1 line under drought stress

1~6:TRIAE_CS42_7DS_TGACv1_622753_AA2044770,TRIAE_CS42_7AS_TGACv1_569613_AA1820410,TRIAE_CS42_5BL_TGACv1_409850_AA1366530,TRIAE_CS42_4AL_TGACv1_288169_AA0939290,TRIAE_CS42_5BL_TGACv1_406947_AA1351690,and TRIAE_CS42_2BS_TGACv1_145841_AA0446640
图5野生型和L1株系在干旱处理下差异基因的相对表达量
Fig.5Relative expression of DEGs between wildline and L1 line under drought stress

表4 正常灌水处理下野生型和过表达株系的差异表达基因GO注释Table 4 GO annotation of DEGs under normal irrigation for wild type and over-expression lines
B、C、M分别为生物学过程、细胞组分、分子功能。表5同。
B:Biological process; C:Cellular component; M:Molecular function. The same in table 5.
2.5.2 差异表达基因的KEGG富集分析
结合KEGG数据库,分析表明,正常灌水与干旱胁迫下,DEGs均显著富集到8条途径(表6)。干旱胁迫下,甘油磷脂、亚油酸、甘油脂和α-亚麻酸代谢途径显著富集,而光合作用-捕光蛋白及所涉及的3个氨基酸代谢途径不再富集。
2.6 过表达株系和野生型的光合相关指标
在小麦灌浆期,测定正常灌水与干旱胁迫处理下过表达株系和野生型旗叶的净光合速率与蒸腾速率(表7)。结果表明,正常灌水处理下,TaER过表达株系L1和L2的净光合速率均显著高于野生型,平均提高18.58%;蒸腾速率平均提高了21.24%;瞬时水分利用效率平均提高了19.94%。干旱胁迫处理后3个株系的净光合速率与蒸腾速率均降低,但是过表达株系L1和L2的净光合速率仍显著高于野生型;蒸腾速率平均较野生型降低了8.83%;而瞬时水分利用效率平均为野生型的1.9倍。

表5 干旱胁迫处理下野生型与过表达株系差异表达基因的GO注释Table 5 GO annotation of DEGs under drought stress for wild type and over-expression lines

表6 野生型与过表达株系差异表达基因的KEGG富集分析Table 6 KEGG enrichment analysis of the DEGs between wild type and over-expression lines
-:无富集的差异表达基因。
-:Non-enriched differentially expressed genes.

表7 灌浆期光合和蒸腾性状分析Table 7 Analysis of photosynthesis and transpiration traits at grain-filling stage
*和**分别表示转基因株系和野生型在0.05和0.01水平上差异显著。
* and ** indicate significant differences between transgenic lines and wild type at 0.05 and 0.01 levels,respectively.
3 讨 论
近年来,转录组水平的测序技术在很大程度上促进了生物基因功能方面的研究。如今,RNA-seq也广泛应用于植物应对逆境的响应。本研究通过对正常灌溉和干旱胁迫的2个T3代转基因株系及其野生型旗叶进行RNA-seq测序,筛选出在2个转基因株系与野生型之间正常灌水下的1 439个共同的差异表达基因,干旱胁迫下607个共同的差异表达基因。这表明某些基因参与小麦抗旱性的调控。而在正常灌溉条件下,L1和L2株系与野生型差异表达基因数目有较大的差异(L1为4 077个,而L2为2 769个),这可能是由于在基因转化过程中插入位点、拷贝数的不同以及在基因重组互换过程中产生的差异而影响了其他基因表达的变化。目前对于小麦转录组学研究处于起步阶段,基因功能注释信息不够完善,部分序列或基因无法获得功能注释信息,而水稻功能信息则比较完善,因此将水稻基因组作为参考进行比对。
正常灌水下DEGs的GO功能主要富集到光合作用、催化活性、水解酶活性和氧化还原酶活性、类囊体、类囊体组分,干旱胁迫下的DEGs富集到的主要是脂质、膜脂代谢基因、催化活性和水解酶活性。表明光合作用、脂质和膜脂代谢基因在干旱胁迫下显著富集,暗示这些基因可能在TaER过表达株系在适应干旱方面发挥着重要 作用。
本研究KEGG分析表明,干旱胁迫下,DEGs富集到半乳糖代谢、淀粉和蔗糖代谢、甘油(磷)脂代谢、亚油酸代谢、光合作用-捕光蛋白和α-亚麻酸代谢,与前人在禾本科早熟禾属的结果基本一致[14]。干旱胁迫后的差异基因主要参与了脂类代谢和光合作用,且甘油酯途径中的糖基转移酶差异基因上调表达,拟南芥糖基转移酶UGT75X被盐胁迫、干旱胁迫诱导表达,通过糖基化脱落酸、油菜素内酯、赤霉素、细胞分裂素和其他小分子物质提高植物抗旱性[15]。表明这些基因可能通过植物激素调节对干旱的适应。亚油酸和α-亚麻酸代谢中的脂氧合酶(LOX)基因下调表达。其参与生成脱落酸、茉莉酸等抗性信号分子响应干旱胁迫,也可以催化亚麻酸氢过氧化而抑制光合电子的传递[16]。因此,这些基因可能通过植物激素、光合作用正调控干旱胁迫。光合作用-捕光蛋白途径中Lhca1、Lhcb(1、3、4和6)差异表达基因在充分灌溉下均下调表达,而干旱胁迫后该途径则无差异表达基因的富集,这些基因参与光吸收和光信号转导,是光系统的组成部分[17]。在拟南芥光合作用调控中,ERECTA通过影响羧化酶最大羧化速率和电子传递能力来影响其光合能力[18],推测这些基因可能通过调控光电子传递途径,从而适应水分逆境。
植株的净光合速率可以作为评价其抗旱性强弱的生理指标之一,抗旱性强的品种,能够维持较高水平的光合特性[19]。分析田间光合、蒸腾参数,结果表明TaER过表达提高了转基因小麦株系的光合作用,这与拟南芥中ERECTA过表达提高净光合速率的结果一致[18],且在干旱胁迫下维持较高的净光合速率与瞬时水分利用效率,降低蒸腾速率。因此,干旱胁迫下,TaER过表达株系可能通过调控光合作用和脂类代谢等途径提高净光合速率,为TaER调控蒸腾效率和响应干旱胁迫提供了理论基础。
