化学杂交剂 SQ-1 对麦长管蚜生命表重要参数及酶活的影响
2019-08-22蒋韫博周雨馨张改生马守才王军卫赵惠燕2宋瑜龙
蒋韫博,郭 燕,周雨馨,张改生,2,马守才, 王军卫,牛 娜,赵惠燕2,,宋瑜龙,2
(1.西北农林科技大学农学院/国家杨凌农业生物技术育种中心/国家小麦改良中心杨凌分中心/小麦育种教育部工程研究中心/ 陕西省作物杂种优势研究与利用重点实验室,陕西杨凌 712100;2.旱区作物逆境生物学国家重点实验室, 陕西杨凌 712100;3.西北农林科技大学植物保护学院,陕西杨凌 712100)
小麦是世界三大主要粮食作物之一,是人类赖以生存的重要食物来源。2015 年我国小麦实际播种面积在 2 400.0万hm2以上,约占粮食作物总面积比重的 21.30%,是仅次于玉米、水稻的第三大粮食作物[1]。近年来,我国的小麦内需超出了自身的产能,以致于不得不大量进口国外小麦以满足国内需求。2007-2016 年间,我国小麦消费总量以年均 0.2% 的增长率整体平稳低速增长,于 2016 年达到 1.16 亿 t,约占世界消费量的 1/5;小麦进口量则在 2013 年达到最高为 609 万 t,约占世界当年小麦进口总量的 3.2%[2]。随着国内经济的高速发展,大量耕地用途被改变,导致农田总面积减少[3]。为确保小麦生产满足逐年稳步增长的消费需求,减少对进口小麦的依赖,最安全途径就是提高单产。
目前,美国是杂种小麦种植面积最大的国家,杂种小麦面积占小麦种植总面积的 1%;英国、阿根廷、印度、法国和澳大利亚等国也积极推动杂交小麦育种工作,年均累计推广面积约 20 万~30 万 hm2[4]。小麦杂种优势利用被认为是今后小麦单产水平大幅度提高的有效途径之一[5],而小麦杂种优势利用的关键是获得优良的雄性不育系。现阶段,小麦雄性不育系主要包括三大类:一是遗传型不育系;二是光温敏雄性不育系;三是化学杂交剂诱导的生理型雄性不育系[6]。基于上述三类雄性不育系,目前已形成了两种不同的小麦杂种优势利用途径,分别是“三系法途径”和“二系法途径”。因恢复系缺乏有效的育性恢复基因和杂交种干瘪等因素严重限制了“三系法途径”小麦杂种优势在生产中的应用[7-8]。另外,“二系法途径”中光温敏雄性不育系受环境因素影响较大,育性稳定性较差[9-10],在一定程度上限制了光温敏二系杂交小麦的制种和大面积应用。化杀二系法既克服了现有遗传型雄性不育系(核质互作雄性不育系和光温敏雄性不育系)对不育基因和环境条件的依赖,又扩大了杂种优势亲本的选配范围,加快了杂交种选育进程,还简化了不育基因转育的繁琐程序[11-12]。因此,化杀二系法小麦杂种优势利用被认为是众多杂种优势利用途径中最具应用前景的类型之一。
小麦化学杂交剂 SQ-1 是我国具有自主知识产权、兼具高效、稳定和广谱等特征的小麦化学杂交剂,其诱导小麦产生雄性不育率可达到 95%~100%,饱和授粉结实率达 85% 以上,具有巨大的产业化应用潜力[13-15]。近年来,关于化学杂交剂 SQ-1 的研究多集中在不育机理研究[16-19]和杀雄嗪酸残留[14,20]等方面,对其生态安全性评价一直未有深入研究,已逐渐成为限制 SQ-1 大面积应用的瓶颈,同时也是化控二系杂交小麦强优势杂交组合创制与大面积推广的重要限制因素。因此,本研究以 5 kg·hm-2的 SQ-1 处理过的小麦和对照小麦(等量清水处理)作为食材分别饲喂麦长管蚜,通过分析蚜虫生命表重要参数变化及其体内SOD、POD、CAT 和AchE的活性变化,分别从昆虫生态学、昆虫生理学和昆虫毒理学层面解析 SQ-1 的生态安全性,为 SQ-1 的应用提供理论依据。
1 材料与方法
1.1 试验材料
供试虫源麦长管蚜来自西北农林科技大学植物保护学院赵惠燕教授实验室;供试小麦材料西农 1376 和化学杂交剂 SQ-1 均由西北农林科技大学张改生教授实验室提供;酶活性测定所需试剂及试剂盒均购自南京建成生物工程研究所。
1.2 生命表研究
挑选颗粒饱满、大小基本一致的西农 1376种子种植于盛有相同基质的穴盘中,置于恒温 20 ℃、光照正常的温室中培养。待小麦发育至四叶期,将第 1 代麦长管蚜接于正常小麦植株上进行饲养,待产仔后将同龄第 2 代麦长管蚜分成两组:一组接于苗期均匀喷施过 5 kg·hm-2化学杂交剂 SQ-1 的小麦植株(30株)上,作为处理组;另一组接于苗期均匀喷施过等量清水的小麦植株(30株)上,作为对照组。每株小麦上仅接一头麦长管蚜,其中每 10 头作为 1 个重复,共 3 个重复。自接种第二天开始,每日上午 8:00-10:00观察、记录麦长管蚜的蜕皮、生长及产仔情况,直至第 2 代蚜虫全部死亡。与此同时,逐个收集第 2 代麦长管蚜成虫,液氮冷冻后于 -80 ℃保存,供酶活性测定。分别做好处理组和对照组蚜虫的续代工作,连续饲喂直至第 11 代,并以相同的方法记录第 6 代和第 11 代麦长管蚜的生命表数据和收集成虫。
1.3 总酶液制备
分别称取第2、第6、第11 代处理组和对照组麦长管蚜成虫 0.02 g,加入 0.18 mL 预冷的生理盐水,于冰浴中机械匀浆;将匀浆液全部转入离心管,2 500 r·min-14 ℃离心 10 min,取上清液作为待测酶液。 3次重复。
1.4 保护酶及解毒酶活性测定
1.4.1 总蛋白浓度测定
总蛋白浓度测定参照总蛋白定量测定试剂盒说明书(A045-3)并有所改动。将表1体系涡旋混匀, 37 ℃孵育 30 min。双蒸馏水调零酶标仪,在 562 nm 波长、0.5 cm 光径下测定各管 OD 值(光密度)。重复3次。按下列公式计算总蛋白浓度( μg·mL-1):

表1 总蛋白浓度测定操作表Table 1 Measurement of total protein concentration μL
总蛋白浓度=(样本OD值-空白OD值)/(标准OD值-空白OD值)×标准品浓度×样本稀释倍数
1.4.2 超氧化物歧化酶(SOD)活性测定
SOD活性测定参照SOD测定试剂盒说明书(A001-3)并做少量修改。将表 2体系涡旋混匀,于 37 ℃孵育 20 min,用酶标仪在 450 nm 波长下测定各管 OD 值(光密度)。重复3次。按下列公式计算 SOD 活性(U·g-1):
SOD抑制率=[(对照OD值-对照空白OD值)-(样本OD值-样本空白OD值)]/(对照OD值-对照空白OD值)×100%
SOD活性=SOD抑制率÷50%×样本稀释倍数÷样本蛋白浓度
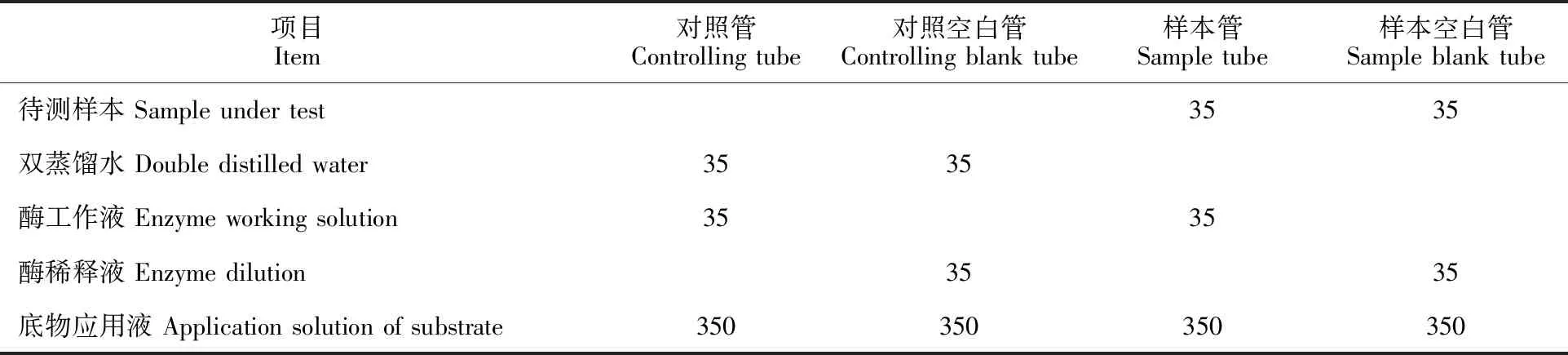
表2 SOD活性测定体系Table 2 Mixture for determining SOD activity μL
1.4.3 过氧化物酶(POD)活性测定
POD活性测定参照POD测定试剂盒说明书(A084-1)并有所改动。将表 3 中配制的各体系涡旋混匀,3 500 r·min-1离心 10 min,取上清液。双蒸馏水调零酶标仪,在 420 nm 波长、1 cm 光径下测定各管 OD 值(光密度)。重复3次。并用下列公式计算 POD 活性(U·mg-1):
POD活性=(样本OD值-空白OD值)/(12×比色光径)×反应液总体积/样本量÷反应时间÷样本蛋白浓度×1 000
1.4.4 过氧化氢酶(CAT)活性测定
CAT活性测定参照CAT测定试剂盒说明书(A007-1)并稍作改动。将表 4 中配制的各体系涡旋混匀,用双蒸馏水调零酶标仪,在 405 nm 波长、0.5cm 光径下测定各管 OD 值。重复3次。并用下列公式计算 CAT 活性(U·mg-1):
CAT活性=(对照OD值-样本OD值)×235.65×(1/60×取样量)÷样本蛋白浓度
1.4.5 乙酰胆碱酯酶(AchE)活测定
AchE活性测定参照AchE测定试剂盒说明书(A024)并有所修改。将表 5 中配制的各体系涡旋混匀,静置 15 min。双蒸馏水调零酶标仪,在412 nm 波长、0.5 cm 光径下测定各管OD值。并用下列公式计算 AchE 活性 (U·mg-1):

表3 POD 活性测定体系Table 3 Mixture for determining POD activity mL
AchE活性=(样本OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度×样本蛋白浓度

表4 CAT 活性测定体系配制Table 4 Mixture for determining CAT activity mL
1.5 数据处理及分析
生命表数据录入 TWOSEX—MSChart[21]软件,用 Bootstrap 方法[22]计算麦长管蚜各种群参数和繁殖参数。随后对获得的生命表参数如:内禀增长率rm、周限增长率λ、净增值率R0、平均世代周期T、产仔前总时间 TPOP、产仔天数和寿命等数据运用 Paired bootstrap test(成对自助检验)[22]进行差异显著性检验,同时对处理组和对照组不同世代蚜虫体内各保护酶及解毒酶活性进行单因素方差分析(One-way ANOVA),并采用 Duncan 多重比较检验法对数据进行差异显著性比较。最后,利用双变量相关分析对各个酶之间的相关性进行分析,相关系数选择 Spearman。成对自助检验使用 TWOSEX—MSChart,方差分析和相关性分析均使用SPSS Statistics 20。

表5 AchE 活性测定体系Table 5 Mixture for determining AchE activity μL
2 结果与分析
2.1 SQ-1 对麦长管蚜生命表重要参数的影响
2.1.1 SQ-1 对麦长管蚜种群参数的影响
麦长管蚜取食化学杂交剂 SQ-1 处理过的小麦后,其同一世代种群参数与对照组相比较,均受到了不同程度的影响,具体表现为:处理组麦长管蚜的内禀增长率rm和周限增长率λ在第 2 代和第 11 代高于对照组,而处理组净增值率R0在第 2 代和第 11 代分别高于和低于对照组,但差异均不显著;处理组内禀增长率rm、周限增长率λ和净增值率R0均在第 6 代低于对照组(P<0.05);处理组平均世代周期T在第 2 代、第 6 代和第 11 代均与对照无显著差异(表 6)。
处理组麦长管蚜内禀增长率rm和周限增长率λ随世代增加呈递减趋势,世代间差异均不显著。对照组内禀增长率rm和周限增长率λ均呈先增加后减少趋势,内禀增长率rm和周限增长率λ在第 2 代与第 11 代无显著差异,而在第 6 代分别显著高于第 2 代和第 11 代(P< 0.05)。处理组净增值率R0随世代推移呈递减趋势,且第 2 代高于第 6 代和第 11 代(P<0.05),第 6 代与第 11 代间无显著差异。对照组净增值率R0随世代增加呈先增加后减少的趋势,第 2 代与第 6 代和第 11 代无显著差异,但第 6 代净增值率R0显著高于第 11 代(P<0.05)。麦长管蚜平均世代周期T随世代增加,处理组呈递减趋势,第 2 代显著高于第 11 代(P<0.05),而第 6 代与第 2 代和第 11 代无显著差异;对照组呈先减少后增加的趋势,第 2 代平均世代周期T显著高于第 6 代 (P<0.05),而第 11 代与第 2 代和第 6 代无显著差异(表 6)。
说明麦长管蚜可以适应一定剂量的 SQ-1 胁迫,即一定剂量的化学杂交剂 SQ-1 具有一定的生态安全性,可适量应用于大面积杂交种的 生产。
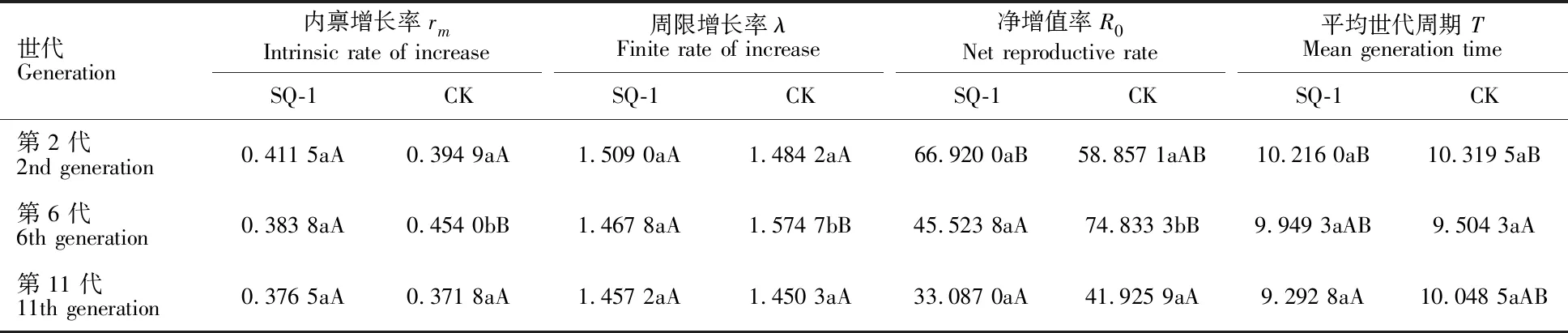
表6 化学杂交剂 SQ-1 对麦长管蚜成虫种群参数的影响Table 6 Effect of chemical hybridization agent SQ-1 on population parameters in Sitobion avenae adults
数据后不同小写字母表示同一世代下处理组与对照组间存在显著差异(P<0.05),不同大写字母表示同一处理下不同世代间存在显著差异(P<0.05)。下同。
Different lower-case letters following the data indicate significant difference between the treatment group and the control group within same generation at 0.05 level,while different capital letters following the data indicate significant difference among different generations within same treatment at 0.05 level.The same below.
2.1.2 SQ-1 对麦长管蚜繁殖参数的影响
用化学杂交剂 SQ-1 处理后的小麦饲喂的麦长管蚜,其产仔前总时间(TPOP)、产仔天数和寿命在第 2 代、第 6 代和第 11 代均与对照组无显著差异(表 7)。随世代推移,麦长管蚜各繁殖参数变化趋势不同,处理组TPOP 随世代增加呈先减少后增加趋势,其中第 2 代TPOP与第 6 代和第 11 代无显著差异,第 6 代TPOP 显著低于第 11 代(P< 0.05);对照组TPOP 呈先减少后增加趋势,第 2 代 TPOP 与第 11 代无显著差异,而第 6 代TPOP 显著低于第 2 代和第 11 代(P<0.05)。处理组麦长管蚜产仔天数呈递减趋势,各世代间均存在显著性差异(P<0.05);对照组产仔天数随世代增加先增加后减少,第2代与第 6 代无显著差异,而第 2 代和第6代显著高于第 11 代(P<0.05)。处理组麦长管蚜寿命随世代推移呈递减趋势,但各世代间均无显著差异;对照组麦长管蚜寿命呈递减趋势,第2代显著高于第 11 代(P<0.05),第6代与第2代和第 11 代无显著差异(表 7)。说明一定剂量的化学杂交剂 SQ-1 对麦长管蚜的种群繁殖能力无显著影响,进一步佐证了小麦化学杂交剂 SQ-1 具有一定的生态安全性。

表7 化学杂交剂 SQ-1 对麦长管蚜成虫繁殖参数的影响Table 7 Effect of chemical hybridization agent SQ-1 on fecundity parameters in Sitobion avenae adults d
2.2 SQ-1 对麦长管蚜体内保护酶及解毒酶活性的影响
2.2.1 保护酶和解毒酶活性分析
处理组的SOD活性在第 2 代、第 6 代和第 11 代均显著高于对照组(P< 0.05)。处理组 SOD 活性随蚜虫世代的增加依次递减,而对照组 SOD 活性随蚜虫世代的增加呈先增加后减少的趋势,相同处理麦长管蚜各世代间 SOD 活性均无显著差异(图 1A)。
与对照组相比,处理组各世代麦长管蚜 POD 活性均显著高于对照组(P<0.05)。处理组 POD 活性随蚜虫世代的增加先增加后减少,第 6 代显著高于第 2 代(P<0.05),第 11 代与第 2 代和第6代间均无显著性差异。对照组 POD 活性表达趋势与处理组相反,第 6 代显著低于第 2 代和第 11 代(P< 0.05)(图 1B)。

图柱上不同小写字母表示显著差异(P<0.05)。
Different lower-case letters above columns indicate significant difference at 0.05 level.
图1 化学杂交剂 SQ-1 对麦长管蚜成虫体内保护酶及解毒酶活性的影响
Fig.1Effect of chemical hybridization agent SQ-1 on protective enzyme activitiesand detoxifying enzyme activity inSitobionavenaeadults
与对照组相比,处理组麦长管蚜 CAT 活性在第 2 代和第 11 代显著升高(P<0.05),第 6 代与对照组差异不显著。处理组CAT 活性随蚜虫世代增加先减少后增加,第 6 代和第 11 代显著低于第 2 代(P<0.05),第 6 代与第 11 代间无显著性差异。CAT 活性在对照组随蚜虫世代增加依次递减,第11代与第6代间无显著差异,但第 11 代较第2代显著降低(P<0.05)(图 1C)。
各世代处理组 AchE活性均显著高于对照组(P<0.05)。处理组和对照组 AchE 活性变化趋势相同,均先增加后减少(图 1D)。上述结果表明,SQ-1 对蚜虫有一定的胁迫效应,但随着世代的增加其胁迫效应逐渐减小,具体表现为保护酶及解毒活随世代增加而呈先显著升高后降低的趋势。进一步说明,化学杂交剂 SQ-1 在蚜虫体内不具有富集效应;麦长管蚜可以通过调节自身的生理代谢过程对 SQ-1 的胁迫损伤进行修复[23]。

表8 保护活性和解毒活性间相关性分析Table 8 Correlation analysis of protective enzyme activities and detoxifying enzyme activity
*:P<0.05,**:P<0.01.
2.2.2 被测酶活性的相关性分析
由表8可知,SOD 活性、POD 活性、CAT 活性和 AchE 活性间均存在正相关关系,具体表现为:SOD 活性与 POD 活性及 CAT 活性呈显著正相关,与 AchE 活性呈极显著正相关;POD 活性与 CAT 活性相关性不显著,但与 AchE 活性呈显著正相关;CAT 活性与 AchE 活性呈显著正相关。上述结果表明,SOD、POD、CAT 和 AchE 之间,可能存在某种相互促进的机制,但 POD 和 CAT 相互促进作用较小。
3 讨 论
小麦是异源六倍体自花授粉纯系作物,其新品种同质化是目前小麦产量实现突破的瓶颈。利用化学杀雄途径实现小麦杂种优势利用是提高小麦单产和实现粮食安全的重要途径之一。SQ-1 是我国自主研制的一种杀雄效果优良的化学杂交剂,在小麦发育的特定时期,以 5 kg·hm-2的 SQ-1 可诱导甘肃河西走廊、山西省晋南麦区、青海高原、四川等地小麦产生 95% 以上的雄性不育率[24-27],且雌蕊发育及其他农艺性状均不受影响,表明该化学杂交剂具有广谱性、高效性及器官专属性。
本研究利用生命表对化学杂交剂 SQ-1 的安全性进行了初步研究,结果表明,麦长管蚜在取食 SQ-1 处理后小麦的种群参数平均世代周期T在各世代间均无显著变化,而内禀增长率rm、周限增长率λ和净增值率R0仅在第 6 代显著低于对照组,繁殖参数产仔前总时间 TPOP、产仔天数和寿命在各世代间均与对照无显著差异。说明一定剂量的 SQ-1 对麦长管蚜种群参数存在一定影响,但随着世代的增加麦长管蚜可逐渐适应 SQ-1 的胁迫,与 Luo等[28]研究结果不一致。差异的主要原因可能是本研究是在活体小麦上接虫,并统计生命表代数高达 11 代,而 Luo 等[28]研究统计生命表的蚜虫代数较低,且其主要用培养基保鲜麦叶饲喂蚜虫,存在一定的环境胁迫。此外,SQ-1 浓度过高或喷施均匀程度是否会对蚜虫生命表参数产生影响、 SQ-1 对田间益虫以及进化地位更高的家畜和人类是否会产生负面效应等仍需进一步探究。

综上所述,化学杂交剂 SQ-1 对麦长管蚜正常的生命活动和种群繁殖能力无显著影响,可能依赖体内的保护酶系统和解毒代谢的协同工作。进一步说明,生物自身保护酶系统和解毒代谢途径可以修复一定剂量的化学杂交剂 SQ-1 对生物造成的胁迫损伤,因此认为小麦化学杂交剂 SQ-1 具有一定的生态安全性。有关麦长管蚜体内解毒代谢和保护酶系统的相互作用、SQ-1 对蚜虫 AchE 活性影响的分子机理、不同剂量 SQ-1 和不同喷施方法对蚜虫的影响、SQ-1 对其他小麦害虫和有益生物的影响乃至对家畜和人类的影响等还有待进一步研究。
