小麦RIL群体苗期抗旱性状的QTL分析
2019-08-22满君霞张国华徐加利吴盼盼李斯深
满君霞,张国华,徐加利,吴盼盼,韩 旭,赵 岩,李斯深
(1.山东农业大学农学院/作物生物学国家重点实验室,山东泰安 271018; 2.泰安市农业局,山东泰安 271000; 3.滨州市农业局,山东滨州 256600)
小麦是我国主要粮食作物之一,也是我国最重要的商品粮食和贮藏品种[1]。随着全球变暖的加剧,干旱已成为世界性的热点问题,严重制约着作物的生长发育和产量提高[2]。据统计,世界上70%的小麦种植于干旱和半干旱地区[3],严重限制小麦的高产、稳产性[4]。我国小麦主要种植在降水少的北方地区,尤其在播种期间降水较少,经常遇到土壤干旱,抑制小麦的萌发和出苗,最终引起小麦产量的降低,因此水分胁迫一直是影响我国北方小麦生产的主要因素之一[5]。提高小麦幼苗的耐旱性可以克服土壤干旱的影响,进而为高产稳产奠定基础[6]。
小麦抗旱性的鉴定指标主要包括形态指标和生理生化指标以及抗旱系数、抗旱指数等综合指标[7-9]。一般抗旱系数值越大,品种的抗旱性越强[10]。小麦的抗旱性是由多基因控制的数量性状,遗传基础复杂。苗期在干旱胁迫下的表现更为直观,选育苗期抗旱性好的品种是提高小麦抗旱性的重要手段[11-13]。小麦苗期根系发育对其抗旱性有重要影响,苗期的根干重与抗旱性呈显著正相关[7-8,14]。在干旱条件下,抗旱小麦品种的根系发达,根较长、根系入土深、根较重、根冠比高[15]。此外,小麦的苗高和芽鲜重也在一定程度上反映出品种的抗旱性[12]。
分子标记技术和生物信息学的发展为从分子水平上研究作物抗旱机理提供了可能,发掘抗旱相关性状 QTL,对开展小麦抗旱分子育种具有促进作用。聚乙二醇(polyethylene glycol,PEG)高渗溶液诱导渗透胁迫最为类似于自然干旱,简单易行、周期短、受环境影响小,已被广泛应用于小麦[16]、水稻[17-18]等重要农作物苗期的耐旱性鉴定。在模拟条件下研究作物的抗旱性能够最大限度的消除大田环境下不可控环境条件的影响[10]。前人开展了许多苗期抗旱性状的QTL分析。例如,周晓果等[15]以小麦DH家系为材料,在水分胁迫和非水分胁迫条件下,对最长根长、根鲜重、根干重、根茎鲜重比和根茎干重比等根系性状进行QTL定位,共检测到11个加性效应QTL和15对上位效应QTL。张正斌等[19]对 33个与小麦水分利用效率有关的性状进行了QTL分析,在6A和 6B上发现控制根系的多个QTL簇。Landjeva等[20]在模拟的干旱条件下调查小麦水培幼苗的根长、苗高等性状,共发现35个QTL。
由于不同研究所用的分析群体以及分子标记图谱不同,所得的结果也不尽相同,小麦抗旱性QTL还需要进一步研究,因此,本研究以小麦“泰农18×临麦6号”RIL(Recombinant Inbred Lines)群体为材料,利用本实验室构建的高密度遗传图谱[21],在PEG-6000模拟干旱胁迫和正常供水两种处理下,对苗期性状及其抗旱系数进行QTL分析,以期为小麦抗旱基因的克隆、分子标记辅助育种等研究提供参考。
1 材料与方法
1.1 试验材料
试验材料为 “泰农18×临麦6号”RIL群体(TL-RIL,包括184个家系)及其亲本。泰农18是本课题组选育的小麦品种,于2008年通过山东省农作物品种审定委员会审定。临麦6号是临沂市农科院选育的小麦品系。
1.2 试验设计
试验在山东农业大学温室进行。采用水培法,试验设置PEG模拟干旱胁迫(D)和正常供水(CK)两种处理,重复3次。进行2次试验,时间分别为2012年10月19日至11月19日(记为D1,CK1)和2012年11月28日至12月28日(记为D2,CK2)。模拟干旱胁迫处理的平均值记为DAV,正常供水处理的平均值记为CKAV。小麦RIL群体各家系及其父母本种子经过10%双氧水消毒5 min后,用蒸馏水冲洗数次,放入培养皿中,在光照培养箱中培养幼苗(温度为25 ℃,光照周期为12 h·d-1,相对湿度为60%~70%)。当幼苗长到一叶一心时,挑选长势健壮一致的幼苗,植于发芽盘中并用海绵固定,每个株系1穴,每穴2株,每株系3次重复共6株 。将发芽盘置于盛有20 L Hoagland 营养液的黑色塑料盒中,保持根系在黑暗环境中生长,用塑胶封住发芽盘周围间隙,防止水分蒸发。培养1天后,以含有 19.2% PEG-6000 的Hoagland 营养液进行模拟干旱胁迫处理(小麦抗旱性鉴定评价技术规范:GB/T 21121-2007),正常供水处理则不加PEG。当对照植株长到三叶期时测定相关性状[15]。
1.3 抗旱性状测定和抗旱系数计算
本试验调查以下性状:苗高、最大根长、根数、苗鲜重、根鲜重、苗干重和根干重,每个性状的表型值分别为3次重复的平均值。鲜重根冠比=根鲜重/苗鲜重;干重根冠比=根干重/苗干重。用两次试验的平均值计算抗旱系数:抗旱系数=胁迫下性状测定值的平均值/非胁迫下性状测定值的平均值。
1.4 数据统计分析和QTL定位

利用“泰农18×临麦6号”RIL群体的高密度遗传图谱进行QTL分析[21],该图谱包括 10 739个位点,其中独立位点 5 399个(3 788个DArT、 1 506个SNP、105个SSR位点),总长 3 394.47 cM,平均密度0.63 cM/marker。QTL分析采用Icimapping 4.1软件,步长为0.5 cM。LOD 的阈值通过置换检测确定(permutation test):命令在P=0.05 水平时使用 1 000次重复排列运算后,确定为LOD≥3.8。
定义相对较高频率QTL(relative high frequency QTL,RHF-QTL)为在D1、D2、DAV(或CK1、CK2、CKAV)中的两个或两个处理以上检测到的QTL;因抗旱系数按平均值计算,因此抗旱系数QTL也看做RHF-QTL。定义在同一染色体置信区间重叠涉及到3个以上性状QTL为QTL簇[22-23]。
2 结果与分析
2.1 表型性状
多数性状在亲本泰农18(Tainong 18)和临麦6号(Linmai 6)之间表现出明显的差异,并且所有性状在RIL群体中均出现超亲分离(表1),变异系数的范围为6.73%~37.92%,多数性状-环境的变异系数超过10%。遗传力最大为 70.20%(苗高,CK),最小为48.00%(干重根冠比,CK);干旱胁迫处理下比正常水分处理下的遗传力稍低。
2.2 QTL分析
利用本课题组创建的遗传图谱[21],用 IciMapping完备区间作图法[24]进行QTL分析。结果表明,共检测到43个QTL(58个单一性状-环境组合QTL)(表2),位于14条染色体(1A、1D、2A、2B、2D、3A、3B、4A、4B、5B、6A、6B、7B、7D)。其中28个QTL为正值,表明QTL的增加效应来自于母本泰农18;30个QTL为负值,表明其增加效应来自于父本临麦6号。单一QTL可解释3.39%~32.63%的表型变异,LOD最大值为52.88(鲜重根冠比)。上述QTL中,11个为在两个或两个以上个处理下检测到的高频表达QTL(RHF-QTL),1个簇位于4B染色体上 (表3)。
在两种水分处理下均检测到的QTL有10个,分布在1A、3A、4B、5B、7B染色体上,其中有8个QTL(QSh-4B-1、QMrl-D-3A-2、QRn-D-5B-2、QSfw-4B-1、QSfw-4B-1、QRsfw-4B-1、QRsfw-D-4B-1、QRsdw-4B-1.1)的贡献率均大于10%。只在干旱胁迫下检测到的QTL有18个,分布在1D、2D、3A、3B、4A、4B、6A、7D染色体上,其中有6个QTL(QSh-3B-2.2、QMrl-4A-1、QSfw-6A-3、QRfw-6A-2.1、QRsfw-7D-1.2、QRsdw-4B-1.2)的贡献率大于10%。仅在正常水分处理下检测到的QTL有15个,分布在1A、1D、2A、2B、3B、4A、6B染色体上,其中有4个QTL(QMrl-3B-3.1、QSh-2B-2.1、QSh-2B-2.2、QRn-6B.2)的贡献率大于10%。
2.2.1 形态性状的QTL
苗高(SH):共检测到5个QTL,分布在2B(2个QTL)、3B(2个QTL)、4B染色体,可解释6.71%~30.32%的表型变异。其中QSh-4B-1的平均贡献率为23.37%,在两种水分处理下均能检测到,是主效RHF-QTL,增加QTL效应来自临麦6号。
最大根长(MRL):共检测到5个QTL,分布在1D、3B(2个QTL)、4A、6B染色体上,可解释6.21%~12.10%的表型变异。其中,QMrl-3B-3.1的平均贡献率为11.42%,在两种处理下均能检测到,是RHF-QTL,增加QTL效应来自临麦6号。
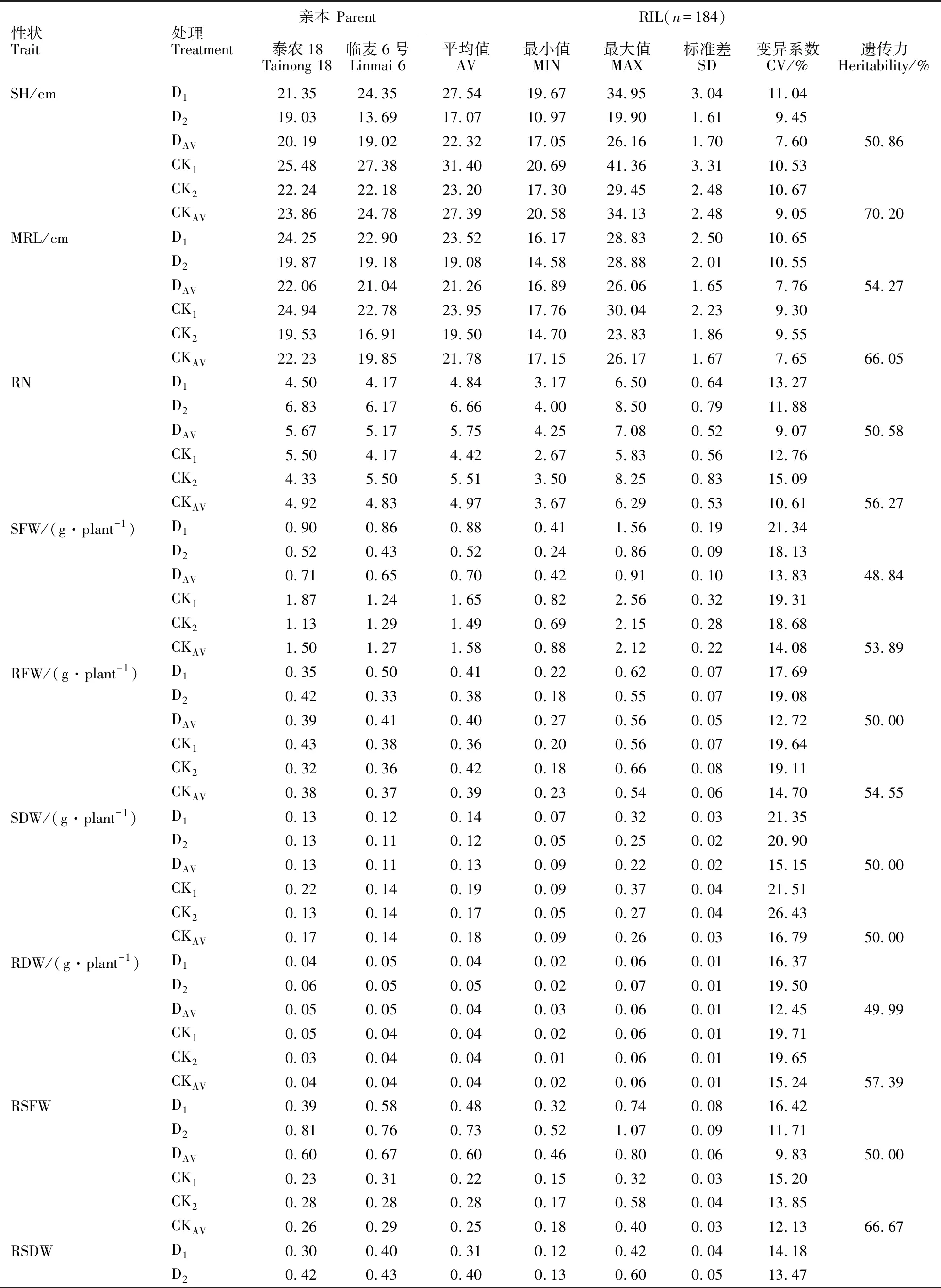
表1 RIL群体及其亲本的性状表现Table 1 Phenotypic performance for investigated traits of the RILs and their parents
(续表1 Continued table 1)
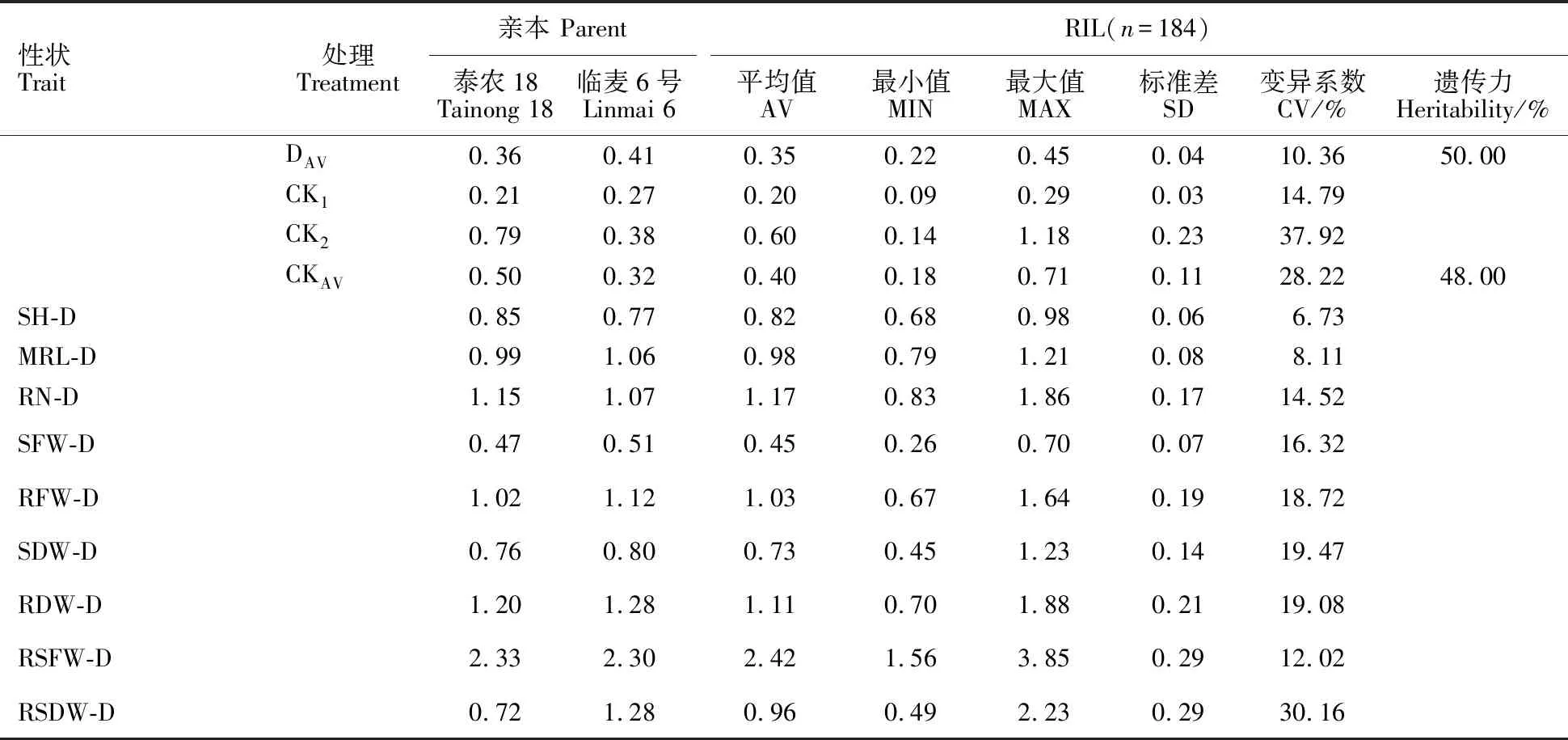
性状Trait处理Treatment亲本 Parent泰农18Tainong 18临麦6号Linmai 6RIL(n=184)平均值AV最小值MIN最大值MAX标准差SD变异系数CV/%遗传力Heritability/%DAV0.36 0.41 0.35 0.22 0.45 0.04 10.36 50.00 CK10.21 0.27 0.20 0.09 0.29 0.03 14.79 CK20.79 0.38 0.60 0.14 1.18 0.23 37.92 CKAV0.50 0.32 0.40 0.18 0.71 0.11 28.22 48.00 SH-D0.85 0.77 0.82 0.68 0.98 0.06 6.73 MRL-D0.99 1.06 0.98 0.79 1.21 0.08 8.11 RN-D1.15 1.07 1.17 0.83 1.86 0.17 14.52 SFW-D0.47 0.51 0.45 0.26 0.70 0.07 16.32 RFW-D1.02 1.12 1.03 0.67 1.64 0.19 18.72 SDW-D0.76 0.80 0.73 0.45 1.23 0.14 19.47 RDW-D1.20 1.28 1.11 0.70 1.88 0.21 19.08 RSFW-D2.33 2.30 2.42 1.56 3.85 0.29 12.02 RSDW-D0.72 1.28 0.96 0.49 2.23 0.29 30.16
SH:苗高;MRL:最大根长;RN:根数;SFW:苗鲜重;RFW:根鲜重;SDW:苗干重;RDW:根干重;RSFW:鲜重根冠比;RSDW:干重根冠比。性状-D:该性状的抗旱系数;D1、CK1:2012年10月19日至11月19日进行的PEG胁迫处理(D1)和非胁迫处理(CK1);D2、CK2:2012年11月28日至12月28日进行的PEG胁迫处理(D2)和非胁迫处理(CK2); DAV、CKAV:两次胁迫处理的平均值(DAV)和两次非胁迫处理的平均值(CK2)。下同。
SH:Shoot height; MRL:Maximum root length; RN:Root number; SFW:Shoot fresh weight; RFW:Root fresh weight; SDW:Shoot dry weight; RDW:Root dry weight; RSFW:Root-shoot ratio in fresh weight; RSDW:Root-shoot ratio in dry weight.Trait-D:Drought resistance coefficient of corresponding traits;D1and CK1:PEG stress treatment(D1) and non-stress treatment(CK1) from October 19 to November 19,2012; D2and CK2:PEG stress treatment(D2) and non-stress treatment(CK2) from November 28 to December 28,2012; DAVand CKAV:Mean value of two stress treatments(DAV) and average of two non-stress treatments(CK2).The same below.
根数(RN):共检测到9个QTL,分布在1A(2个QTL)、1D、2A、3B、4A(2个QTL)、6B(2个)染色体,可解释3.39%~14.07%的表型变异,无RHF-QTL 。
苗鲜重(SFW):共检测到3个QTL,分布在1D、4B、6A染色体,可解释7.39%~17.16%的表型变异。QSfw-4B-1的平均贡献率为15.37%,在两种水分处理下均能检测到,是主效RHF-QTL,增加QTL效应来自临麦6号。
根鲜重(RFW):共检测到6个QTL,分布在2D、3A、4A、4B、6A(2个QTL)染色体上,可解释 5.08%~10.65%的表型变异。
苗干重(SDW):共检测到1个QTL,位于4B染色体,QSdw-4B-1的平均贡献率为13.42%,在两种水分处理下均能检测到,是主效RHF-QTL,增加QTL效应来自临麦6号。
根干重(RDW):共检测到3个QTL,分布在2D、3B、4A染色体上,可解释6.49%~9.52%的表型变异。
鲜重根冠比(RSFW):共检测到3个QTL,分布在4B、7D(2个QTL)染色体,可解释 3.99%~32.63%的表型变异。QRsfw-4B-1的平均贡献率为23.88%,在两种水分处理下均能检测到,是主效RHF-QTL,增加QTL效应来自泰农18。
干重根冠比(RSDW):共检测到3个QTL,分布在3B、4B(2个QTL)染色体,可解释 9.77%~25.02%的表型变异。
2.2.2 抗旱系数的QTL
所有9个性状的抗旱系数中,仅检测到3个性状抗旱系数的QTL。
最大根长抗旱系数(MRL-D):共检测到3个QTL,分布在1A、3A、7B染色体,可解释 6.45%~10.38%的表型变异。
根数抗旱系数(RN-D):共检测到1个QTL (QRn-D-5B-2),位于5B染色体上,贡献率为 12.80%,增加效应来自泰农18。
鲜重根冠比抗旱系数(RSFW-D):共检测到1个QTL(QRsfw-D-4B-1),位于4B染色体上,贡献率为12.97%,增加效应来自临麦6号。
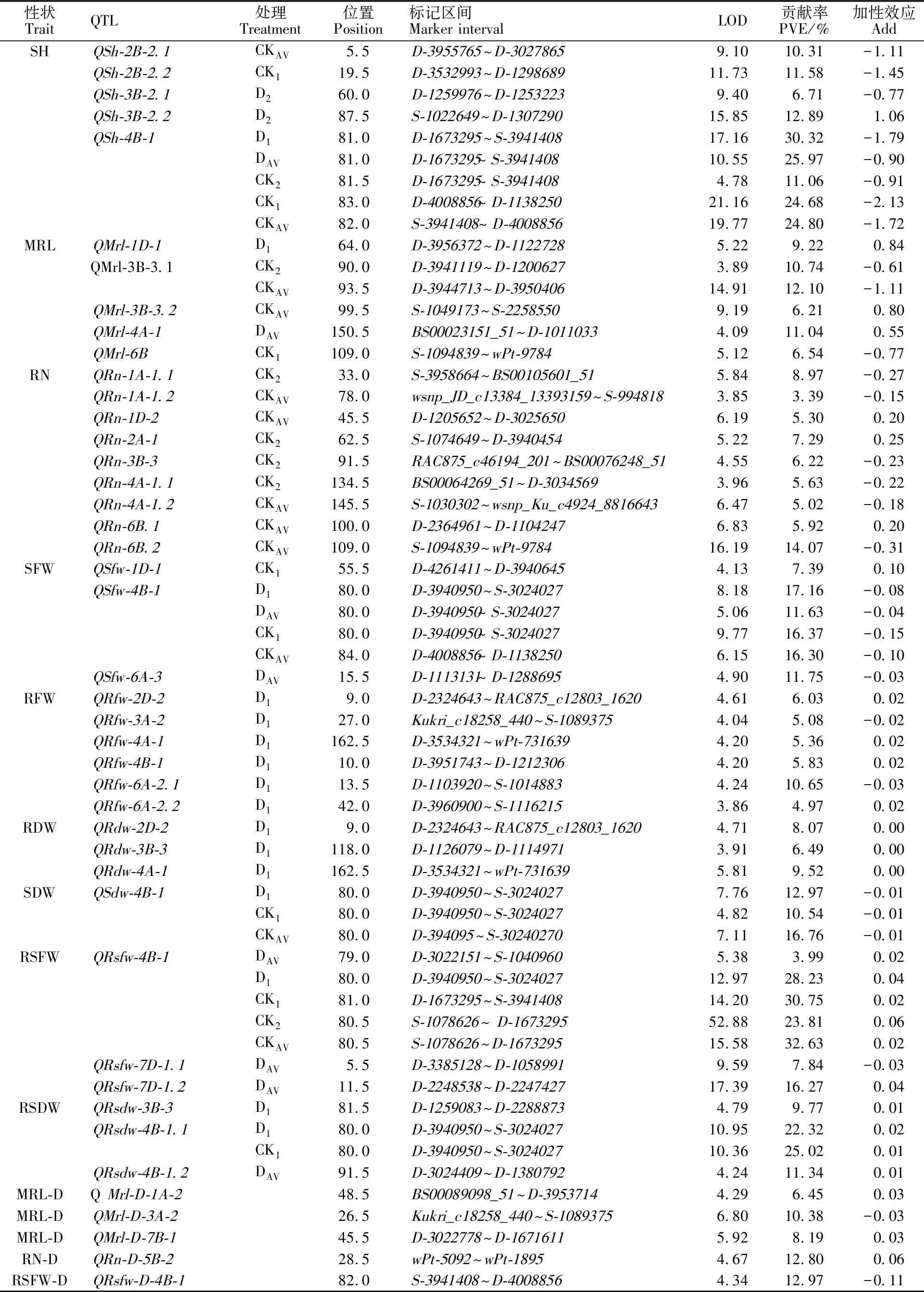
表2 不同水分处理下的抗旱性状QTL定位Table 2 QTLs for drought resistance related traits detected in different drought treatments using the RILs
2.3 QTL簇分析
本研究中,在4B染色体上发现了一个QTL簇,包括4个形态性状的QTL(QSh-4B-1、QSfw-4B-1、QSdw-4B-1、QRsfw-4B-1)和1个抗旱系数QTL(QRsfw-D-4B-1)。这5个QTL的平均贡献率较高,变化范围为12.97%~20.69%,是主效RHF-QTL。QRsfw-4B-1的增加效应来自泰农18,其他4个QTL增加效应均来自临麦6号(表3)。

表3 不同水分处理下的抗旱性状QTL簇Table 3 QTL Clusters of drought resistance related traits under different drought treatments
3 讨 论
小麦的抗旱性是由多基因控制的复杂的数量性状,是小麦本身的遗传特性和环境共同作用的结果。本试验以PEG-6000模拟干旱胁迫,在很大程度上可以消除环境的干扰。在以往的研究中,已经定位到许多关于小麦苗期抗旱性状的QTL[6,15]。Zhang 等[6]在染色体4B上定位到一个控制株高的QTL,本研究在4B染色体上也定位到1个控制苗高的QTL,贡献率为23.37%,从系谱分析,这个QTL可能与rht-B1基因有关。周晓果等[15]在6B染色体上定位到控制最大根长的QTL,本研究在6B染色体上也定位到一个控制最大根长的QTL,可解释6.54%的表型变异。由于不同研究者利用的群体和标记类型不同,难以根据分子标记进行详细比较,本研究的大多数QTL定位在新的分子标记区间。
多个QTL定位在染色体同一区域形成QTL簇,前人在小麦中发现了许多QTL簇[23,25-26]。本研究在4B染色体上发现了一个QTL簇,包括4个形态性状的QTL(QSh-4B-1、QSfw-4B-1、QSdw-4B-1、QRsfw-4B-1)和1个抗旱系数QTL (QRsfw-D-4B-1)。Yuan等[26]利用该RIL群体进行了苗期和成株期P效率相关性状的QTL分析,在该区域也发现了一个QTL簇(C5),包括SDW(苗干重)、TDW(植株总干重)、RSDW(干重根冠比)、SPUTE(苗期P利用效率)、SN(单位面积穗数)、GWP(单株粒重)、GPTUE(籽粒的P利用效率)的QTL。这表明该区域不但与抗旱相关,而且与P利用效率性状相关。该区间覆盖的标记(D-3022151~D-4008856)可以用作标记辅助选择。
