乌拉尔图小麦WOX基因的克隆与表达分析
2019-08-22单强强阳文龙李英洁刘冬成孙家柱张爱民程西永
单强强,阳文龙,李英洁,刘冬成, 孙家柱,张爱民,程西永
(1.河南农业大学农学院, 河南郑州 450002; 2.植物细胞与染色体工程国家重点实验室, 中国科学院遗传与发育生物学研究所, 北京 100101)
WOX(WUSCHEL-relatedhomeobox)家族基因在植物胚胎发生、干细胞维护和根的形成等关键发育过程中起着重要作用[1],其编码蛋白是一类植物特有的转录因子,是同源异型结构域(Homeodomain, HD)蛋白Homeobox(HOX)超家族中的一员[2]。典型的HD包括60个氨基酸残基,组成helix 1 -loop-helix2-turn-helix3的空间结构,起到与特异DNA序列结合的作用[3]。WOX蛋白家族的HD含有65个氨基酸残基(WUS为66个),属于含有额外氨基酸残基的非典型的HD[4],HD下游还含有其他功能元件[5]。系统发育分析发现,WOX家族可分为3支:WUS支/进化支、中间支和古老支,WUS支成员WUS-box起始氨基酸为T-L,古老支和中间支起始氨基酸并不固定[5]。古老支的WOX成员只存在低等植物中,中间支在维管植物中开始出现,进化支的WOX成员仅存在高等植物中,其含有特异的WUS盒(T-L-X-L-F-P-X-X,其中X代表任何一个氨基酸),表明中间支和进化支可能是经过古老支成员复制和分化形成的[6]。自1996年Laux等克隆得到了WUS基因以来,很多物种都已克隆到WOX家族基因;如拟南芥中有15个,水稻中有13个,玉米中有21个被鉴定[7-8]。拟南芥中,WUS支/进化支包括WUS和WOX1-WOX7,中间支包括WOX8、WOX9、WOX11和WOX12,古老支包括WOX10、WOX13和WOX14[5]。WUS和WOX5分别在茎尖分生组织(SAM)和根尖分生组织(RAM)的中心细胞中表达,具有维持干细胞分裂的功能[3,9-10]。此外,WUS还参与调控胚珠和花药的发育[11-12]。WUS蛋白不仅可以作为抑制因子,而且在调控AG基因时起到了活化剂的作用[6]。研究表明,WUS/PGA6可能通过促进营养生长向胚胎发生的转变或维持胚胎干细胞的属性从而对胚胎发育起着重要作用[13]。WOX2和WOX8、WOX9均在合子中表达,与胚胎早期顶—基部分的形成相关[14]。WOX3/PRS1(PRESSED FLOWER1)主要在分生组织的外围进行表达,对营养时期和生殖时期干细胞的表达调控有重要作用[15]。AtWOX4参与SAM和RAM中维管束的形成与发育[16]。AtWOX5在根尖不活动中心特异表达[5],主要控制拟南芥RAM的活性[17]。WOX6/PFS2主要在胚珠中表达并调节胚珠的发育,在珠被和卵细胞的形成过程中防止细胞的提前分化[18],WOX6可以影响冷胁迫的应答[19]。WOX13、WOX14在根部及花药表达,并且受到严格调控,具有防止提前分化的功能[20]。
水稻WOX基因的表达模式和功能与拟南芥的WOX基因存在一定的差异,如OsWUS主要在幼苗时期的叶原基表达,特别是叶原基顶端,另外也在茎尖分生组织以及花序原基中表达,说明单子叶植物的水稻和双子叶植物的拟南芥WUS基因的表达模式出现了分化[21];AtWOX4与微管分生组织发育相关[16],但其同源基因OsWOX4在微管丰富的叶片和根中没有检测到明显的表达信号[22],说明该基因在拟南芥和水稻的功能上存在一定程度的分化。
目前,小麦的WOX基因只克隆到2个成员:TaWOX2和TaWOX5s(包括TaWOX5a,TaWOX5b,TaWOX5c),TaWOX2主要在种子发育过程中表达,TaWOX5s主要在小麦根和愈伤组织中表达,它们的染色体定位和具体功能还不清楚[23]。乌拉尔图小麦是普通小麦 A 基因组的原始二倍体供体种,也是普通小麦进化的基础性基因组,对普通小麦的发展和进化起着核心作用[24]。伴随着小麦 A 基因组测序的完成,乌拉尔图小麦因为具有基因组相对较小、遗传背景简单、遗传多样性高等优点而成为打破小麦研究瓶颈的新的切入点。因此,本研究以乌拉尔图小麦为研究对象,以已知的水稻和拟南芥的WOX基因编码蛋白搜索乌拉尔图小麦的基因组数据库,获得候选WOX基因家族的蛋白序列、cDNA序列和DNA序列,对乌拉尔图小麦中WOX基因进行同源克隆,并进行生物信息学分析、组织特异性和非生物逆境胁迫的表达分析,初步明确乌拉尔图小麦WOX家族基因的组成类别、系统发生情况,以及在不同组织和不同逆境胁迫下的表达特性,以期为深入研究小麦WOX基因家族的结构、功能和表达调控模式等提供参考。
1 材料与方法
1.1 植物材料及处理
供试材料为已进行基因组测序的乌拉尔图小麦(Triticumurartu)材料G1812,将其种植于 22 ℃、16 h光照/8 h黑暗的温室条件下,生长两周,取部分叶片用于DNA的提取;其余材料分别做以下处理:100 μmol·L-1ABA处理;置于 4 ℃冰箱进行低温处理;室温条件下自然脱水处理;用200 mmol·L-1NaCl进行高盐胁迫处理。所有处理均为3 h;以未处理幼苗为对照,3次重复。采集各处理幼苗的叶片,液氮速冻,置于超低温冰箱保存备用。
2013年9月底,播种乌拉尔图小麦于中国科学院遗传与发育生物学研究所北京昌平实验农场;于2014年5月,乌拉尔图小麦长至抽穗期,采集根、茎、旗叶和幼穗,液氮速冻,保存于超低温冰箱用于RNA提取。
1.2 基因组DNA的提取及WOX基因的克隆
用CTAB法提取生长2周的乌拉尔图小麦幼苗叶片的基因组DNA,用紫外分光光度计及0.8%琼脂糖凝胶电泳检测DNA的浓度和质量,将DNA浓度调整为100 ng·μL-1。以其为模板,用WOX基因特异引物(表1)进行PCR,反应体系与程序参考LA Taq polymerase说明书,其中循环数为40,退火温度为57 ℃,延伸时间为 2 min 30 s。
PCR产物经1%琼脂糖凝胶电泳分离后,切下目的DNA片段,用TIAN gel DNA Purification Kit(天根,北京)回收目的片段,用pGEM-T Easy载体连接试剂盒(Promega,美国)进行连接。连接产物采用热激法转化大肠杆菌,用菌落PCR筛选含有目的片段的阳性克隆,然后送至北京博迈德基因技术有限公司进行测序。
1.3 乌拉尔图小麦总RNA的提取和cDNA第一链合成
用RNeasy Plant Mini Kit(QIAGEN,德国)按照试剂盒说明书提取乌拉尔图小麦材料的总RNA,用紫外分光光度计和1%琼脂糖凝胶电泳检测RNA的浓度和完整性。用FastQuant RT Kit (With gDNase)(天根,北京)进行cDNA第一链的合成,具体操作按试剂盒说明书进行。
1.4 WOX基因序列的生物信息学分析
用DNAMAN Version 8和DNASTAR Lasergene v7.1对测序结果进行序列拼接和比对分析,用NCBI-CDD(http://www.ncbi.nlm.nih.gov/ Structure/cdd/docs/cdd_search.html)分析氨基酸序列的保守结构域,用ExPASy-ProtParam tool在线分析工具(http://web.expasy.org/protparam/)分析氨基酸序列的理化性质,用CBS-TMHMM Server v. 2.0(http://www.cbs.dtu.dk/ services/TMHMM/)进行跨膜结构域预测,用GenScript-PSORT(https://www.genscript.com/psort.html)进行亚细胞定位预测,用CBS-SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测。用GSDS2.0(http://gsds.cbi.pku.edu.cn/)进行基因结构分析,用Clustal W(www.ebi.ac.uk/clustalw)或者DNASTAR Lasergene v7.1的Megalign进行蛋白序列比对分析,用MEGA6进行系统发育分析。
1.5 WOX基因的表达分析
以上述合成的cDNA为模板,用WOX基因特异引物(表1),以小麦Ta4045(ubiquinol-cytochrome C reductase iron-sulfur subunit)基因为内参基因,用实时荧光定量PCR(qRT-PCR)技术在Roche LightCycler 480 system(Roche,美国)参照LightCycler 480 SYBR Green 1 Master Kit(Roche,美国)说明书进行WOX基因的表达 分析。
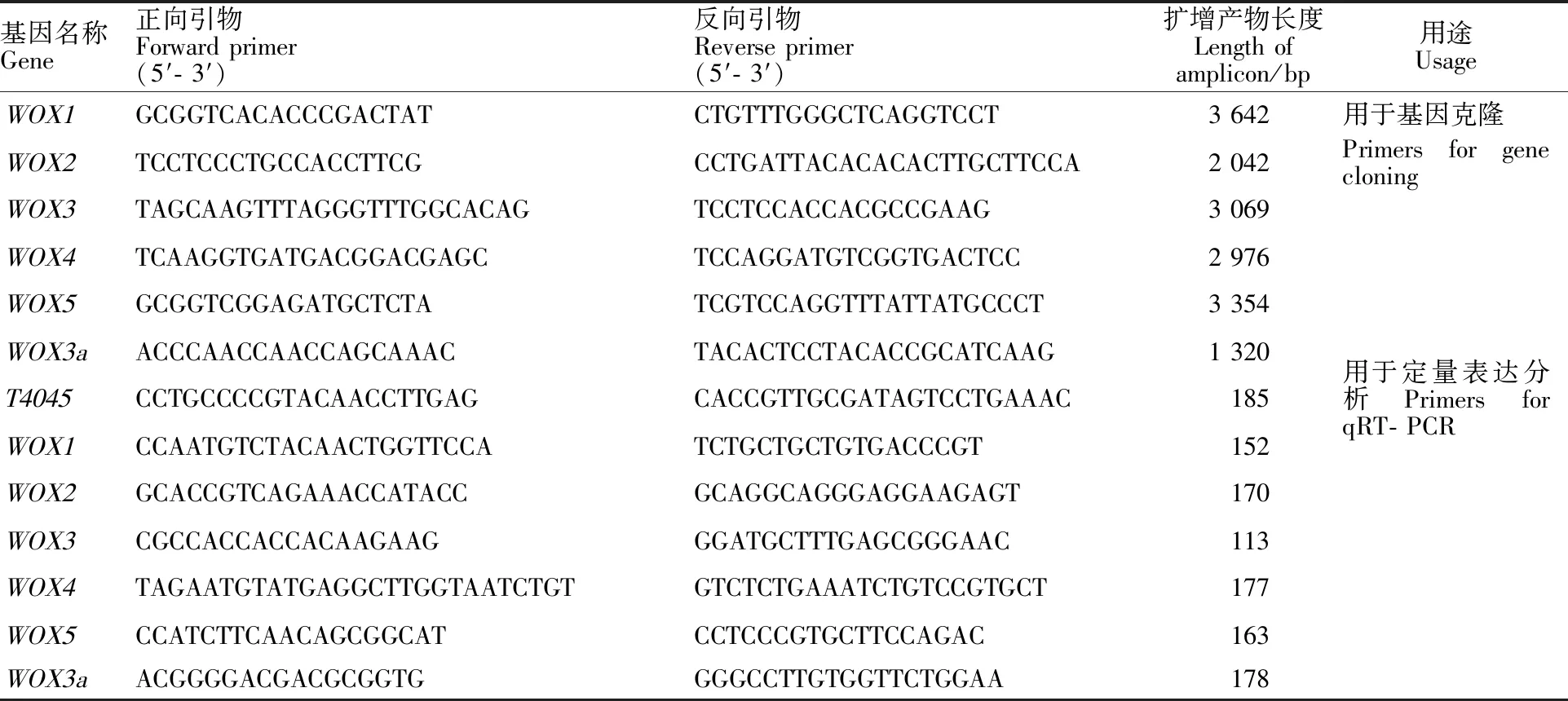
表1 WOX基因克隆和定量表达分析所用引物Table 1 Primers used for WOX gene cloning and qRT-PCR
2 结果与分析
2.1 TuWOX基因的克隆与序列分析
用已知的水稻和拟南芥WOX基因编码蛋白序列,搜索小麦二倍体祖先种乌拉尔图小麦的基因组数据库,获得候选WOX基因的蛋白序列、cDNA和基因组DNA序列。根据获得的候选序列分别设计特异引物(表1),以乌拉尔图小麦基因组DNA为模板进行PCR,克隆得到6个基因,扩增长度分别为3 642、2 042、3 069、2 976、3 354和1 320 bp,包括部分5′和3′UTR和完整的CDS序列。用NCBI-CDD对其编码氨基酸序列的保守结构域进行分析,发现6个基因的编码氨基酸都含有与水稻、拟南芥及二穗短柄草高度相似的保守结构域(图1,图2),说明从乌拉尔图小麦中成功克隆得到6个WOX家族基因,分别命名为TuWOX1、TuWOX2、TuWOX3、TuWOX4、TuWOX5和TuWOX3a,并对这6个基因进行生物信息学分析。
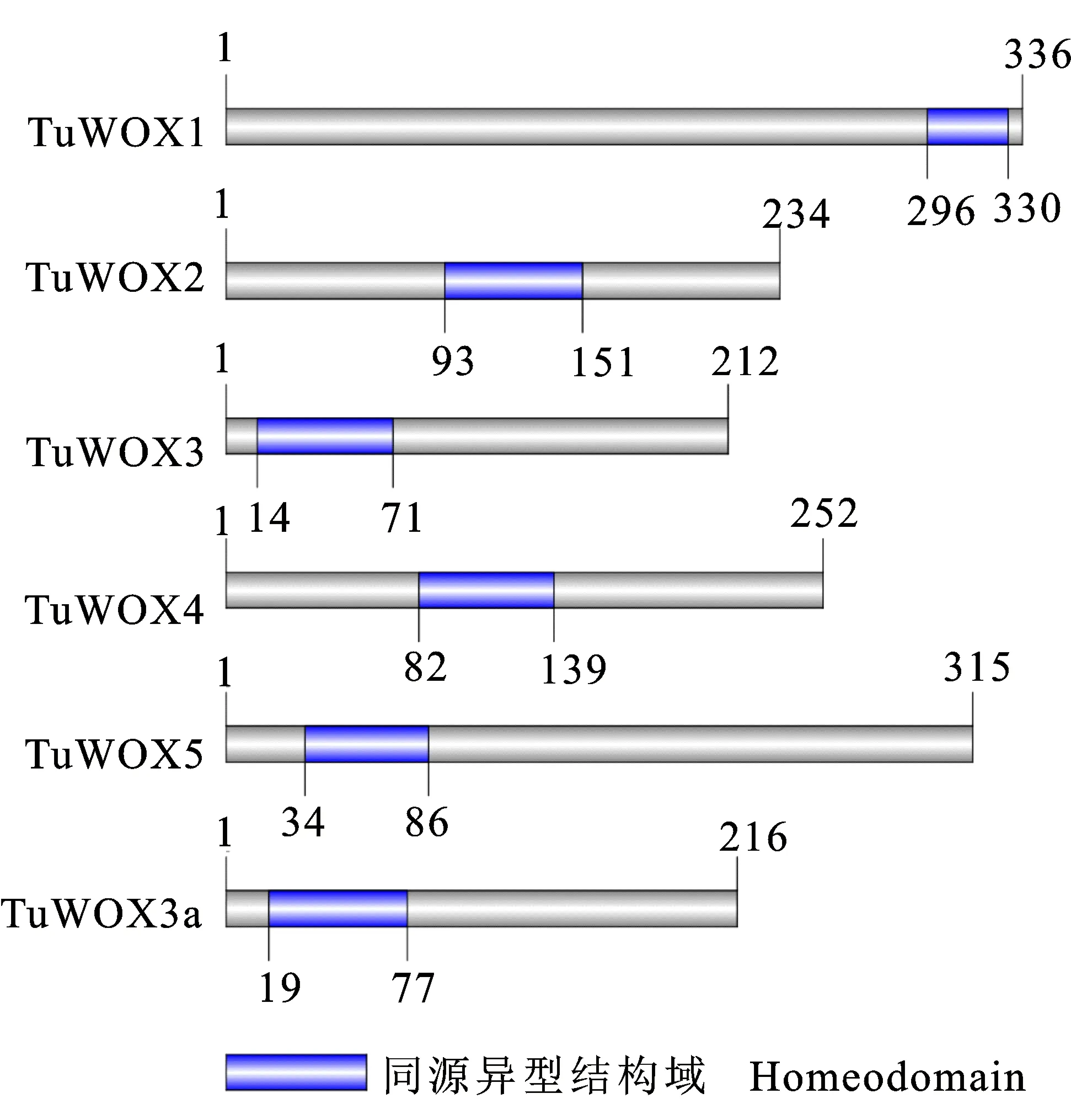
图1 TuWOX蛋白的氨基酸序列保守结构域Fig.1 Conserved domain of the deduced amino acid sequences of TuWOXs
将6个乌拉尔图小麦TuWOX基因与水稻的13个WOX基因、拟南芥的15个WOX基因以及二穗短柄草的7个WOX基因同源异型结构域序列进行多重比对(图2),发现这四种植物WOX基因的同源异型结构域中保守氨基酸位点的分布非常相似。已有研究表明,同源异型结构域中存在着几个保守的氨基酸位点,例如螺旋1(helixl)中的Q、L和Y,螺旋3(helix3)中的V、W、F、N[25]。在本研究中,我们发现WOX蛋白同源异型结构域中存在着其他的保守氨基酸残基,包括螺旋1(helixl)中的R、W、P,螺旋2(helix2)中的P、I和L,螺旋3(helix3)中的Y、F、Q和N,以及转角(turn)中的 G。同时发现,在环(loop)中存在可变的氨基酸残基,而之前也有报道说明在一些非典型同源异型结构域蛋白的同源异型结构的环和转角区域存在额外的氨基酸残基[3,26-27]。
理化性质分析结果(表2)表明,6个基因所编码的蛋白质的不稳定性指数和脂溶指数均大于50,总平均疏水性指数均为负值,故而都是不稳定的亲水性脂溶蛋白,其中TuWOX2和TuWOX3a的等电点大于9,且碱性氨基酸残基数远大于酸性氨基酸残基数,为碱性蛋白。跨膜结构预测分析发现,6个蛋白均不存在跨膜结构域,属于非跨膜蛋白类。亚细胞定位预测结果表明,除TuWOX1定位于线粒体外,其余5个蛋白均定位于核内。信号肽预测结果表明,6个蛋白均不含信号肽。基因结构分析结果(图3)表明,除TuWOX3a没有内含子外,其他5个基因分别含有7、2、1、3和1个内含子。
2.2 WOX蛋白的系统发育分析
为研究乌拉尔图小麦WOX基因的进化关系,用MEGA6软件对6个乌拉尔图小麦WOX蛋白序列进行了N-J (Neighbor-Joining)和L(Maximun-Likehood)两种方法的系统发生分析,发现两种方法构建的进化树在整体上具有非常相似的拓扑结构,仅少部分节点有所区别。因此,以N-J法构建的进化树(图4)为例进行乌拉尔图小麦WOX基因编码蛋白的系统进化分析,发现TuWOX3a、TuWOX2和TuWOX3聚在了一支,TuWOX4和TuWOX5分别聚在了另外两支,而TuWOX1为单独一支。前人研究认为拟南芥WOX蛋白大致可以分为三个系统进化支,分别为包括WUS、WOX1、WOX2、WOX3、WOX4、WOX5、WOX6和WOX7的WUS支,包括WOX8、WOX9、WOX11和WOX12的中间支,以及包括WOX10、WOX13和WOX14的古老支[5-6]。因此,TuWOX3a、TuWOX2和TuWOX3属于WUS支,TuWOX4属于古老支,TuWOX5属于中间支,除了这三个分支外,TuWOX1自成一支,说明在乌拉尔图小麦中可能出现了不同功能的WOX家族基因。

At:拟南芥;Bd:二穗短柄草;Os:水稻;Tu:乌拉尔图小麦。
At:Arabidopsisthaliana; Bd:Brachypodiumdistachyon; Os:Oryza sativa; Tu:Triticumurartu.

图2 WOX蛋白同源异型结构域的比对分析

图3 TuWOX基因结构分析Fig.3 Structure of TuWOX genes
2.3 TuWOX基因的表达分析
2.3.1TuWOX基因的组织表达模式分析
为研究6个TuWOX基因在组织中的表达模式,本研究设计了基因特异引物,对乌拉尔图小麦抽穗期的幼穗、茎、旗叶和根进行qRT-PCR。结果(表3)表明,TuWOX基因在各个组织中均为组成性表达,但在不同组织中的表达量有差异,其中,TuWOX1、TuWOX3、TuWOX4、TuWOX5和TuWOX3a均在根中表达量最高,TuWOX2在茎中的表达量最高,说明其在调控植物生长的过程中所起到的作用及参与的机制可能不同。另外,TuWOX4在根、茎、叶、穗中的表达水平均较高,TuWOX1在根和叶中的表达水平较高,其余基因在各组织中的表达量均很低。同时,这6个基因在穗中的相对表达都较低,表明WOX家族基因可能对穗的生长发育作用不大,或没有直接作用。

表3 TuWOX基因在不同组织中的表达量Table 3 Expression profiles of the TuWOX genes in different tissues
表中同一列数据后的不同大写字母表示不同组织之间的差异达到极显著水平(P<0.01)。
The different captain letters following the values represent the expression difference in different tissues are highly significant (P<0.01).

图4 乌拉尔图小麦TuWOX与其他植物的WOX蛋白的系统进化树Fig.4 Phylogenetic analysis of TuWOXs and WOX proteins from other plants
2.3.2 不同胁迫条件下TuWOX基因的表达 分析
对乌拉尔图小麦6个TuWOX基因在ABA、低温、干旱和高盐胁迫条件下的表达水平进行了分析,结果(表4)表明,TuWOX1在低温胁迫下表达量有所增加,而在干旱及高盐条件下表达量显著降低;TuWOX2在四种胁迫条件下,表达量均显著降低;TuWOX3在低温和干旱胁迫条件下表达量都显著增加;TuWOX4在干旱胁迫下表达量显著增加,而在低温、高盐及ABA处理下表达量显著降低;TuWOX5及TuWOX3a在植株体内表达水平较低,TuWOX5在四种胁迫条件下,表达量均降低;TuWOX3a在低温、干旱和高盐条件下表达量显著降低。

表4 TuWOX基因在不同胁迫条件下的表达模式Table 4 Expression profiles of the TuWOX genes under different stresses
表中同一列数据后的不同大写字母表示不同处理之间的差异达到极显著水平(P<0.01)。
The different captain letters following the values represent the expression difference in different treatments are highly significant(P<0.01).
3 讨 论
本研究通过同源克隆,获得6个乌拉尔图小麦WOX家族基因,分别命名为TuWOX1、TuWOX2、TuWOX3、TuWOX4、TuWOX5和TuWOX3a。它们都具有一个同源异性结构域,通过同源异性结构域的分析可以确定这6个基因属于WOX基因家族。
系统发育分析表明,TuWOX2与OsWOX4及AtWOX4亲缘关系最近。表达模式分析发现,TuWOX2在根部的表达量较高。据报道,拟南芥AtWOX4基因主要参与SAM与RAM维管束的发育与形成,并且AtWOX14在调节维管细胞分裂上与AtWOX4具有冗余的功能[28]。突变体研究发现TDIF-TDR-WOX4信号在拟南芥次生生长过程中的维管分生组织的维持具有重要角色[29]。推测TuWOX2也可能具有类似的功能。
TuWOX3与水稻中亲缘关系最近的是OsWOX9,与拟南芥中AtWOX5、AtWOX7关系较近,属于WUS支/进化支。拟南芥中WUS支除了AtWOX7没有WUS盒外,其他都具有WUS盒,在乌拉尔图小麦中克隆的这6个基因中,TuWOX2、TuWOX3a、TuWOX3属于WUS支,都具有WUS盒。将这6个基因与小麦中已克隆的TaWOX2和TaWOX5比对分析发现,这6个基因与TaWOX2的亲缘关系较远,而TuWOX3与TaWOX5同源性最高,氨基酸序列一致性达98%。TaWOX2主要在种子发育过程中表达,而TaWOX5主要在根和愈伤组织中表达[23],TuWOX3在根和茎中的表达量较高,表明TuWOX3可能具有类似TaWOX5的功能。在拟南芥的发育中,AtWOX5在根尖不活动中心特异表达[5],WOX5与WUS在根干细胞调节中的功能可以互相改变[9];玉米(Zeamays)中根的发育与ZmWOX5基因的表达密切相关。玉米基因组中含有两个WOX5同源基因ZmWOX5A和ZmWOX5B。ZmWOX5B基因在根端静止中心表达,被认为是与拟南芥WOX5基因同源的基因。ZmWOX5B基因最早被发现在原胚维管化的胚柄细胞上层的胚的中部区域表达,而此时,ZmWOX5A基因早已在胚的近轴一侧表达。在胚胎发育的后期,ZmWOX5B基因则集中于根的静止中心处的细胞中表达。本研究克隆的乌拉尔图小麦TuWOX3在根和茎中的表达量较高,说明TuWOX3有可能在这些组织中具有一定的功能。
TuWOX5与水稻中OsWOX11亲缘关系较近,属于中间支。水稻OsWOX11基因在SAM和RAM中表达,它的功能是控制不定根的形成,并主要作为一个生长素和细胞分裂素的响应因子[29]。TuWOX5的主要表达部位是根部,推测TuWOX5可能也起着相似的功能。
TuWOX4与AtWOX13、OsWOX8同属于古老支,推测在功能上可能也有着相似的作用。在拟南芥中,WOX13和WOX14在主根和侧根以及花药中表达,它们具有防止提前分化的功能[20],AtWOX13功能缺失突变体表现出胚座框变小的表型[30]。对TuWOX4的表达模式研究也发现,TuWOX4在根中的表达量相对其他组织较高。
TuWOX3a与OsWOX2亲缘关系最近,与OsWOX3及AtWOX3属于同一个子进化支,OsWOX2基因主要在水稻幼嫩组织中细胞分裂旺盛的区域表达,在发育早期的胚、茎端分生组织和根端分生组织干细胞以外区域、叶原基、茎居间分生组织及幼嫩花器官中均检测到OsWOX2基因mRNA的大量积累,当器官逐渐发育成熟,OsWOX2基因的表达水平则逐渐降低。OsWOX2基因抑制表达影响了水稻植株叶片的形态发生,促进了水稻茎居间分生组织的活动,且抑制了花器官的正常发育过程[29]。OsWOX3在分生组织及叶原基中表达,并且调控叶片的发育,RNAi干扰的植株叶片呈现卷曲表型,OsWOX3超量表达的水稻植株中,叶片变宽[31]。TuWOX3a主要在根及叶中表达,推测TuWOX3a对根与叶片的发育是有一定作用的。
TuWOX1与拟南芥、水稻中所报道的WOX基因亲缘关系较远,推测TuWOX1可能在小麦中功能出现了较大分化,从TuWOX1在不同组织的表达分析中可以看出,TuWOX1在根和叶中表达量较高,而在茎和穗中表达量较低,表明TuWOX1可能在根与叶中发挥了一定的作用,其具体功能需要进一步的研究。
