卡介苗培养滤出液中O-甘露糖基化蛋白的确定和解析
2019-08-21杨淑凤邓国英孙文长
杨淑凤 , 邓国英, 孙文长
(大连医科大学 微生物学教研室, 大连 116044)
结核分枝杆菌(Mycobacteriumtuberculosis,M.tb)所引起的人类结核病是全球性危害严重的传染病之一。WHO结核病报告显示, 2016年全球结核病患者约1040万例, 2016年因结核病死亡人数为167万,列传染病死亡人数首位[1]。在中国共有结核病例89.5万,同年死亡5万[1],因此结核病的防控尤为重要。卡介苗(Bacillus Calmette-Guérin,BCG)作为唯一许可应用的预防结核病的疫苗,在一定程度上能降低儿童播散性结核,如结核性脑炎和粟粒样结核的发病,但不能提供长期免疫,也无法预防成人肺结核的发病[2]。而候选疫苗的保护力与传统卡介苗相比并无差异,因此全面认识卡介苗的抗原性物质和免疫机制非常关键[2]。甘露糖复合物抗原是分枝杆菌细胞壁上一类重要的抗原,包括脂阿拉伯甘露聚糖(lipoarabinomannan,LAM)、荚膜阿拉伯甘露聚糖和甘露糖基化蛋白[3]。其中甘露糖基化蛋白在结核分枝杆菌和耻垢分枝杆菌中均有报道,例如最早确定的结核分枝杆菌甘露糖蛋白为富含丙氨酸脯氨酸的分泌蛋白(alanine/proline-rich secreted protein),即Apa和PstS1[4]。而且各甘露糖蛋白的甘露糖残基连接方式也不尽相同,例如Apa的4个糖基化位点Thr上甘露糖残基连接方式均为ɑ-1,2连接,而同样也是具有4个Thr糖基化位点的Mpb83,则有2个位点上甘露糖残基以ɑ-1,3连接[5]。不同的糖链连接方式也影响与宿主细胞特异受体的识别,Apa能被宿主细胞甘露糖受体(mannose receptors, MR)识别,并参与结核菌的免疫逃逸。而Mpb83不能被MR识别[5]。此外,催化结核分枝杆菌O-甘露糖基化蛋白合成路径中关键酶:蛋白甘露糖基转移酶(protein mannosyl transferase,PMT)Rv1002c本身就是个毒力因子[6]。因此,甘露糖基化蛋白在细菌致病性和宿主细胞相互作用过程中发挥着重要作用。而卡介苗中甘露糖基化蛋白的研究不多,因此本文基于刀豆素凝集素(Concanavalin A,ConA)亲和层析技术和质谱技术开展了O-甘露糖基化蛋白的研究。
1 材料与方法
1.1 细菌和培养条件
使用的BCG为中国普遍使用的疫苗(成都生物制品研究所有限责任公司,国药准字S20013057 ),在7H10固体培养基(含有10%ADC)复苏,挑取单个菌落至5 mL苏通培养基中,37 ℃培养10 d后,转至200 mL苏通培养基,37 ℃静止培养10 d后收获培养滤出液。
1.2 培养滤出液(Culture filter,CF)中蛋白的提取
将细菌培养液通过0.22 μm的滤膜,收获CF。与0.5 g/mL的(NH4)2SO4等体积比混合,4 ℃过夜,10 300 r/min离心0.5 h,收获沉淀,ddH2O重悬。采用10 ku的透析膜放置于PBS中,4 ℃透析3 d除盐。冷冻真空干燥并称重。
1.3 ConA琼脂糖亲和层析获得O-甘露糖基化蛋白
先用预洗缓冲液(1 mol/L NaCl, 5 mmol/L MgCl2,5 mmol/L MnCl2和 5 mmol/L CaCl2)冲洗ConA琼脂糖层析柱(Concanavalin A-SepharoseR4B, Sigma),然后应用平衡缓冲液(20 mmol/L Tris,0.5 mol/L NaCl,pH 7.4)平衡层析柱。CF中的蛋白用ddH2O配成浓度为1 mg/mL,流经层析柱。应用平衡缓冲液冲洗直至洗出液中无蛋白检出。最后应用200 mmol/L甘露糖苷洗脱目的蛋白,收获洗脱液并浓缩。
1.4 O-甘露糖蛋白的确证和解析
利用15%的SDS-PAGE分离收获的目的蛋白,转膜至PVDF膜,封闭液为1.5%的BSA,封闭时间30 min。然后使用1∶ 10 000的生物素标记的ConA(Sigma)室温孵育30 min后,洗膜,再使用1∶ 5000的HRP标记链霉亲和素(Sigma)室温孵育30 min后,洗膜,化学发光显色。同时电泳后的条带银染(ProteoSilverTMPlus,Sigma),显色后将各蛋白条带切下质谱分析。使用的质谱仪器为基质辅助激光飞行时间质谱仪5800 MALDI-TOF/TOF(AB SCIEX)。
1.5 O-甘露糖蛋白的解析
将各蛋白的质谱数据进行解析,并使用在线甘露糖基化位点预测软件(http://www.cbs.dtu.dk/services/NetOGlyc/)NetOGlyc 4.0 Server进行各蛋白的糖基化位点预测解析。
2 结果与分析
2.1 ConA琼脂糖亲和层析洗脱液SDS-PAGE的银染结果
SDS-PAGE分离CF中收获的目的蛋白,并进行银染。结果如图 1箭头所示,共检测到约7个蛋白条带。依据分子量大小标注为条带1~7。
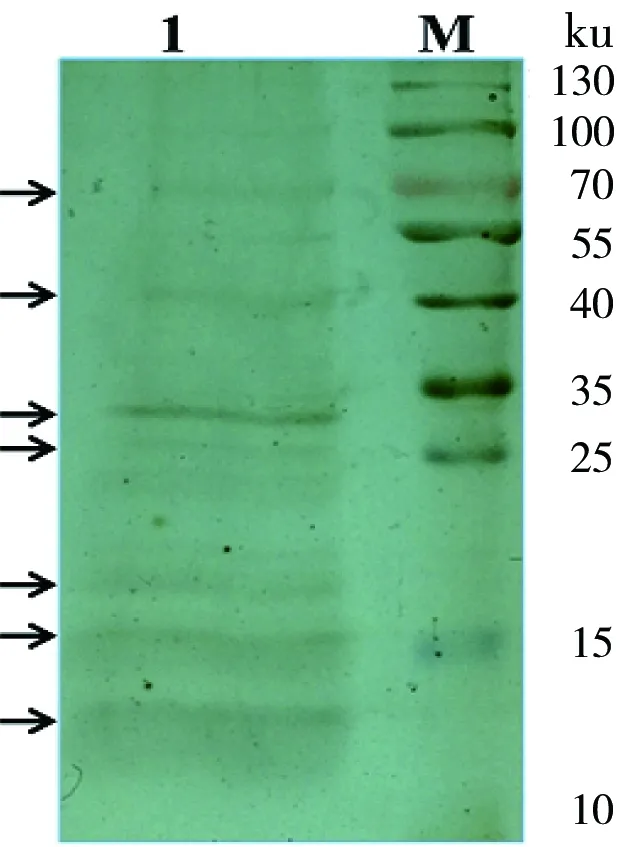
箭头所示为银染显色条带,共检测到约7个条带。染色方法为银染色。1:洗脱液;M:蛋白Marker(Fermentas)
图1ConA琼脂糖亲和层析洗脱液SDS-PAGE结果
Figure 1 SDS-PAGE of CF with Con-A sepharose affinity
2.2 ConA琼脂糖亲和层析洗脱液印记确证结果
洗脱液利用生物素标记的ConA检测。结果如图 2所示,与SDS-PAGE银染一致,糖蛋白条带用箭头显示,条带位置与图 1银染条带的偏差可能是糖型所致。
2.3 O-甘露糖基化蛋白质谱解析和糖基化位点预测结果
将图 1中的1~7条带切下,进行各条带的质谱数据分析,并进行糖基化位点和蛋白功能预测。结果(表1)显示,这7个蛋白均为甘露糖蛋白,具有不同的蛋白功能,糖基化位点多位于Ser和Thr上,位点总数从1个到16个不等。

箭头所示为检测到的糖蛋白条带
图2ConA琼脂糖亲和层析洗脱液Western-blot
Figure 2 Western-blot of CF with Con-A sepharose affinity

表 1 CF中甘露糖化蛋白质谱结果和糖基化位点预测
3 讨论
ConA能特异识别甘露糖,因此广泛用于甘露糖基化蛋白的富集和确证[7]。本研究利用ConA亲和技术富集了卡介苗培养滤出液中的甘露糖蛋白,并用ConA印记实验确证了这些糖蛋白均为甘露糖蛋白(图 1和图 2)。使用SDS-PAGE分离各蛋白,并经过质谱解析了这些糖蛋白。最终确定了BCG培养滤出液中的7种甘露糖蛋白,如表1所示。蛋白条带2就是与Apa同源的BCG中富含丙氨酸/脯氨酸的分泌蛋白。
BCG培养滤出液存在的蛋白多为分泌蛋白,本研究所确定出的7种甘露糖基化蛋白,经预测大多具有酶活性(表1),可能在细菌修复、糖链代谢、呼吸代谢等过程中发挥作用。以Apa为例,结核分枝杆菌Apa可增强T细胞抗原性和诱导产生高水平IFN-γ[8],并且其O甘露糖基化修饰是刺激T淋巴细胞所必需的[9]。BCG中的Apa是否具有相同的功能未知。本次所确定出的这些甘露糖蛋白确切功能还需要具体实验来验证。
本实验结果表明,BCG中甘露糖基化蛋白无论在糖基化位点还是发生糖基化的氨基酸与结核分枝杆菌中的同源的甘露糖基化蛋白并不完全相同。还是以Apa为例,BCG中Apa的甘露糖基化位点预测为8个,也多于结核菌分枝杆菌Apa的4个位点[4]。此外,结核分枝杆菌Apa发生甘露糖基化的氨基酸均为Thr[4],而BCG的Apa发生甘露糖基化的预测氨基酸除了7个Thr外,还有1个为Ser。当然产生如此差异也可能是由于BCG只是软件预测,最终还需具体实验验证。
Geoffrey等借助质谱技术共确证了13种结核分枝杆菌O-甘露糖蛋白[10]。我们从BCG培养滤出液中分离出7种O-甘露糖蛋白,数量少于结核分枝杆菌。一方面与菌种不同有关,另一方面和本研究使用的单向电泳有关。使用双向电泳分离更多的BCG甘露糖基化蛋白,是将来需要开展的工作。
BCG中O-甘露糖基化蛋白的确证有利于BCG免疫机制的认识,从中筛选出重要的糖基化蛋白进行基因水平上的调控,构建甘露糖蛋白表达水平上调的重组BCG,也是改造优化BCG的途径之一。
