N端无半胱氨酸断裂蛋白质内含子的构建
2019-08-21李佳,孟清
李 佳, 孟 清
(东华大学 生物科学与技术研究所,上海 201620)
蛋白质修饰指通过各种化学方法和生物方法对目标蛋白在各种环境中进行操作,以便更好地研究蛋白的结构、生物学功能及蛋白与蛋白之间的相互作用[1-3]。化学手段存在许多不足之处:常用的化学基团会产生混合的标记蛋白;有些对蛋白的浓度和蛋白的侧链性质要求较高,普遍性不强[4];多肽配体、荧光配体、其它小分子配体的非共价标记不稳定,而且多肽蛋白的存在可能会干扰蛋白的功能[5-9];通过蛋白质翻译过程引入一个非自然的氨基酸到目标蛋白上,也可以实现无缝标记,可是这个技术比较复杂,对引入的标签或修饰类型也有较多的限制[10]。
蛋白质内含子(intein)是具有自我催化活性的蛋白质。翻译成熟后,内含子会自我切除,然后将两侧的外显子(extein)以肽键的形式连接起来[11]。而断裂蛋白质内含子(split intein)的N端和C端可以相互识别,形成有活性的蛋白构象,然后发生反式剪接反应(trans-splicing)[12]。在某些情况下,split intein的某一端可以发生断裂反应(cleavage):当N端外显子缺失时,会催化inetin的C端发生断裂,在蛋白的N末端产生一个硫酯键,然后可以利用化学反应添加一个标记物到蛋白质的N末端[13];当C端外显子缺失时,N末端的断裂反应会在N端外显子的C末端产生一个硫酯键[14-15],接下来这个硫酯键可以和半胱氨酸残基或者标记的半胱氨酸残基类似物反应,实现对蛋白的特异性标记[16-18]。
利用断裂蛋白内含子的反式剪接特性对目标蛋白进行标记是一个非常有潜力的生物标记工具,其主要优点有[19-21]:引入较少或者通过突变不引入外源氨基酸;对目标蛋白结构和功能影响较小;功能比较保守,即较小的N端或C端片段依然能够和对应的大片段反应;不用合成多肽,成本较低;应用范围广泛。然而目前仍有许多因素限制该技术的广泛应用:剪接效率不稳定,蛋白质内含子两侧外显子不同就会呈现不同的剪接效率;融合蛋白溶解性不好,经常会产生包涵体等,可能会影响后续蛋白的正确折叠;活性和通用性差,不同的蛋白质内含子在异源宿主中的活性不均一,且只在某些特定条件下才能有较好的剪接活性。因此,发现和构建更多有活性的断裂蛋白质内含子是扩大断裂蛋白质标记应用范围有效可行的方法。
本文在Inbase数据库和实验室获得了几个1位不是Cys的蛋白质内含子作为研究对象,通过定点突变、体内体外断裂、蛋白亲和层析、Western Blot等技术获得了2个体内断裂蛋白质内含子pMHP-S1和pMMD-S11,1个体外断裂蛋白质内含子pMTX-S1(C1/S)。它们都具有较高的剪接活性,可以用于后续蛋白质N端标记和相关应用。
1 材料和方法
1.1 蛋白质内含子的选择和基因序列的获得
根据课题的需要和选择条件,最后选择的蛋白质内含子为TerNdse-2、TerThyX(已经改造成TX-S1)、HaV01 Po1、MsmDnaB-1和Arsp-FB24。其中TX-S1和TerNdse-2为本实验室所有,HaV01 Po1由日本东京大学Shmuel Pietrokovski教授赠送[22],其它蛋白质内含子通过比对后,去除多余外显子、归巢核酸酶内切酶区域及优化密码子后由上海捷瑞生物工程有限公司合成。
1.2 微小蛋白质内含子的构建及剪接活性的检测
通过全基因合成获得MsmDnaB-1和ArspFB24 2个蛋白质内含子的cDNA序列。然后将cDNA序列克隆到pMalI载体内。利用IPTG诱导E.coliBL21表达目的蛋白,然后通过Western Blot检测这些intein的剪接活性。
1.3 N端无半胱氨酸蛋白质内含子的构建及剪接活性的检测
通过检测发现只有TerNdse-2、pMTX-S1和pMHP具有剪接活性。接下来将通过反向PCR或者搭桥PCR的方法对蛋白质内含子内部半胱氨酸进行定点突变。
1.3.1TerNdse-2
TerNdse-2内部两个半胱氨酸相近48个碱基,设计一对反向PCR引物P1和P2(见表1),以pMTerNdse-2为模板进行扩增。
1.3.2 pMTX-S1(C1/S)-CF的构建及剪接活性的检测
pMTX-S1断裂蛋白质内含子有剪接活性,将N端外显子突变为GGS后仍有较高的剪接活性,因此通过反向PCR引物P3和P4将1位的半胱氨酸C突变成丝氨酸S(见表1)。

表1 引物序列
1.3.3MsmDnaB-1和ArspFB24
MsmDnaB-1和ArspFB24的1位都不是半胱氨酸,在全基因合成时,会同时将外显子或非必需的内部半胱氨酸合成为丝氨酸。
1.4 N端无半胱氨酸断裂蛋白质内含子的构建及剪接活性的检测
将pMMD、pMTX和pMHP与微小蛋白质内含子SspDnaB的氨基酸序列进行比对,按照比对结果(图3)确定S1、S0和S11的断裂位置,设计对应的PCR引物进行反向PCR或搭桥PCR,构建对应的体内断裂内含子。
1.5 体外断裂蛋白质内含子的构建和剪接活性的检测
1.5.1 构建断裂蛋白质内含子N端表达质粒
采用AflII和Hind III双酶切法将断裂蛋白质内含子TX-S1和MD-S11的C端DNA序列以及后面硫氧还蛋白对应的DNA序列切除,形成的N端表达质粒只含有麦芽糖结合蛋白和断裂蛋白质内含子的N端部分。
1.5.2 构建断裂蛋白质内含子C端表达质粒
采用NdeI和PstI双酶切法将断裂蛋白质内含子TX-S1和MD-S11的C端以及硫氧还蛋白对应的DNA序列从载体上切下来,然后将片段连入pTWIN表达载体中,得到pTTX-S1C和pTMD-S11C两个前体蛋白表达质粒。
1.6 体外断裂蛋白质内含子的纯化
N端前体蛋白质内含子的纯化:将质粒pMTX-S1N、pMMD-S11N和pMMD-F4N转化到感受态细胞E.coliDH5α内。通过超声破碎释放蛋白到溶液中,然后通过亲和层析纯化N端融合蛋白。C端前体蛋白质内含子的纯化:将质粒pTTX-S1C和pTMD-S11C电击转化到E.coliBL21(DE3)中。通过Ni-NTA纯化C端融合蛋白。所有操作均在冰上,离心温度为4 ℃。最后利用SDS-PAGE凝胶系统检测N端和C端蛋白质的表达和纯化情况。
1.7 断裂蛋白质内含子体外剪接
在体外条件下检测断裂蛋白之间的剪接反应情况。体外剪接条件一般为:N端前体蛋白和C端前体蛋白的摩尔比为1∶ 1,DTT的终浓度为1 mmol/L,25 ℃,反应12~24 h。取20 μL反应后的混合样品做Western Blot检测。
2 结果与分析
2.1 蛋白质内含子的选择
在Inbase数据库,我们选择N端第1位不是Cys,且内部Cys数量较少的intein,筛选结果如表2。
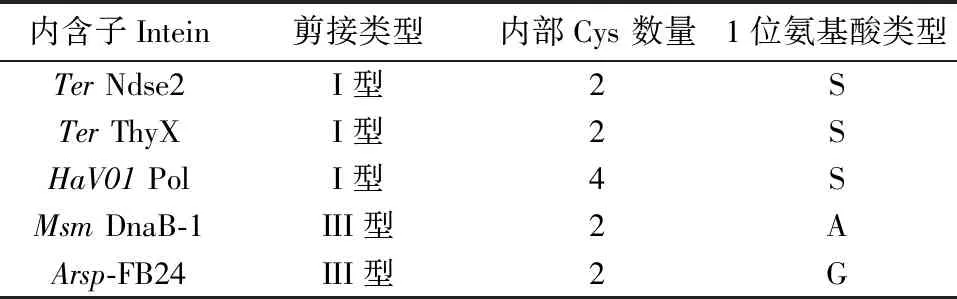
表2 蛋白质内含子基本信息
其中TerNdse-2、TerThyX和HaV01 Pol是I型蛋白质内含子,具有标准的剪接机制。而MsmDnaB-1和ArspFB24为III型蛋白质内含子,它们内部仅有2个半胱氨酸,其中一个是剪接发生所必需的,根据文献报道这些intein也可以在E.coli中表达和剪接[23-25]。
2.2 微小蛋白质内含子的构建及剪接活性的检测
TerNdse2为本实验室所有,已经做过适当的改造,尤其pMTX-S1(C1/S,由TerThyX改造后获得)有较好的剪接活性。蛋白质内含子Arsp-FB24和MsmDnaB-1两侧的外显子不能太多,一般不超过3个氨基酸,同时将Cys替换成Ser。但是F模块的Cys是III型蛋白质内含子剪接所必需的氨基酸之一,因此不能被其他氨基酸替代,如图1所示。Arsp-FB24和MsmDnaB-1全基因合成前,同样对其密码子进行了优化。
MsmDnaB-1、Arsp-FB24为全基因合成,TerNdse2和pMTX-S1为本实验室所有,内含子序列均插入到pMall载体内。构建好的的质粒分别命名为pMMD、pMAF、pMNdse和pMTX-S1(C1/S)。

图1 蛋白质内含子改造后的氨基酸序列
注:红色表示Cys和由Cys突变成的Ser
蛋白质内含子发生剪接后,会将两侧的外显子麦芽糖结合蛋白M和硫氧还蛋白T以肽键的形式连接起来,形成约56 ku的剪接条带MT。然后通过抗硫氧还蛋白抗体检测到含有T的蛋白条带,如图2。
从图2中可以看出,只有pMHP、pMMD和pMTX有较高的体内剪接活性,而pMNdse-2、pMMD-C1F和pMAF没有检测到任何的剪接活性,基本上都是以前体的形式存在。但是本实验室之前的研究发现pMNdse-2在通常的剪接条件下是有剪接活性的,可能由于实验条件和操作或者蛋白质内含子本身剪接条件的敏感性等原因而没有活性。
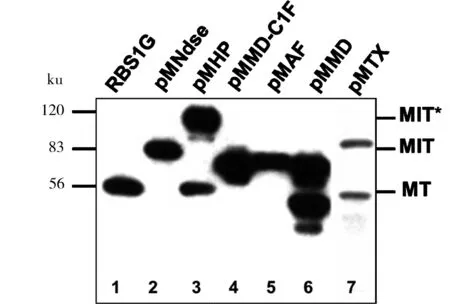
1:pMRBS1G表达剪接的M+T蛋白(55.4 ku);2:pMNdse-2剪接情况;3:pMHP剪接情况;4:pMMD-C1F剪接情况(将内部唯一的半胱氨酸替换成丝氨酸);5:pMAF的剪接情况;6:pMMD的剪接活性;7:pMTX剪接情况。MT:剪接条带;MIT:未发生剪接的前体蛋白;MIT*:未剪接的分枝状前体蛋白
图2原始蛋白质内含子的剪接活性
Figure 2 Splicing activity of different original inteins in vivo, respectively

-:代表空缺,主要是为了优化比对结果;*:表示相同的氨基酸;点号:表示相似的氨基酸;冒号:表示保守的氨基酸;箭头:HaVolPo1、TerThyX和MsmDnaB-1序列中,S1、S0和S11断裂位点;下划线:SspDnaB中的12个β折叠(β 1-12)。其中TerThyX为1N端外显子和1位氨基酸突变后的序列进行比对的
图3HaVolPo1、TerThyX、MsmDnaB和SspDnaB序列比对
Figure 3 Alignment of amino acid sequence ofHaVolPo1,TerThyX,MsmDnaB-1 andSspDnaB
2.3 N端无半胱氨酸体内断裂蛋白质内含子的构建及剪接活性的检测
通过图4看到原始断裂位点S1、S0和S11中只有pMMD-S11和pMTX-S1有剪接活性。接下来我们构建了pMHP(G/T)S1、pMMD-S11和pMTX-S1的体外断裂蛋白质内含子。
2.4 体外断裂蛋白质内含子的构建和剪接活性的检测
2.4.1 前体蛋白质的纯化
将含有蛋白质内含子N端和C端的质粒转入对应的表达菌株内,通过IPTG诱导前体蛋白表达。从图5中可以看到N端前体蛋白和C端前体蛋白纯化效果都比较好,pTTX-S1C纯化的比较少是因为Ni-NTA resin结合特异性不高造成的,但蛋白的浓度已经达到体外剪接所需要的浓度。pMHP-S1N纯化效果也很好(结果未显示),但是却纯化不到其C端前体蛋白pTHP-S1C,后续可能会优化表达条件或者换取其他高表达载体尝试一下。
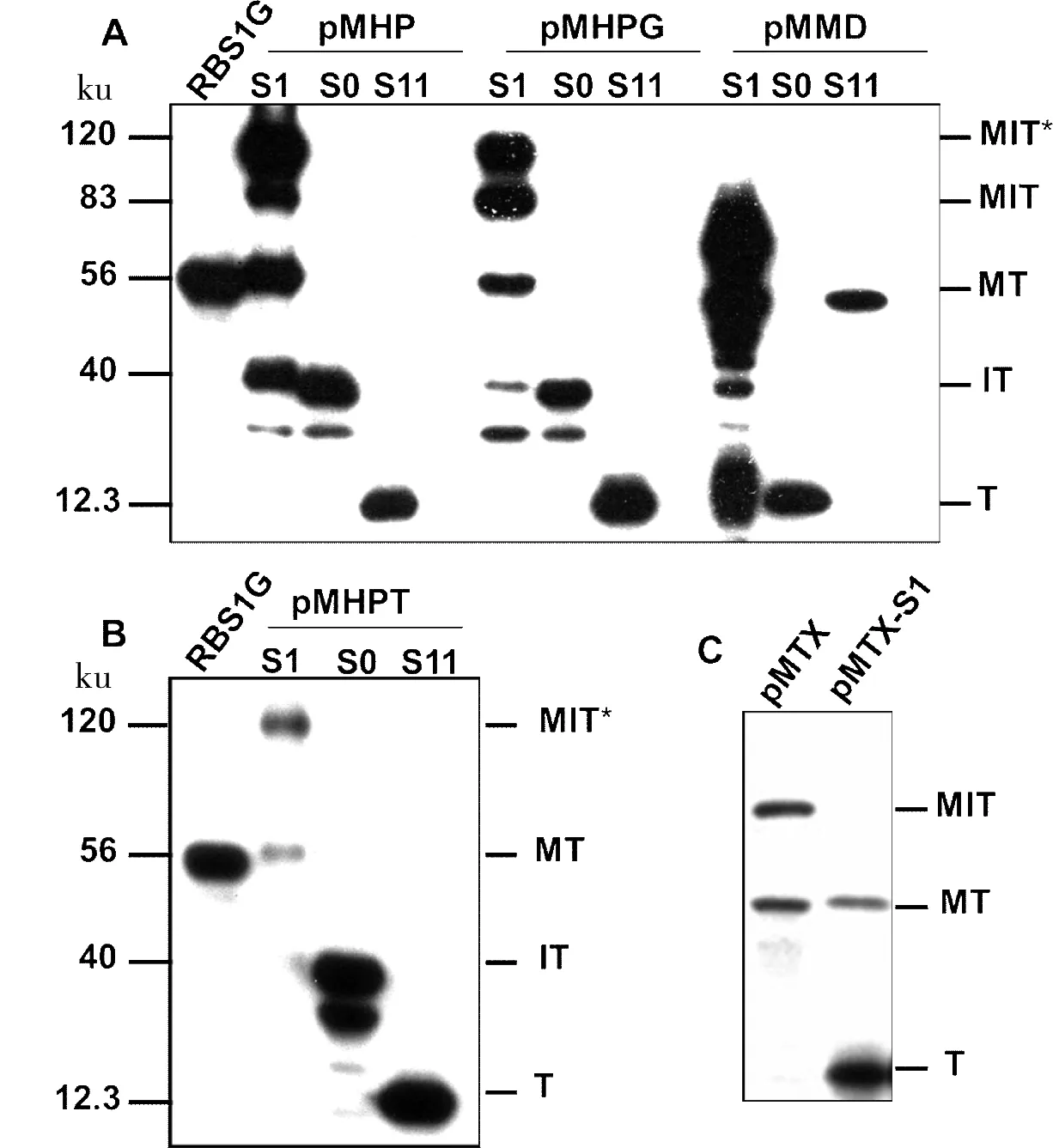
RBS1G:MT阳性对照;MT:剪接产物MT;MIT:未发生剪接的前体蛋白质;MIT*:未发生剪接的分支状中间体;IT:发生N端断裂的产物;T:发生C端断裂的产物
图4pMHP、pMHPG、pMMD、pMHPT和pMTX-S1在
位点S1、S0和S11剪接活性的检测
Figure 4Tans-splicing activity of pMHP, pMHPG, pMMD, pMHPT and pMTXS1 at S1, S0 and S11 sites, respectively
2.4.2 断裂蛋白质内含子的体外剪接反应
将目标intein的前体蛋白按照体外剪接反应条件混合均匀,置于25 ℃常温下反应12 h,取反应后混合样品20 μL,加入适量的上样缓冲液,然后通过Western Blot 检测体外剪接活性,结果如图6。TX-S1在体外条件下仍然有较高的剪接活性,而Msm-S11却没有任何剪接活性。
3 讨论
利用断裂蛋白质内含子对目标蛋白进行N端、C端和特异性位点标记在研究目标蛋白结构和功能等方面得到了越来越多的应用[26-28]。但是天然可利用的断裂蛋白质内含子和1位不是半胱氨酸的蛋白质内含子都非常少。这严重限制了蛋白质内含子对目标蛋白N端标记的应用。本文通过数据数据库筛选、定点突变等技术得到了HaV01 Pol、MsmDnaB-1和TX-S1 3个体内有活性的蛋白质内含子,其他蛋白质内含子没有活性或活性太低。原因可能是原始剪接效率不是很高或改造过程中删除了部分序列,使剩余的结构不能形成正确的折叠构象从而阻碍了剪接活动的发生。
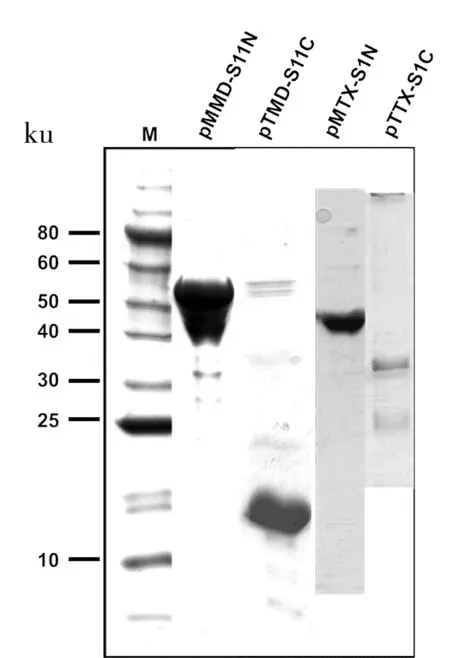
图5 pMMD-S11N/pTMD-S11C/pMTX-S1N/pTTX-S1C蛋白纯化
蛋白质内含子体外断裂位点的选择并没有统一的标准,主要是由intein的结构和性质等多种因素造成的。另外,由于intein对外显子的同源要求较高,即使高剪接活性的断裂蛋白质内含子,在不同的外源宿主中的剪接活性也有较大的差异。目前断裂位点的选择主要是和人工断裂蛋白质内含子Ssp DnaB等比对后获得的。但是因为intein的起源不同,比对结果很多时候氨基酸同源性很低。本文成功获得了TX-S1(C1/S)N端无半胱氨酸的断裂蛋白质内含子,且N端外显子为GGS,增加了该内含子的通用性和广泛性。我们仍希望在HaV01 Pol中寻找多个有活性的断裂位点,同时对MsmDnaB-1做更多的分析和研究,探索III型断裂蛋白质内含子在蛋白标记中的应用。
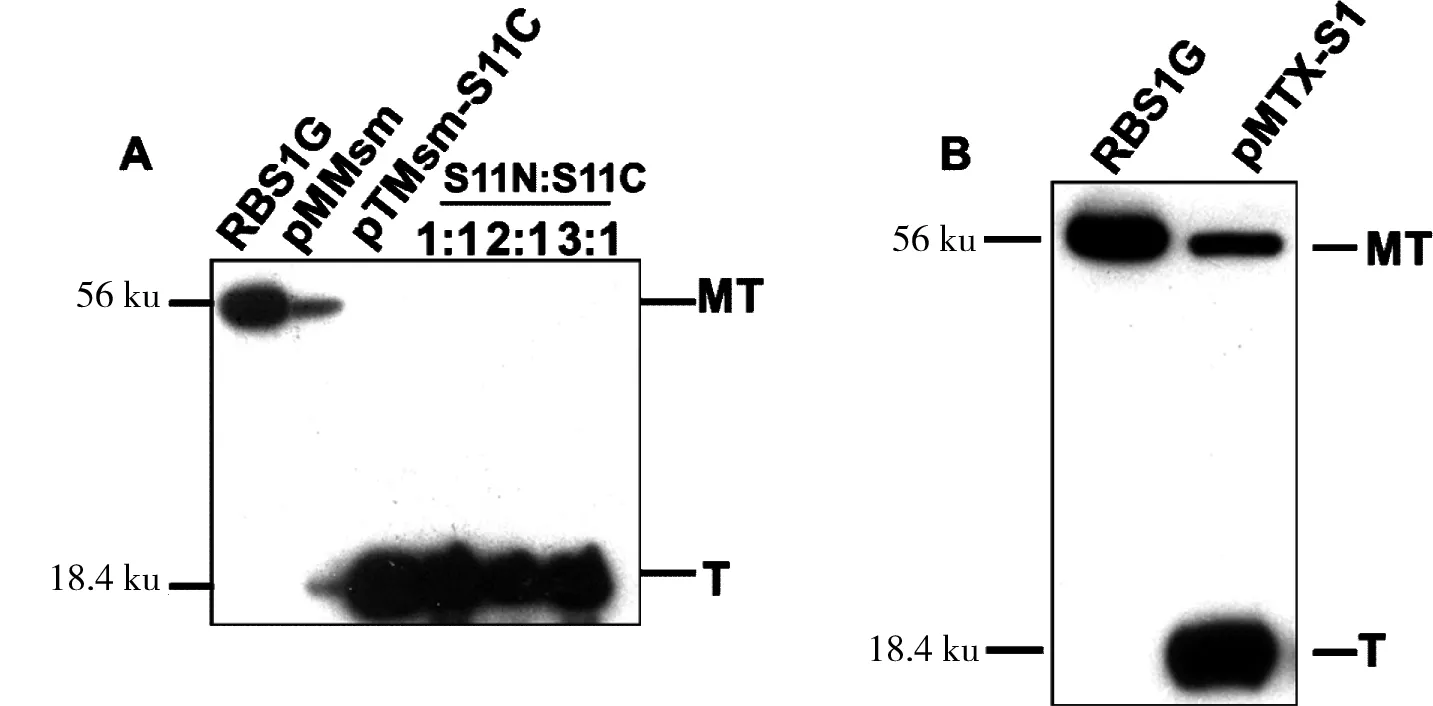
A:pMMsm-S11N和pTTX-S11C在体外没有剪接活性,几乎全部都是C末端断裂;B:pMTX-S1N和pTTX-S1C在体外条件下可以发生体外剪接反应,但是会有部分C端断裂的发生,不过这些并不影响后续标记的应用
图6Msm-S11和TX-S1断裂蛋白质内含子体外剪接
Figure 6Trans-splcing activity of Msm-S11 和TX-S1 in vitro
接下来,我们将纯化TX-S1(C1/S)N端蛋白,用半胱氨酸染料标记N端,然后和TX-S1C-T在体外进行剪接反应,用SDS-PAGE、Western Blot、荧光扫描仪等检测剪接和标记效果。同时对TX-S1(C1/S)体外剪接条件如温度、DTT浓度和尿素浓度等进行优化,扩大其对不同蛋白的适应能力。另外,其还可以应用到蛋白结晶、蛋白纯化和蛋白连接等方面。因此我们的研究为蛋白质N端标记提供了一个高剪接效率的N端无半胱氨酸断裂蛋白质内含子,或潜在的断裂蛋白质内含子。这将进一步扩大了断裂蛋白质内含子在化学生物学和生物技术中的应用。
