玉米蛋白水解物对大豆油水包油乳状液物理化学稳定性及体外消化的影响
2019-08-20张文丽令狐义李婷王思齐孙慧妍李寒璐伍娟程宇
张文丽 令狐义 李婷 王思齐 孙慧妍 李寒璐 伍娟 程宇


摘要:以D500 nm和TBARS为指标分别考察玉米蛋白水解物对吐温20-壳聚糖双层膜O/W乳状液在4、25、 37 ℃ 下贮藏7 d过程中物理和氧化稳定性的影响。以脂肪酸的释放量为指标,通过静态胃-肠消化和动态胃-肠消化体外模拟模型考察玉米蛋白水解物对吐温20-壳聚糖双层膜乳状液脂肪消化的影响。结果表明,尽管玉米蛋白水解物(2.5~10.0 mg/mL)降低了乳状液的物理稳定性,但是并未降低乳状液的氧化稳定性。玉米蛋白水解物促进了乳状液中脂肪的消化,乳状液中脂肪在动态胃-肠消化模型中的消化速率和程度低于在静态胃-肠消化模型中。说明玉米蛋白水解物可以改善乳状液中脂肪的氧化和消化。
关键词:玉米蛋白水解物;乳状液;稳定性;体外消化
中图分类号: TS201.7文献标志码: A
文章编号:1002-1302(2019)09-0234-05
玉米蛋白由于含有醇溶蛋白和谷蛋白水溶性较差,限制了其在食品工业中的应用。通过酶解制备玉米蛋白水解物是改善玉米蛋白溶解度、提高其在食品工业中应用价值的有效手段。酶水解不仅提高了玉米蛋白的溶解度,还提高了玉米蛋白的生物活性。酶水解得到的玉米蛋白水解物具有抗氧化[1-3]、抑制血管紧张素转化酶(ACE)活性[4-6]及抑制糖苷酶活性[7]。目前,较多的研究关注玉米蛋白酶解效率提高[8-10]以及活性多肽的制备工艺[6,11-13],而将玉米蛋白水解物用于改善食品品质的研究则不多。王晶等将玉米蛋白水解物加入到肉糜中,提高了肉糜中脂肪的氧化稳定性[14-16]。石丽梅等将玉米蛋白水解物加入到中式香肠中起到了较好的抗氧化作用[17]。可见,玉米蛋白水解物可用于提高食品中脂肪的氧化稳定性。乳状液是食品中油脂存在的主要形式之一,然而将玉米蛋白水解物用于乳状液的研究还较少。前期研究表明,将蛋白水解物用于食品乳状液体系时可以抑制乳状液脂肪的氧化[18]。同时,Klinkesorn等的研究表明,利用静电吸附作用制备的小分子乳化剂和壳聚糖组成的多层膜乳状液不仅可以改善乳状液的物理化学稳定性,还可以影响乳状液中脂肪的消化[19-20]。因此,本研究拟考察玉米蛋白水解物对吐温20和壳聚糖制备的双层膜乳状液物理稳定性、氧化稳定性及脂肪消化的影响,为基于乳状液体系的食品设计和抗氧化肽的应用提供新的思路。
1 材料与方法
1.1 试验材料与仪器
玉米醇溶蛋白,购自高郵市日星药用辅料有限公司,蛋白含量为95%;碱性蛋白酶(Alcalase)2.4 L FG(2.4AU),购自诺维信生物技术有限公司;福临门大豆油,当地超市购买;胃蛋白酶(pespin,1 200 U/g)、脂肪酶(lipase,3 000 U/g)、猪胆盐、壳聚糖,均购自上海国药集团股份有限公司;其他试剂为分析纯;试验用水为纯水,自制。
pH计,购自梅特勒-托利多仪器(上海)有限公司;WCR-8 加热制冷循环器、HG15A高速乳化均质机,购自大韩科学株式会社;TDL-5-A离心机,购自上海安亭科学仪器厂;冷冻干燥机,购自德国Marin Christ公司;AH-basic型高压均质机,购自ATS工业系统有限公司;UV-2800型紫外可见光分光光度计,购自尤尼柯(上海)仪器有限公司。
1.2 试验方法
1.2.1 玉米蛋白水解物的制备
参照Kong等的方法[1],在50 ℃和pH值为9.0的条件下将玉米蛋白制成30 g/L悬浊液后,用碱性蛋白酶水解4 h,酶底比2%,酶解结束后调pH值至7.0并迅速沸水灭酶10 min,冷却后离心(20 ℃、5 000 r/min 离心20 min),取上清液冷冻干燥得到玉米蛋白水解物。
1.2.2 乳状液的制备
称取一定量吐温20溶于醋酸缓冲液(100 mmol/L、pH值为3)中制成吐温20浓度为11.25%水相溶液。将大豆油和吐温20(1.125%)溶液以一定质量比(10 ∶90)混合后,于20 ℃下用高速分散机在 21 600 r/min 下乳化2 min,再用高压均质机将乳状液在 30 MPa 下均质2次,得到乳状液。在上述乳状液加入一定量壳聚糖搅拌 30 min 使其充分溶解,制成壳聚糖浓度0.1%的乳状液。之后称取一定量的玉米蛋白水解物加入上述乳状液中搅拌 30 min 使其充分溶解,得到含不同浓度(0、2.5、10.0 mg/mL)玉米蛋白溶解度的乳状液用于后续研究。乳状液中加入0.02%山梨酸钾作为防腐剂。
1.2.3 乳状液物理稳定性的测定
乳状液的稳定性用浊度法[21]进行分析。将制备好的乳状液迅速倒入30 mL小玻璃瓶中,在离瓶底2 cm处取30 L乳状液于试管中,在试管中加入10 mL SDS溶液1 mg/mL,混匀后测定吸光度D500 nm,用D500 nm表示浊度,在不同温度(4、25、37 ℃)下测定不同样品的浊度变化。
1.2.4 乳状液氧化稳定性的测定
在氧气充足条件下,将乳状液分装在30 mL带盖的棕色玻璃瓶中,然后在不同温度(4、25、37 ℃)下进行氧化,测定储藏周期(7 d)内乳状液的丙二醛反应物(TBARS)含量。TBARS含量的测定参考Mei等的方法[22]。以1,1,3,3-四乙氧基丙烷作标准曲线,确定样品中的TBARS含量。
1.2.5 乳状液的静态模型消化
参考Li等的方法[23],并在此基础上进行修改。取12 g乳状液在37 ℃条件下保温 5 min 后向其加入等质量模拟口腔液[称取0.159 4 g NaCl、0.020 2 g KCl溶于100 mL磷酸盐缓冲液(10 mmol/L、 pH值7.0),调节pH值至6.8],在37 ℃及磁力搅拌(95 r/min)条件下反应5 min。向反应后的乳状液加入24 g模拟胃液[称取0.32 g胃蛋白酶、0.020 g NaCl溶于100 mL磷酸盐缓冲液(10 mmol/L、pH值2.5)],并使其在37 ℃、pH值2.5及磁力搅拌(95 r/min)条件下反应2 h,然后用1 mol/L NaOH溶液调pH值7.0并静置5 min。向上述乳状液中加入等量(48 g)模拟小肠液[由4 g胆汁盐溶液(0.375 g胆盐和10 mmol/L pH值7.0磷酸盐缓冲液组成)、2.5 g新制备的脂肪酶悬液(0.134 g脂肪酶和10 mmol/L pH值7.0磷酸盐缓冲液组成)以及41.5 g 10 mmol/L pH值7.0磷酸盐缓冲液组成],后迅速用0.1 mol/L NaOH溶液进行恒pH值滴定,37 ℃磁力搅拌(95 r/min)条件下反应2 h并保持pH值7.0,记录反应过程中消耗NaOH溶液的体积。
1.2.6 乳状液的動态模型消化
参考Shani-Levi等的方法[24-25],并在此基础上进行修改。在15 g乳状液中加入 0.5 g pH值2.0的胃液[含有0.43 g胃蛋白酶、0.067 g脂肪酶、0.07 g胃电解液(含4.8 g/L NaCl、12.2 g/L KCl、0.3 g/L CaCl2、1.25 g/L NaHCO3)]后以0.025 mL/min速率分别滴加模拟胃液(5 mL pH值2.0的胃电解液中加入4.3 g胃蛋白酶和0.066 7 g脂肪酶)和胃酸(1 mol/L HCl)120 min,反应结束后操作同“1.2.5”节。
1.2.7 乳状液中游离脂肪酸释放量
参考Li等的方法[26]计算消化过程中脂肪酸的脂肪量。游离脂肪酸(FFA)释放比例计算公式如下:
FFA比例=VNaOH×mNaOH×MLipidwlipid×2×100%。
式中:V为消耗NaOH的体积,L;m为NaOH的摩尔浓度,mol/L;w为消化体系中三酰基甘油的总质量,g;M为三酰基甘油的平均分子质量,g/mol,大豆油为876.56 g/mol。
1.3 数据处理与分析
试验至少进行2次重复(n≥2)。单次重复试验在不同时间进行,并设置3次平行。试验数据的差异性通过SPSS 17.0软件进行方差分析,数据差异性的分析方法为LSD法,显著差异用P<0.05表示。
2 结果与分析
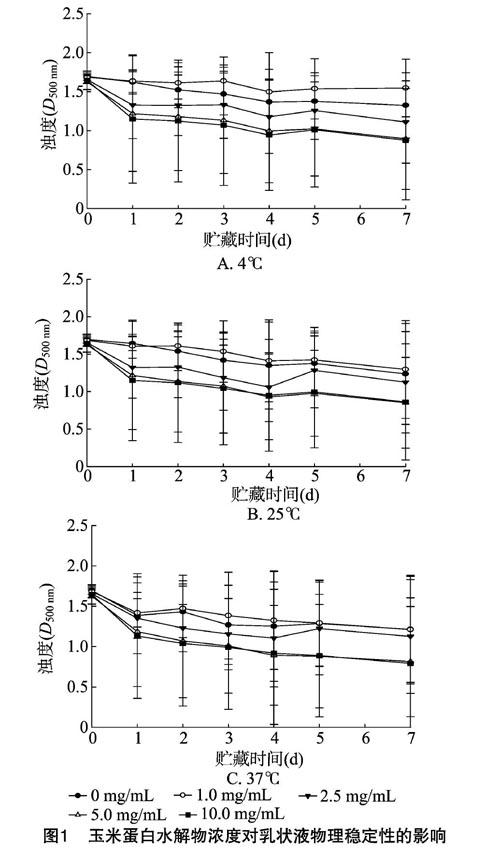
2.1 玉米蛋白水解物对乳状液的物理稳定性的影响
研究结果(图1)表明,不同组成乳状液在不同储藏温度下随着储藏时间的增加都呈现浊度下降的趋势,并且随着储藏温度增加乳状液浊度下降的程度越大。这是由于乳状液是热力学不稳定体系,乳化脂肪颗粒会不断上浮使容器底部乳化脂肪颗粒的含量下降,而浊度与乳化脂肪颗粒的含量成正相关关系[21],因而浊度不断下降。温度的升高加速了乳化脂肪颗粒的运动速度,导致在37 ℃时浊度下降较快。玉米蛋白水解物浓度在1.0 mg/mL时,乳状液浊度在储藏过程中的下降程度要低于未添加玉米蛋白水解物的对照样品。在贮藏后5 d 时,4、25、37 ℃储藏条件下对照样品浊度下降程度分别是添加了1.0 mg/mL玉米蛋白水解物乳状液的2.13、1.21、1.03 倍,表明玉米蛋白水解物浓度为1.0 mg/mL时,玉米蛋白水解物的加入增加了乳状液的稳定性。但是当增加玉米蛋
白水解物浓度时,乳状液浊度下降程度高于对照样品,表明玉米蛋白水解物浓度在2.5~10.0 mg/mL时其加入导致了乳状液稳定性下降。
2.2 玉米蛋白水解物对于乳状液氧化稳定性的影响
试验结果(图2)表明,低温储藏过程中脂肪氧化较慢,而提高储藏温度会显著提高脂肪氧化的程度,这是因为温度的升高会提高化学反应的速率。在4 ℃储藏条件下,对比0 d和7 d不同样品的氧化稳定性,只有添加了10.0 mg/mL玉米蛋白水解物的乳状液脂肪氧化产物TBARS的量有显著提高(P<0.05),贮藏后7 d TBARS的生成量的为贮藏当天的4.41倍。在25 ℃储藏条件下,对比贮藏当天和贮藏后7 d不同样品的氧化稳定性,吐温20制备乳状液以及添加0、2.5、10.0 mg/mL 玉米蛋白水解物的乳状液中TBARS的生成量分别提高2.55、6.07、2.31、3.17 倍(P<0.05)。尽管贮藏后 7 d 时吐温20制备乳状液与添加不同浓度玉米蛋白水解物的乳状液中TBARS的生成量没有显著差异,但是添加不同浓度玉米蛋白水解物的乳状液中TBARS的生成量之间有显著性差异(P<0.05),添加了2.5、10.0 mg/mL玉米蛋白水解物的乳状液中TBARS的生成量和未添加玉米蛋白水解物乳状液相比分别降低35.5%、72.8%。在37 ℃储藏条件下,对比贮藏当天和贮藏后7 d不同样品的氧化稳定性,吐温20制备乳状液以及添加0、2.5、10.0 mg/mL 玉米蛋白水解物的乳状液中TBARS的生成量分别提高4.39、3.39、2.28、4.50倍(P<0.05)。贮藏后7 d时添加0、2.5、10.0 mg/mL玉米蛋白水解物的乳状液中TBARS的生成量比吐温20制备乳状液分别下降78.6%、51.8%和45.0%(P<0.05)。但是添加0、2.5、10.0 mg/mL玉米蛋白水解物的乳状液中TBARS的生成量之间并无显著性差异。以上研究表明,壳聚糖和玉米蛋白水解物加入制备的多层乳状液的氧化稳定性要高于吐温20制备的单层膜乳状液。玉米蛋白水解物的加入并不会降低吐温20-壳聚糖制备的双层膜乳状液的氧化稳定性。
2.3 玉米蛋白水解物对乳状液脂肪消化程度的影响
2.3.1 乳状液在静态胃-肠消化模型中脂肪的消化 静态模型是体外消化模型中使用得最多的模拟消化模型。不同浓度玉米蛋白水解物对吐温-壳聚糖双层膜乳状液中脂肪消化影响的结果如图3所示。从图3可以看出,玉米蛋白水解物的加入增加了乳状液中脂肪的释放速率和释放量,并且脂肪释放速率和释放量随着玉米蛋白水解物浓度的增加而提高。在0~5 min肠消化过程,添加了10.0 mg/mL玉米蛋白水解物的乳状液中脂肪酸的平均释放速率是对照样品的1.71倍。消化结束时,添加了10.0 mg/mL玉米蛋白水解物的乳状液中脂肪酸的释放量是对照样品的1.58倍。表明乳状液的消化在20 min时基本上就已完成,并且脂肪消化速率随着时间不断下降。这是由于脂肪消化产生的脂肪酸自身具有一定表面活性,可以吸附在脂肪表面。同时,肠环境呈中性,消化释放的脂肪酸会发生皂化生成表面活性比脂肪酸更强的脂肪酸盐,与胆酸盐竞争吸附在脂肪表面,从而阻止脂肪酶与底物的作用。
2.3.2 乳状液在动态胃-肠消化模型中脂肪的消化
尽管静态模型是常用的消化模型,但是静态模型未考虑胃消化过程中pH值的变化,而实际人体消化过程中pH值是随着胃酸的分泌逐渐下降的。因此,本研究引入动态胃消化过程以一定速率动态向乳状液样品中添加胃酸来调节pH值变化,结果如图4所示。从图4可以看出,和静态模型pH值恒定在pH值为2不同,乳状液的pH值随着胃酸的分泌不断下降,并且玉米蛋白水解物的加入减缓了pH值下降的速率。添加了 10.0 mg/mL 玉米蛋白水解物的乳状液在消化进行了 40 min 左右时,pH值才降到pH值2左右。这可能是玉米蛋白水解物及其消化产物与壳聚糖之间通过静电吸附作用形成一定的缓冲体系,从而消耗了氢离子使水相中游离氢离子浓度升高较慢,pH值下降变缓。
经过胃动态模型消化后的乳状液进行肠消化阶段后脂肪酸的释放结果如图5所示。和静态胃-肠消化时结果相似,玉米蛋白水解物的加入同样增加了脂肪酸的释放速率。在 0~5 min肠消化过程,添加了10.0 mg/mL玉米蛋白水解物的乳狀液中脂肪酸的平均释放速率是未添加玉米蛋白水解物对照样品的1.41倍,低于静态胃-肠消化时速率的提高倍数。乳状液的消化在30 min时基本上完成,时间上也比静态胃-肠消化时多。对比添加0、2.5、10.0 mg/mL玉米蛋白水解物的乳状液在动态胃-肠消化和静态胃-肠消化最终脂肪酸的释放量,前者分别是后者的86.4%、79.7%、65.4%。这些数据都表明乳状液在动态胃-肠消化和静态胃-肠消化模型中有不同的消化结果。
3 讨论与结论
根据Mun等的研究结果可知,壳聚糖的加入使乳状液的表面电位变为正值,从而使乳状液的稳定性提高[27]。而玉米蛋白水解物在试验条件下(pH值约为3)所带电荷为负电,因而玉米蛋白水解物的加入可能会改变乳状液的表面电位,使乳状液的物理稳定性发生变化。本研究结果表明,玉米蛋白水解物添加量为1.0 mg/mL时,吐温20-壳聚糖双层膜乳状液的稳定性并不会下降;而提高乳状液中玉米蛋白水解物浓度到2.5~10.0 mg/mL时,玉米蛋白水解物的加入降低了乳状液的稳定性。这可能是由于玉米蛋白浓度较高时,静电吸附作用使壳聚糖表面的部分正电荷被玉米蛋白水解物的负电荷平衡,导致乳状液表面电位下降,减弱了乳化颗粒间的静电排斥作用,使小颗粒聚集成大颗粒的概率增加,大颗粒相对小颗粒易于上浮,从而降低了乳状液的稳定性。
尽管Mun等的研究表明,在吐温20制备的乳状液中加入壳聚糖可以提高乳状液的物理稳定性[27],但是壳聚糖的加入是否提高了乳状液的氧化稳定性则未报道。本研究结果表明,壳聚糖的加入可以提高吐温20为乳化剂制备乳状液的氧化稳定性,这与Klinkesorn等在卵磷脂制备的乳状液中加入壳聚糖可以提高乳状液的氧化稳定性的研究结果[19]一致。壳聚糖在乳状液表面的正电对金属离子的排斥作用被认为是壳聚糖提高乳状液氧化性的机制之一。尽管带负电玉米蛋白水解物可能会由于静电吸附作用降低乳状液表面的正电位,但是玉米蛋白水解物已经被证实有较好的抗氧化活性[1-3]。因此玉米蛋白水解物的加入可能可以通过其自由基清除能力来辅助抑制乳状液中脂肪的氧化。这使得玉米蛋白水解物的添加不会降低吐温20-壳聚糖双层膜乳状液的氧化稳定性。
乳状液是食品中脂肪存在的形式之一。由于乳状液是热力学不稳定体系,因而稳定性是其重要的性质。而乳化脂肪由于比纯油脂体系具有更多的表面积,脂肪更易氧化,因而氧化稳定性也是乳状液的重要性质,但是这2个性质都是乳状液的货架期性质。在食品设计和开发时,在保证货架期性质的前提下,考虑营养素在体内的释放而非单纯考虑营养素比例,则可以获得营养品质更好的产品。随着近年来人们对食品营养品质的关注[28-29],乳状液中脂肪进入体内经消化后脂肪酸的释放受到了研究人员的关注。前面的结果表明,玉米蛋白水解物的加入可以改变吐温20-壳聚糖双层膜乳状液的物理和氧化稳定性,因此本研究接着通过静态胃-肠消化和动态胃- 肠消化模型对上述乳状液中脂肪消化进行了分析。玉米蛋白水解物的添加增加了吐温20-壳聚糖双层膜乳状液在消化过程中脂肪酸的释放量和释放速率。乳状液在动态 胃- 肠消化模型中脂肪酸的释放量和释放速率低于静态 胃- 肠消化模型。尽管动态胃-肠消化模型由于有pH值变化过程,消化酶的活性以及体系中各物质之间的作用都在不断变化,使消化过程更加复杂,但是其更接近实际人体消化的情况,因此应该须要进一步研究。
本研究结果表明,玉米蛋白水解物可以改善食品乳状液的物理化学稳定性和影响乳状液中脂肪的消化[30],显示了玉米蛋白水解物在改善食品品质中的应用前景。
参考文献:
[1]Kong B H,Xiong Y L. Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J]. Journal of Agricultural and Food Chemistry,2006,54(16):6059-6068.
[2]代衍峰,何志勇,陈 洁,等. 抗氧化性玉米肽的分离纯化及其性质[J]. 食品与机械,2008,24(5):5-8.
[3]李媛媛,孙方达,刘 骞,等. 水解度对玉米蛋白水解物抗氧化性和乳化性影响的研究[J]. 食品工业,2016,37(8):201-207.
[4]刘 萍,陈黎斌,杨严俊. 酶解玉米蛋白制备降血压肽的研究[J]. 食品工业科技,2006,27(5):117-119,122.
[5]朱丽娟,熊幼翎,唐学燕,等. 玉米醇溶蛋白抗氧化肽耐消化性研究[J]. 食品工业科技,2008,29(12):61-64.
[6]王晓杰,丛万锁,刘晓兰,等. 玉米ACE抑制肽的制备工艺及中试生产[J]. 食品与发酵工业,2016,42(7):158-164.
[7]胡宇航,戴 军,陈尚卫,等. 玉米降血糖活性肽制备分离及其氨基酸序列分析[J]. 食品与机械,2017,33(6):147-152.
[8]王 凯,马海乐,张艳艳,等. 聚能式逆流脉冲超声预处理对玉米蛋白酶解的影响[J]. 中国农业科技导报,2015,17(5):127-133,161.
[9]金 建,马海乐,曲文娟,等. 超声预处理对玉米蛋白可酶解性的影响[J]. 中国粮油学报,2015,30(11):58-64.
[10]王晓杰,刘晓兰,丛万锁,等. 原料热处理对玉米醇溶蛋白结构性质和酶解效率的影响[J]. 现代食品科技,2015,31(11):170-176.
[11]金杜欣,刘晓兰,郑喜群. Alcalase和Flavourzyme协同修饰玉米蛋白制备抗氧化活性蛋白水解物[J]. 食品与机械,2015,31(2):25-31.
[12]胡二坤,郭兴凤,吴欣欣,等. 中性蛋白酶水解条件对玉米蛋白酶水解产物抗氧化活性影响研究[J]. 粮食与油脂,2015,28(5):51-54.
[13]彭 楠,刘晓兰,郑喜群. 酶底比对玉米蛋白水解物抗氧化活性的影响[J]. 食品科技,2015,40(7):226-232.
[14]王 晶,孔保华,熊幼翎,等. 玉米蛋白酶水解物对生肉糜脂肪氧化的抑制研究[J]. 中国粮油学报,2009,24(2):63-66.
[15]王 晶,孔保华. 玉米蛋白抗氧化肽的制备及其在熟肉糜中的应用[J]. 肉类研究,2009,31(11):42-47.
[16]许瑞雪,刘晓兰. 玉米蛋白水解物对生鸡肉糜脂质氧化的影响[J]. 中国调味品,2016,41(8):5-10,16.
[17]石丽梅,唐学燕,何志勇,等. 玉米抗氧化肽对于中式香肠的氧化稳定性的影响[J]. 食品科技,2008,33(10):135-139.
[18]程 宇,陈 洁,马海乐,等. 不同蛋白水解物在大豆油水包油乳状液中的抗氧化作用[J]. 食品工业科技,2012,33(16):108-110.
[19]Klinkesorn U,Sophanodora P,Chinachoti P,et al. Increasing the oxidative stability of liquid and dried tuna oil-in-water emulsions with electrostatic layer-by-layer deposition technology[J]. Journal of Agricultural and Food Chemistry,2005,53(11):4561-4566.
[20]Klinkesorn U,McClements D J. Influence of chitosan on stability and lipase digestibility of lecithin-stabilized tuna oil-in-water emulsions[J]. Food Chemistry,2009,114(4):1308-1315.
[21]Pearce K N,Kinsella J E. Emulsifying properties of proteins:evaluation of a turbidimetric technique[J]. Journal of Agricultural and Food Chemistry,1978,26(3):716-723.
[22]Mei L Y,McClements D J,Wu J N,et al. Iron-catalyzed lipid oxidation in emulsion as affected by surfactant,pH and NaCl[J]. Food Chemistry,1998,61(3):307-312.
[23]Li J,Ye A,Lee S J,et al. Influence of gastric digestive reaction on subsequent in vitro intestinal digestion of sodium caseinate-stabilized emulsions[J]. Food and Function,2012,3(3):320-326.
[24]Shani-Levi C,Levi-Tal S,Lesmes U. Comparative performance of milk proteins and their emulsions under dynamic in vitro adult and infant gastric digestion[J]. Food Hydrocolloids,2013,32(2):349-357.
[25]Nimalaratne C,Savard P,Gauthier S F,et al. Bioaccessibility and digestive stability of carotenoids in cooked eggs studied using a dynamic in vitro gastrointestinal model[J]. Journal of Agricultural and Food Chemistry,2015,63(11):2956-2962.
[26]Li Y,McClements D J. New mathematical model for interpreting pH-stat digestion profiles:impact of lipid droplet characteristics on in vitro digestibility[J]. Journal of Agricultural and Food Chemistry,2010,58(13):8085-8092.
[27]Mun S,Decker E A,McClements D J. Influence of droplet characteristics on the formation of oil-in-water emulsions stabilized by surfactant-chitosan layers[J]. Langmuir,2005,21(14):6228-6234.
[28]穆蘭海,母养秀,常克勤,等. 不同皮燕麦品种蛋白质含量与营养指标及农艺性状的相关性分析[J]. 江苏农业科学,2017,45(22):86-88.
[29]梁克红,朱大洲,孙君茂,等. 品种与产地因素对花生营养品质的影响[J]. 江苏农业科学,2017,45(17):73-76.
[30]Golding M,Wooster T J. The influence of emulsion structure and stability on lipid digestion[J]. Current Opinion in Colloid & Interface Science,2010,15(1/2):90-101.
