H5、H7、H9亚型禽流感病毒三重RT-PCR检测方法的建立
2019-08-20赵冬敏吴青赵翰飞刘青涛杨婧黄欣梅刘宇卓韩凯凯毕可然李银
赵冬敏 吴青 赵翰飞 刘青涛 杨婧 黄欣梅 刘宇卓 韩凯凯 毕可然 李银

摘要:根据GenBank中H5、H7、H9亚型禽流感病毒血凝素蛋白(HA)编码基因,使用DNAStar软件比较分析筛选出特异的保守片段,设计3对引物H5-P1/H5-P2、H7-P3/P4和H9-P5/P6。在此基础上,建立了H5、H7、H9亚型禽流感的三重RT-PCR检测方法,本方法可同时检测出样品中的H5、H7、H9亚型禽流感病毒。敏感性试验结果表明,该方法检测H5、H7、H9亚型禽流感RNA的敏感性分别达2.80、10.50、5.73 pg/μL,该方法检测其他相关病毒时均为阴性,具有很高的特异性,此外,该方法具有良好的重复性。利用所建立方法对240份禽流感临床样品进行检测,结果与血凝试验和血凝抑制试验结果的符合率为100%。此诊断方法检出时间早,且特异、敏感、经济、快速,可普遍推广,在禽流感诊断和防制中具有重要意义和应用价值。
关键词:禽流感病毒;H5亚型;H7亚型;H9亚型;三重RT-PCR
中图分类号:S852.65+7 文献标志码: A
文章编号:1002-1302(2019)09-0204-03
禽流行性感冒(avian influenza virus,AIV)是由正黏病毒科A型流感病毒引起的禽类烈性传染病,其易感动物包括鸡、鸭、火鸡、鹌鹑等家禽及野鸟、水禽、海鸟等野禽,且对人类和低等哺乳动物也能引起严重的疾病,包括高致病性毒株引起的急性致死性疫病以及低致病毒株引起的产蛋下降、轻度呼吸道疾病等多种疾病[1]。禽流感病毒亚型较多,毒株变异较大,给本病的防治带来极大困难。国际兽医局(OIE)规定该病为A类传染病。我国也将此病列为一类动物疫病。
研究发现H5、H7、H9是禽流感病毒中具有较强致病性的3种亚型,其中H5N1禽流感病毒对禽类的致死率通常可以达到100%[2-3]。1997年,香港首次报道发生18例人感染H5N1禽流感病毒,其中6人死亡,引起了全球卫生界的广泛关注[4],证实了AIV可直接对人类造成威胁。2013年3月,我国上海、安徽等地发现人感染H7N9型禽流感,共造成136人感染,其中37人死亡,是全球首次发现的新亚型流感病毒[5]。自1994年首次报道鸡群分离到H9N2亚型禽流感病毒以来[6],H9亚型低致病性禽流感病毒广泛存在于我国[7]。低致病性的H9N2亚型禽流感病毒虽然不引起感染禽类的大量死亡,但是可导致感染禽产蛋下降和免疫抑制,与其他病原共感染时常导致高死亡率,给我国养禽业造成了巨大的经济损失[8-9]。1999年H9N2亚型禽流感在内地和香港感染人事件的发生,更突出体现了禽流感预防治疗的公共卫生意义[10]。因此,快速、及时、准确地检测出禽流感对保障国民的生命财产安全具有重要意义。
RT-PCR作为一种现代分子生物学基因诊断技术,具有高度敏感性和特异性,并可极大缩短禽流感病毒的检出时间,能在数小时内检出痕量病原,可克服传统的AIV诊断技术包括病毒分离鉴定试验周期长的缺点,为AIV早期快速诊断提供了敏感、快速、实用的方法。本试验针对我国养禽业的主要病毒亚型H5、H7和H9,建立了H5、H7、H9的三重RT-PCR,快速诊断禽流感,进行禽流感早期诊断,疫情预测,为禽流感的防治提供有效的早期诊断技术和监测手段,同时也为高致病性禽流感防治争取宝贵的快速反应时间。
1 材料与方法
1.1 试验材料
H9亚型禽流感病毒由笔者所在实验室分离鉴定及序列测定。H5亚型禽流感病毒RNA及阳性血清、H7亚型禽流感病毒RNA及阳性血清均由美国密西西比州立大学万秀峰教授惠赠。鸭坦布苏病毒(duck tembusu virus,DTMUV),鸡传染性喉气管炎病毒(avian infectious laryngotracheitis virus,ILTV),鸡传染性支气管炎病毒(avian infectious bronchitis virus,IBV),减蛋综合征病毒(egg drop syndrome virus,EDS-76)、H9亚型禽流感病毒阳性血清均由本实验室保存。
1.2 试剂
液体病毒RNA/DNA抽提试剂盒,购自Axygen生物科技有限公司;5×AMV反转录缓冲液、High Pure dNTPs(10 mmol/L)、Rnase Inhibitor(40 U/μL)、反转录酶AMV、dNTPs(2.5 mmol/L)、Mg2+(25 mmol/L)、Ex Taq反应缓冲液(10×)、Ex Taq酶,均购自TaKaRa公司;反转录随机引物,由南京金斯瑞生物科技有限公司合成。
1.3 引物设计与合成
根据GenBank已发表的H5、H7和H9亚型禽流感病毒基因序列,分析HA基因保守区,应用DNASTAR软件设计3对特异性引物(表1),由南京金斯瑞生物科技有限公司合成。
1.4 样品的准备
按照试剂盒说明书提取H9亚型禽流感病毒、DTMUV、IBV的总RNA。反转录体系:5×AMV反转录缓冲液4.0 μL,反转录随机引物(9 mer)1.0 μL,dNTP(10 mmol/L)2.0 μL,Ribonuclease Inhibitor 0.5 μL,AMV反转录酶1.0 μL,模板RNA 11.5 μL。按如下條件将病毒RNA反转录成cDNA:42 ℃ 反应1 h,95 ℃反应5 min。将H5、H7亚型禽流感病毒RNA按上述反应体系和条件反转录成cDNA。参照试剂盒说明书,提取EDS-76、ILTV的DNA,保存于-20 ℃,备用。
1.5 单引物单模板验证
分别以H5、H7、H9亚型禽流感病毒cDNA为模板,进行单引物单模板PCR反应,反应体系如下:总体系为25.00 μL,其中双蒸水15.25 μL,10×PCR Buffer 2.50 μL,25 mmol/L MgCl2 2.00 μL,dNTP(2.5 mmol/L)2.00 μL,上、下游引物(50 μmol/L)各0.50 μL,模板cDNA 2.00 μL,Ex Taq(5 U/μL)0.25 μL。PCR反应程序:94 ℃预变性5 min;94 ℃变性50 s,56 ℃退火50 s,72 ℃延伸1 min,30个循环;然后72 ℃延伸10 min。循环反应结束后,将扩增产物进行1.5%琼脂糖凝胶电泳检测。
1.6 H5、H7、H9亚型禽流感病毒三重 RT-PCR检测方法的建立
经过对引物比例、引物浓度、Mg2+浓度、反应时间、反应温度等因素的反复优化,确定了H5、H7、H9亚型禽流感病毒多重PCR基本的反应体系为:双蒸水13.25 μL,10×PCR Buffer 2.50 μL,25 mmol/L MgCl2 2.00 μL,dNTP(2.5 mmol/L)2.00 μL,H5-P1(50 mmol/L)0.50 μL,H5-P2(50 μmol/L)0.50 μL,H7-P3(50 μmol/L)0.50 μL,H7-P4(50 μmol/L)0.50 μL,H9-P5(50 μmol/L)0.50 μL,H9-P6(50 μmol/L)0.50 μL,混合病原cDNA 2.00 μL,Ex Taq(5 U/μL)0.25 μL。按照“1.5”节中所述PCR程序进行反应,循环结束后将扩增产物进行1.5%琼脂糖凝胶电泳检测。
1.7 敏感性试验
测定H5、H7、H9亚型禽流感病毒RNA浓度。在此基础上,分别进行10倍梯度稀释,然后反转录成cDNA,进行三重RT-PCR方法检测,确定该方法的敏感性。
1.8 重复性试验
用建立的三重RT-PCR检测方法,对3份禽流感病毒阳性样品重复检测3次,以验证本方法的重复性和稳定性。
1.9 特异性试验
取DTMUV、ILTV、IBV和EDS-76,分别提取RNA或DNA,采用三重RT-PCR进行扩增,确定本方法检测的特异性。
1.10 三重RT-PCR方法对临床样品的检测
采集江苏地区活禽市场中鸡、鸭、鹅的泄殖腔拭子和喉拭子240份,置于添加四抗的无菌PBS缓冲液中,冻融3次后,尿囊腔接种9~11日龄SPF鸡胚,弃去24 h内死亡鸡胚,于接种后120 h收集鸡胚尿囊液,分别进行三重RT-PCR检测、血凝试验和血凝抑制试验。
2 结果与分析
2.1 单引物单模板验证
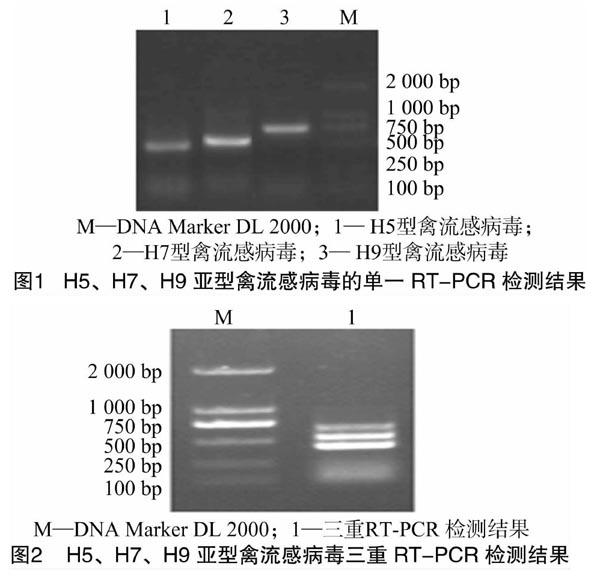
将H5、H7和H9亚型禽流感病毒RNA反转录成cDNA后,采用单引物单模板进行PCR,结果显示,H5、H7、H9亚型禽流感病毒特异性检测引物的目的基因大小分别为427、501、673 bp,与试验设计相符(图1)。
[FK(W9][TPZDM1.tif]
2.2 H5、H7、H9亚型禽流感病毒三重RT-PCR方法的建立
以H5、H7和H9亚型禽流感病毒混合cDNA为模板,同时采用3对引物进行RT-PCR扩增,经过对引物比例、引物浓度、Mg2+浓度、反应时间、反应温度等因素的反复优化,电泳结果显示,H5、H7和H9亚型混合模板扩增出预期大小的特异性条带(图2)。
2.3 敏感性试验
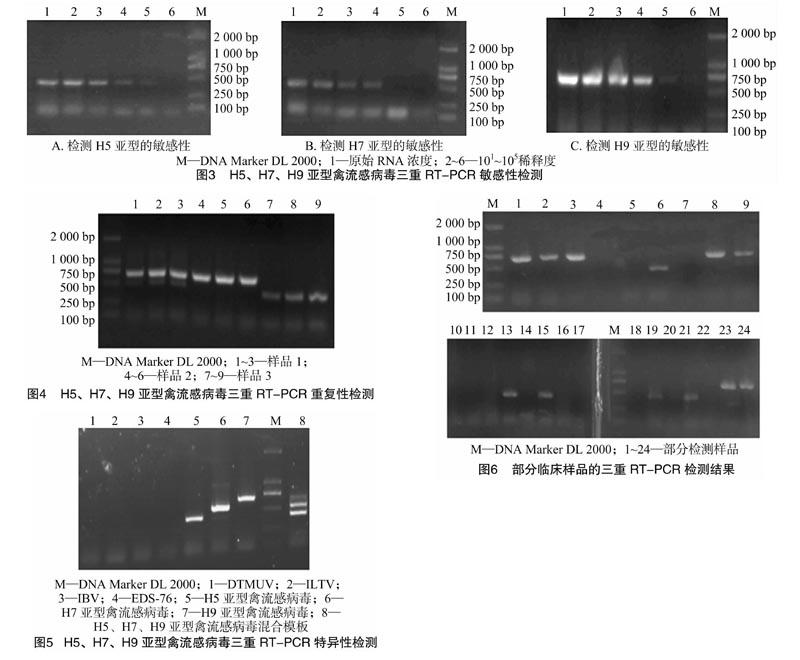
禽流感病毒核酸初始质量浓度的测定结果为:H5亚型模板的质量浓度为28.0 ng/μL,H7亚型模板的质量浓度为105.3 ng/μL,H9亚型模板的质量浓度为57.3 ng/μL。将其进行101~105稀释后进行三重RT-PCR扩增。检测结果表明,该方法能检测出稀释度为104的H5、H7和H9亚型AIV(图3)。
2.4 重复性试验
用建立的三重RT-PCR检测方法,对3份禽流感样品重复检测3次,结果均出现相同的检测结果,表明所建立的方法具有良好的稳定性和重复性(图4)。
2.5 特异性试验
采用所建立的三重RT-PCR方法对几种禽主要疫病病毒进行检测,结果对坦布苏病毒、鸡传染性喉气管炎病毒、鸡传染性支气管炎病毒、减蛋综合征病毒进行RT-PCR均未出现特异扩增条带,说明该检测方法特异性好(图5)。
2.6 三重RT-PCR方法对临床样品的检测
采集江苏地区活禽市场中鸡、鸭、鹅的泄殖腔拭子和喉拭子240份,接种9~11日龄SPF鸡胚后收集鸡胚尿囊液,利用禽流感三重RT-PCR方法进行检测,结果检测到H5亚型禽流感病毒5份、H9亚型禽流感病毒6份,H9和H7亚型混合感染1份。所检测结果与血凝试验和血凝抑制试验的结果完全符合,证明该方法可用于临床检测(图6)。
3 结论与讨论
禽流感病毒可引起禽类全身性或呼吸器官性传染病。至今A型禽流感病毒的血凝素已发现16种,神经氨酸酶10种,其血清型较多,易变异[11]。病毒主要通过病禽的排泄物、分泌物和尸体等污染饮水和饲料,经消化道或伤口传染[12]。早期快速诊断和血清学监测是预防、控制禽流感的前提条件。由于感染禽种类、年龄、性别、所处环境以及感染并发症的不同,表现的临床症状差异极大,因此,该病主要依靠实验室诊断。
目前,禽流感的诊断技术主要有病毒分离鉴定、免疫荧光、RT-PCR、血凝抑制、琼脂扩散、ELISA等,其中病毒分离鉴定和RT-PCR具有很高的敏感性和特异性[13]。但由于病毒分离鉴定操作繁琐、耗时较长,因此,RT-PCR技术仍然是当前诊断禽流感的主要方法。多重PCR是在以单基因PCR为基础上进行的发展和完善,是在同一PCR体系中加入多对特异性引物,一次同时扩增多个靶基因,实现了多基因型的鉴别和多种病原体的同时检出,使混合感染的诊断和基因分型变得更加简捷,减少了漏诊率,提高了检验效率。张文慧等建立了同时检测H5和H7亚型禽流感病毒的多重RT-PCR方法[14];陈思怀等针对NP(型诊断)、HA(亚型诊断)基因设計2对引物,从而对H5、H6、H9亚型AIV做快速检测[15]。马鸣潇等针对H5和H9这2个亚型,各设计1套特异性的引物,建立了RT-PCR一步法,用于H5和H9亚型的鉴别[16]。
本研究针对我国养禽业的主要病毒亚型H5、H7和H9,设计3对特异性检测引物,通过条件优化,建立了同时检测H5、H7、H9亚型禽流感的三重RT-PCR方法。该方法可同时检测H5、H7和H9亚型禽流感病毒,检测灵敏度分别达 2.80、10.50、5.73 pg/μL,方法特异性好、重复性高,可用于快速诊断禽流感,进行禽流感早期预测。本方法的建立可为禽流感防治提供有效的早期诊断技术和监测手段,同时也为高致病性禽流感防治争取了宝贵的快速反应时间。
参考文献:
[1]刘 燕,钱爱东. 禽流感病毒H5、H9亚型的多重RT-PCR鉴别诊断[J]. 中国预防兽医学报,2005,27(1):74-76.
[2]Guan Y,Vijaykrishna D,Bahl J,et al. The emergence of pandemic influenza viruses[J]. Protein & Cell,2010,1(1):9-13.
[3]Subbarao[KG*2/3]K,Katz[KG*2/3]J.[KG*2/3]Avian influenza viruses infecting humans[J].Cellular and Molecular Life Sciences,2000,57(12):1770-1784.
[4]Claas E C,de Jong J C,van Beek R,et al. Human influenza virus A/HongKong/156/97(H5N1)infection[J]. Vaccine,1998,16(9/10):977-978.
[5]Taubenberger J K,Morens D M. Influenza viruses:breaking all the rules[J]. mBio,2013,4(4):e00313-e00365.
[6]陈伯伦,张泽纪,陈伟斌. 禽流感研究:Ⅰ 鸡A型流感病毒分离与血清学初步鉴定[J]. 中国兽医杂志,1994,22(10):3-5.
[7]刘琳玉,姜双应,汪立杰,等. 青海湖地区5株H9N2亚型禽流感病毒全基因组序列进化分析[J]. 病毒学报,2014,30(2):109-118.
[8]吴海燕,李明义,范根成,等. 33株H9N2亚型禽流感病毒分离株分子流行特点的研究[J]. 中国动物检疫,2010,27(6):31-33.
[9]Parvin R,Heenemann K,Halami M Y,et al. Full-genome analysis of avian influenza virus H9N2 from Bangladesh reveals internal gene reassortments with two distinct highly pathogenic avian influenza viruses[J]. Archives of Virology,2014,159(7):1651-1661.
[10]Peiris M,Yuen K Y,Leung C W,et al. Human infection with influenza H9N2[J]. Lancet,1999,354(9182):916-917.
[11]傅生芳,独军政,常惠芸,等. 禽流感病毒的分子生物學研究进展[J]. 动物医学进展,2005,26(5):22-24.
[12]邓振旭. 禽流感病毒检测技术的研究进展[J]. 安徽农业科学,2006,34(12):2740-2741.
[13]张应国,Song Jian Ling,Hu Yuan Yuan,et al. 禽流感病毒 RT-PCR 及多重RT-PCR检测技术的建立[J]. 中国兽医科技,2005,35(8):600-604.
[14]Zhang W H,Guo H,Wang W L,et al. Designing Primers foe H5 and H7 subtypes of avian influenza virus and multiplex RT-PCR amplification[J]. Agricultural Science & Technology,2008,39(1):15-17.
[15]陈思怀,乔宪凤,华文君,等. 多重RT-PCR快速检测禽流感病毒的研究[J]. 湖北农业科学,2006,45(1):20-23.
[16]马鸣潇,金宁一,王振国,等. 检测禽流感病毒RT-PCR一步法的建立及H5、H9亚型的鉴定[J]. 中国生物制品学杂志,2005,18(5):63-65.
