DHA藻油脂质体制备及性质的研究
2019-08-19王淑慧毛苗苗胡诗慧慕鸿雁
黄 茜 王淑慧 崔 婧 毛苗苗 徐 健 胡诗慧 慕鸿雁
(青岛农业大学食品科学与工程学院,青岛 266000)
随着生活水平的提高,人们对于功能性多不饱和脂肪酸的关注度大大提高,其中富含DHA的鱼油、藻油是市场关注热点。DHA是人体大脑和视网膜的重要组成部分,对婴幼儿的智力和视力发育具有重要作用[1];在炎症控制、心血管疾病的调控、机体免疫力增强等方面发挥积极的功效[2-4]。市面上的DHA产品多来自于鱼油,鱼油中脂肪酸组成复杂,DHA含量相对不高,且其应用因海水污染、过度捕捞而受限。天然微藻是海生鱼的食物,脂肪酸组成较简单,是鱼油中多不饱和脂肪酸的主要来源。我国国家卫生部于2010年将裂壶藻油列为新资源食品,其DHA质量分数约为40%,可添加于婴幼儿配方奶粉,亦可作为多不饱和脂肪酸营养补充剂。但藻油含有大量C=C双键,导致其性质不稳定,极易发生氧化酸败,影响感官品质和营养价值降低,甚至产生对人体健康有潜在危害组分。因此,提出切实可行的提高藻油氧化稳定性的解决方案,尤为必要。脂质体是由磷脂等双亲性物质组成的双分子层闭合囊泡,可实现对功能性成分的包封和运载,有效发挥其缓控释作用[5];此外磷脂双分子层的保护作用,还可有效提高功能成分的稳定性[6]。研究表明以脂质体形式存在的鱼油氧化稳定性显著提高,将其作为食品基料添加于食品,具有较高的储存稳定性[7-8],但是关于藻油脂质体的制备及应用研究还很少。基于以上阐述,本研究以大豆卵磷脂、胆固醇、DHA藻油、吐温-80为原料,采用薄膜超声法制备DHA藻油脂质体,通过单因素试验,以包封率、平均粒径为指标探讨最佳制备条件,通过红外吸收光谱分析研究其氧化稳定性,并对其体外消化进行模拟,以期为功能性多不饱和脂肪酸的稳定化技术提供借鉴,也为藻油的应用研究提供新思路。
1 材料与方法
1.1 实验材料与试剂
DHA藻油,大豆卵磷脂(纯度≥97%),胆固醇(≥95%),猪胰脂酶,牛血清蛋白,胆酸钠,吐温-80;无水乙醇、石油醚、脲素、磷酸二氢钾、磷酸二氢钠、磷酸氢二钠等,均为分析纯。
1.2 仪器与设备
TU-1810DASPC紫外可见光光度计;ZEN-3690Malvern纳米激光粒度分析仪;SCIENTZ-10N冷冻干燥机;Neofuge15高速离心机;NICOLET iS10傅里叶变换红外光谱仪;JEM-2100高分辨率透射电子显微镜。
1.3 实验方法
1.3.1 脂质体的制备[9]
采用薄膜分散法,称取一定量的大豆卵磷脂、胆固醇、DHA藻油和吐温-80,按一定比例加入无水乙醇中超声混匀,于一定温度旋转蒸发脱溶并均匀成膜;再加入定量磷酸盐PBS缓冲液,经水化洗膜得到粗脂质体,将其置于冰水浴中超声一定时间得到均匀分散的脂质体澄清液。
1.3.2 单因素实验
分别考察原料配比(大豆卵磷脂/胆固醇质量比、大豆卵磷脂/DHA藻油质量比)、制备因素(蒸脱温度、pH、超声时间和超声功率)对DHA藻油脂质体包封率及性质的影响。
1.3.3 包封率的测定1.3.3.1 标准曲线绘制
(1)DHA藻油溶解于石油醚中,配成浓度为0.6 mg/mL的溶液,以石油醚为空白对照,在190~400 nm波长范围内进行扫描,得到溶液的吸收波长扫描曲线;将大豆卵磷脂和胆固醇做相同处理。
(2)配制一系列不同浓度(0,0.2,0.4,0.6,0.8,1.0 mg/mL)的DHA藻油-石油醚溶液,以石油醚为空白,在最佳波长处测定DHA藻油-石油醚溶液的吸光度,以DHA藻油的浓度为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.3.2 包封率
取适量DHA藻油脂质体溶液于4 200 g离心10 min,得到上清液,取4 mL上清加入20 mL石油醚提取,静置,然后在最佳波长处测定其吸光度,根据如下公式计算包封率:
包封率(EE)=(混悬液中油的总重量-未包封的油)/总的藻油重量×100%
1.3.4 粒径、电位
取适量DHA藻油脂质体,加入蒸馏水稀释到合适浓度,采用纳米激光粒度分析仪测定其平均粒径大小和Zeta电位,平行测定3次并取平均值。
1.3.5 微观形貌
将藻油脂质体样品加水稀释至10 mg/mL,将铜网浸入样品溶液,滤纸吸干多余液体,冷冻干燥,在透射电镜下观察藻油纳米脂质体的形态。
1.3.6 红外吸收光谱
将冻干后的藻油脂质体以无水乙醇复溶,取适量纯溴化钾粉末在玛瑙研钵中研磨均匀,压制成空白KBr片,取一滴样品溶液滴于空白KBr片上,在红外灯下烘干后上机测定。
1.3.7 体外模拟消化[9]
肠液消化液(pH 7.4):取9.07 g KH2PO4,0.007 5 g脲素,1 g牛血清蛋白,0.375 g猪胰脂酶,1.5 g胆酸钠用0.2 N氢氧化钠调节pH至7.4[9]。
消化反应:将脂质体样品与模拟肠液溶液以1∶3的体积比混合,在37 ℃水浴恒温振荡器中混匀预热。猪胰脂酶以相应的肠液溶解,反应开始时间为加入酶的瞬间。在1、5、20、120 min时分别取样于95 ℃的恒温水浴锅中加热2 min灭酶,测定其平均粒径。
2 结果与分析
2.1 标准曲线的绘制
DHA藻油、大豆卵磷脂、胆固醇石油醚溶液的吸收波长如图1所示,藻油的最大吸收峰出现在240 nm处,大豆卵磷脂和胆固醇最大吸收峰也出现在此处,而藻油在274 nm处有一个突出的吸收峰。因此,将274 nm选作测定藻油脂质体包封率的最佳吸收波长。根据在274 nm波长处所测得的数据,以藻油-石油醚溶液浓度为横坐标吸光度为纵坐标,得到藻油-石油醚溶液标准曲线,如图2所示,其线性回归方程为y=0.611 9x+0.008 6,R2=0.999 3。

图1 DHA藻油、大豆卵磷脂、胆固醇石油醚溶液的吸收波长
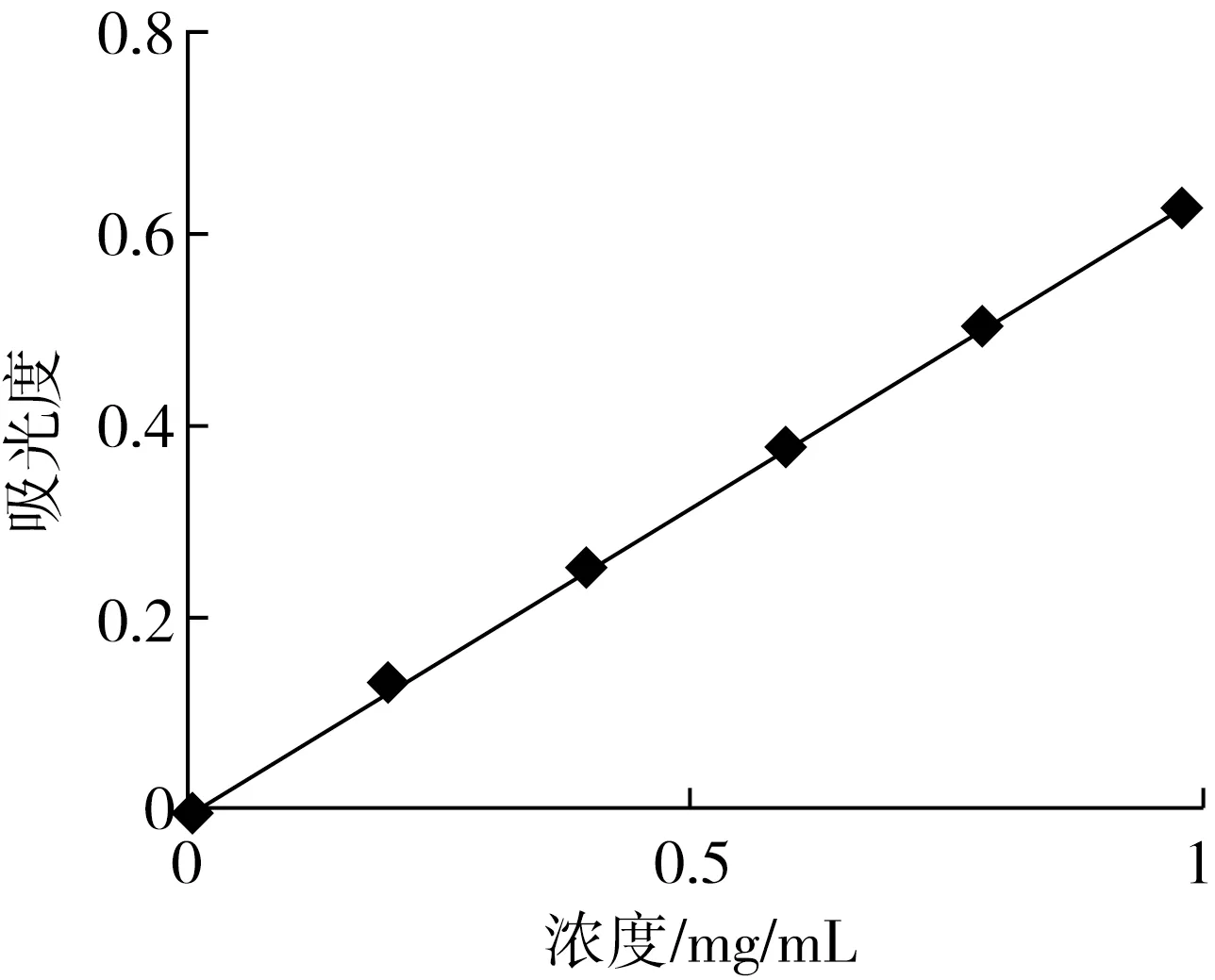
图2 DHA藻油-石油醚溶液标准曲线
2.2 单因素结果分析
2.2.1 原料配比对DHA藻油脂质体包封率和性质的影响
以脂质体的包封率、粒径和电位为考察指标,在其他因素(温度40 ℃、pH 7.2、超声功率350 W、超声时间60 s)不变情况下分别探讨了大豆卵磷脂/DHA藻油质量比、卵磷脂/胆固醇质量比对脂质体包封率及性质的影响,结果如图3、图4所示。

图3 物料比对脂质体包封率的影响

a

b图4 物料比对脂质体粒径、电位、PDI的影响
由图3可知,随着大豆卵磷脂/胆固醇质量比的提高,DHA藻油脂质体的包封率逐渐增加,在两者质量比为3∶1时最大,之后呈降低趋势。这是由于胆固醇会改变大豆卵磷脂的相变温度,影响磷脂双分子层的流动性。适量的胆固醇会降低磷脂双分子层的流动性,使脂质体膜的致密性增加,从而提高包埋率[10]。保持大豆卵磷脂/胆固醇质量比为3∶1,考察大豆卵磷脂与DHA藻油质量比对脂质体包封率的影响,发现包封率变化显著。当大豆卵磷脂/DHA藻油质量比为2∶1时,脂质体包封率仅为(70.05±0.54)%;随着卵磷脂比例升高,包封率逐渐增加,当卵磷脂/DHA藻油比为5∶1时,包封率达到(88.46±0.87)%,之后继续增加卵磷脂含量,包封率变化不明显。在整个原料配比考查范围内,脂质体粒径为200~600 nm,说明所制备的脂质体为纳米脂质体。电位是考察脂质体颗粒稳定性的重要参考指标,颗粒间静电斥力越大,脂质体颗粒越不容易发生聚集等现象[11]。在整个物料比考察范围内,所得脂质体的电位绝对值均高于30 mV,说明该条件下所制备的脂质体具有较好的稳定性。当卵磷脂/胆固醇质量比为3∶1,卵磷脂/DHA藻油质量比为5∶1时,所制备的纳米脂质体粒径为(247.1±0.3)nm, PDI为0.279±0.003,说明脂质体粒径分布均匀。故确定大豆卵磷脂/胆固醇质量比为3∶1、大豆卵磷脂/藻油质量比为5∶1。
2.2.2 制备因素对藻油脂质体包封率和性质的影响
保持大豆卵磷脂/胆固醇质量比为3∶1,卵磷脂/藻油质量比为5∶1,分别探讨了蒸脱温度、pH、超声时间和超声功率对纳米脂质体包封率和粒径、PDI、电位的变化,结果如图5、图6。
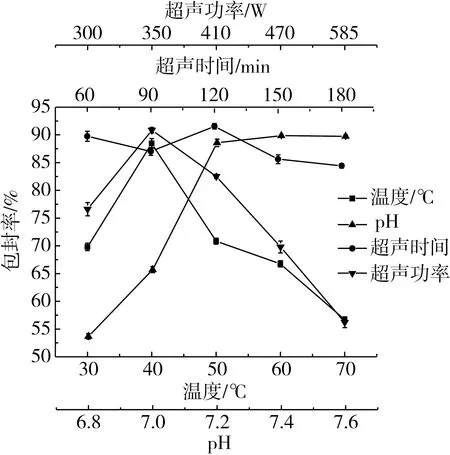
图5 制备条件对脂质体包封率的影响
由图5可知,温度、pH和超声功率对脂质体包封率具有重要的影响,在实验温度范围内,脂质体的包封率先增加后降低,实验过程中发现温度过低会导致脂质体成膜时间长且不均匀,温度过高则会增加DHA藻油的氧化损失。蒸脱温度为40 ℃时,脂质体的包封率最高。脂质体的外被膜为磷脂双分子层,因此酸性条件下会加速脂质体的水解[10],在实验范围内,脂质体的包封率随着pH增加而增加,当溶液pH为7.4时,脂质体包封率相比于其他pH值脂质体包封率较高。适度的超声有利于脂质体的分散,而长时间超声,可影响脂质体囊泡的结构,且超声会产生热量,时间越长,产生的热量越多,会影响到磷脂双分子层的稳定性,当超声时间为120 s时脂质体的包封率最高。DHA藻油脂质体的包封率随着超声功率的增加呈现先增大后减小的变化,这是由于过高的超声功率会破坏脂质体囊泡结构,使DHA藻油从脂质体中渗漏,从而使包封率降低,当超声功率为350 W时,包封率显著高于其他功率下的结果。
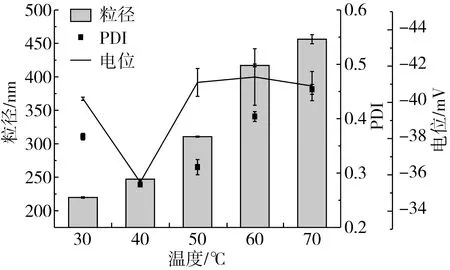

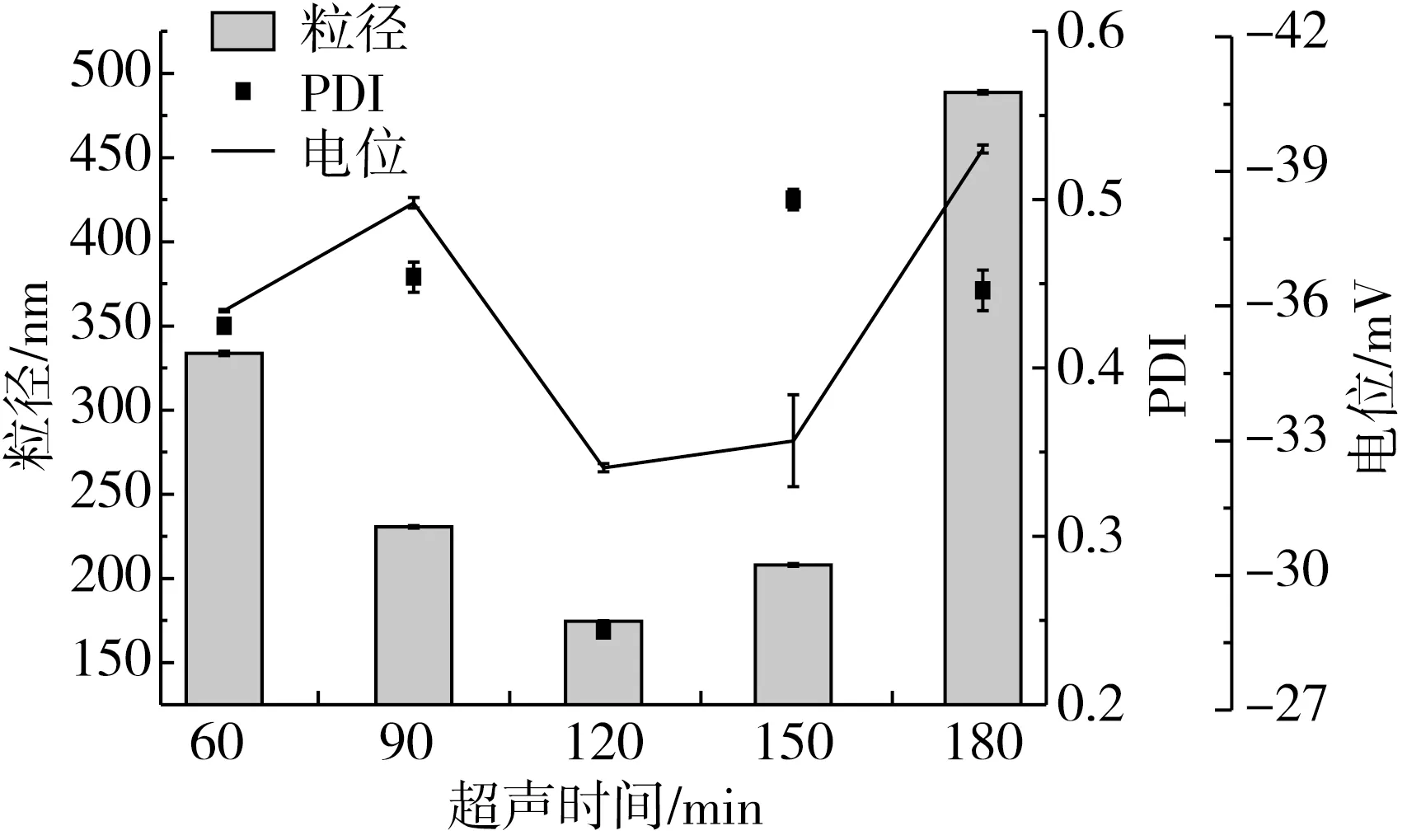

图6 制备条件对脂质体粒径、PDI和电位的影响
图6是各制备条件下脂质体的粒径、电位及PDI。由图6可知,各制备因素对所得脂质体的粒径、PDI和电位均有重要的影响,但在实验范围内,所制得的脂质体粒径均小于600 nm,电位绝对值为25~48 mV。当蒸脱温度为40 ℃、pH7.4、350 W超声120 s时所制备的脂质体包封率最高,为(91.55±0.4)%,粒径为(224.5±0.21)nm,PDI为0.224±0.003,电位(-32.4±0.03)mV,说明所制备的纳米脂质体粒径分布均匀且稳定。
所得藻油脂质体的最佳制备条件为:大豆卵磷脂与胆固醇比为3∶1(g/g)、大豆卵磷脂与DHA藻油比为5∶1(g/g)、蒸脱温度为40 ℃、pH为7.4、超声时间为120 s、超声功率为350 W。
2.2.3 透射电镜结果分析
DHA藻油脂质体的透射电镜图如图7所示。由图7可见,脂质体呈现球形或椭圆形,粒径均在纳米级,这与激光粒度分析仪所测得的结果一致;最佳条件下的脂质体边缘基本没有油脂,说明最佳条件下脂质体对DHA藻油的包封效果明显。

图7 藻油脂质体的透射电镜图
2.2.4 红外吸收光谱分析

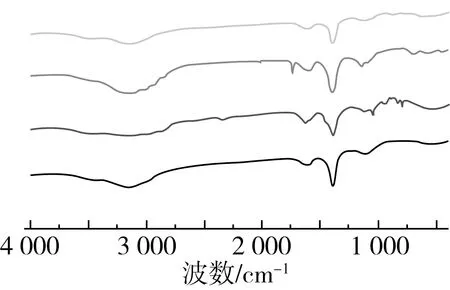
注:图中曲线从上到下依次为脂质体,DHA藻油,胆固醇,卵磷脂。a

注:图中曲线从上到下依次为室温放置1周的DHA藻油,DHA藻油,室温放置1周的脂质体,脂质体。b图8 大豆卵磷脂、胆固醇、DHA藻油、脂质体的红外光谱
2.2.5 体外模拟消化结果分析
研究表明,脂质在体内的消化与脂肪酶的活性有关,而低pH对脂质体的影响很小[13]。本实验在预实验中也得到了一致的结果。由于脂肪酶、磷脂酶主要分布在小肠中,本研究重点探究了脂质体在肠液中的粒径的变化,结果如图9所示。
藻油脂质体在模拟肠液溶液中平均粒径呈先逐渐增加而后减小的趋势。本实验中所用的胰脂酶是从猪体内提取得到的,含有脂解酶(包括脂肪酶、磷脂酶A2和胆固醇酶),这三种脂解酶均对磷脂产生作用,其中,磷脂酶A2对磷脂双分子层结构具有较强的破坏能力。经脂解酶的作用,DHA藻油脂质体的结构可能发生变化,导致脂质体的絮凝,从而使平均粒径增大。随着脂质体被消化,其平均粒径随之减小,这是由于肠液中胆酸钠的存在,破坏了脂质体的双分子层膜,脂质体被消化吸收,使平均粒径减小[14]。

图9 不同消化时间脂质体的粒径
3 结论
本研究以包封率、平均粒径为指标,通过单因素试验确定了制备DHA藻油脂质体的最佳条件:大豆卵磷脂与胆固醇质量比为3∶1(g/g)、大豆卵磷脂与DHA藻油质量比为5∶1(g/g)、温度为40 ℃、pH为7.4、超声时间为120 s、超声功率为350 W。在此条件下,脂质体包封率可达(91.55±0.4)%,粒径为(224.5±0.21)nm,PDI为0.224±0.003,电位(-32.4±0.03) mV,形貌为椭圆球形。通过红外吸收光谱图发现,DHA藻油脂质体对DHA藻油的包封效果良好,室温放置数天后的DHA藻油脂质体红外光谱图无明显变化,DHA藻油脂质体的稳定性远高于DHA藻油。
