大米蛋白质中砷分布规律研究
2019-08-19邢常瑞鞠兴荣
邢常瑞 章 铖 杨 锴 董 雪 鞠兴荣 袁 建 何 荣
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室, 南京 210023)
大米蛋白及其功能性产品具有致敏性低、氨基羧含量高、比例合理等优点,近年以来在婴幼儿产品和高端产品领域具有广阔的开发前景。然而随着中国工业化快速发展,部分省市以污染环境为代价导致土壤中重金属污染严重。这些重金属通过“天气-河流-土壤-植物”的自然循环系统富集在植物中,并通过食物链进入人体从而引发一系列疾病,危害生命健康[1],如日本富山县“痛痛病”事件。镉易于在肾脏中累积,进而可能损害肾脏所处的泌尿系统,主要表现为近端肾小管功能障碍[2]。重金属铅进入人体后会溶于血液中,进而阻碍血细胞的合成,导致贫血。长此以往,会对人体的血液循环系统,消化系统,神经系统,免疫系统产生巨大危害。根据联合国报道,在贫困地区的居民,长期饮用被砷污染的地下水会造成多器官的细胞毒性,甚至是癌症[3]。
水稻是较易富集重金属的主粮之一,重金属镉、铅、砷更易于与大米的蛋白质结合。孔庆新[4]对受污染大米可能镉分布部位的实验探究,得出镉主要与米胚乳中的谷蛋白络合而存在,是一类金属镉与蛋白质形成的络合物。陈露等[5]采用Osborne分级法提取籼糙米(镉含量215.31 μg/kg)中的4种蛋白质(清蛋白、球蛋白、醇溶蛋白和谷蛋白),发现4种大米蛋白中的镉含量分别为0.66、0.31、0.63、0.23 mg/kg,清蛋白中镉含量最高。杨居荣[6]采用组织化学及溶剂提取法研究发现,Cd、Cu、Pb在稻谷和小麦籽实中优势形态是蛋白质结合态,并且球蛋白和谷蛋白结合Cd的比例高。然而,到目前为止,鲜有报道分析砷与大米结合蛋白的特征和相关的理化性质以及结合机理。
本实验选取砷污染较严重的大米为研究对象,通过Osborne法的原理连续提取各级蛋白质,并结合聚丙烯酰胺凝胶电泳(SDS-PAGE)、紫外扫描分析(UV)和基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)等方法对砷结合蛋白质进行性质表征。利用电感耦合等离子体质谱(ICP-MS)定量分析不同大米蛋白中重金属含量,并结合氨基酸组成分析研究特征蛋白氨基酸组成,得出砷在稻米中的分布规律,为后续稻米砷消减技术和开发优质米蛋白产品、响应国家优质粮食工程建设提供参考。
1 材料与方法
1.1 样品采集与处理
实验样品为采集的砷污染严重的大米(粳稻、产自湖南某地、2017年秋)。取重金属污染大米适量,用砻谷机将稻谷外壳去掉,保留糙米,然后用万能粉碎机将糙米磨成粉末,过60目筛得到糙米粉,待用。
1.2 试剂与仪器
石油醚、乙醇、氢氧化钠、盐酸、氯化钠、硝酸、过硫酸铵、Tris-HCl、过氧化氢、浓硝酸、溴化钾、聚丙烯酰胺凝胶电泳相关试剂、ZipTip C4微量层析柱、SA基质溶液。
JXFM110锤式旋风磨;CEM MARSX微波消解萃取装置;7700x电感耦合等离子质谱仪;pHS-3C型精密数显pH计;5800MALDI-TOF-MS基质辅助激光解吸电离飞行时间质谱;BLH-3250型实验砻谷机;JNMJ6型检验碾米机;TENSOR 27傅里叶变换红外光谱仪;RE-5299旋转蒸发仪;U-3900紫外可见分光光度计;Bio-Red 165-8001 小型垂直电泳仪。
1.3 方法
1.3.1 大米中蛋白的提取与纯化
根据4种蛋白(清蛋白、球蛋白、醇溶蛋白、谷蛋白)溶解度的差异,分别以蒸馏水,5% NaCl溶液,70%乙醇溶液,0.05 mol/L NaOH溶液作为主要溶剂,采用Osborne法分步提取四种蛋白。每次室温搅拌提取时间2 h,固液比4∶1,通过离心(10 000 r/min,10 min)分离沉淀蛋白,每步重复提取3次。合并提取液并通过0.45 μmol/L过滤,通过滴加2 mol/L HCl调节等电点沉淀提取液中的蛋白质,进行冷冻干燥,-20 ℃保存。具体提取步骤见图1。
1.3.2 SDS-PAGE电泳
将分离得到的适量清蛋白,球蛋白,醇溶蛋白,谷蛋白分别溶于蒸馏水,5%(m/V) NaCl溶液,70%(V/V)乙醇溶液,0.05 mol/L NaOH溶液制成0.3%(m/V)蛋白样液。并分别吸取各蛋白样液10 μL,加入上样缓冲液30 μL于2.5 mL离心管中,沸水浴加热3 min备用。配制10%(m/V)分离胶,5%(m/V)浓缩胶。连接电泳槽,装入已制备好的凝胶,在电泳槽中加适量电泳缓冲液,依次缓慢滴加Marker,蛋白样液各10 μL。凝胶电泳初始电压设置为70 V,待条带跑至黑线时,加大电压至120 V。凝胶电泳结束后将凝胶小心取下,置于考马斯亮蓝染色液中摇床振荡40~60 min,后置于脱色液中摇床振荡约180 min,最后使用凝胶成像系统拍照。
1.3.3 MALDI-TOF-MS检测
用ZipTip C4对蛋白样品进行脱盐,在样品靶上点样1 μL蛋白样品并风干,加入0.6 μL SA基质溶液点后风干,在旁边做标准样对照。选取线性方法在正离子条件下进行相关样品的校准测试,并用线性方法测试蛋白样品的分子质量。
1.3.4 紫外扫描分析
将适量清蛋白,球蛋白,醇溶蛋白,谷蛋白分别溶于蒸馏水,5%(m/V) NaCl溶液,70%(V/V)乙醇溶液,0.05 mol/L NaOH溶液制成0.1%(m/V)蛋白样液。分别以蒸馏水、5%(m/V) NaCl溶液、70%(V/V)乙醇溶液、0.05 mol/L NaOH溶液作为空白进行基线校正,再对同溶剂的蛋白溶液在200-800 nm范围内的紫外吸收强度进行扫描测试。
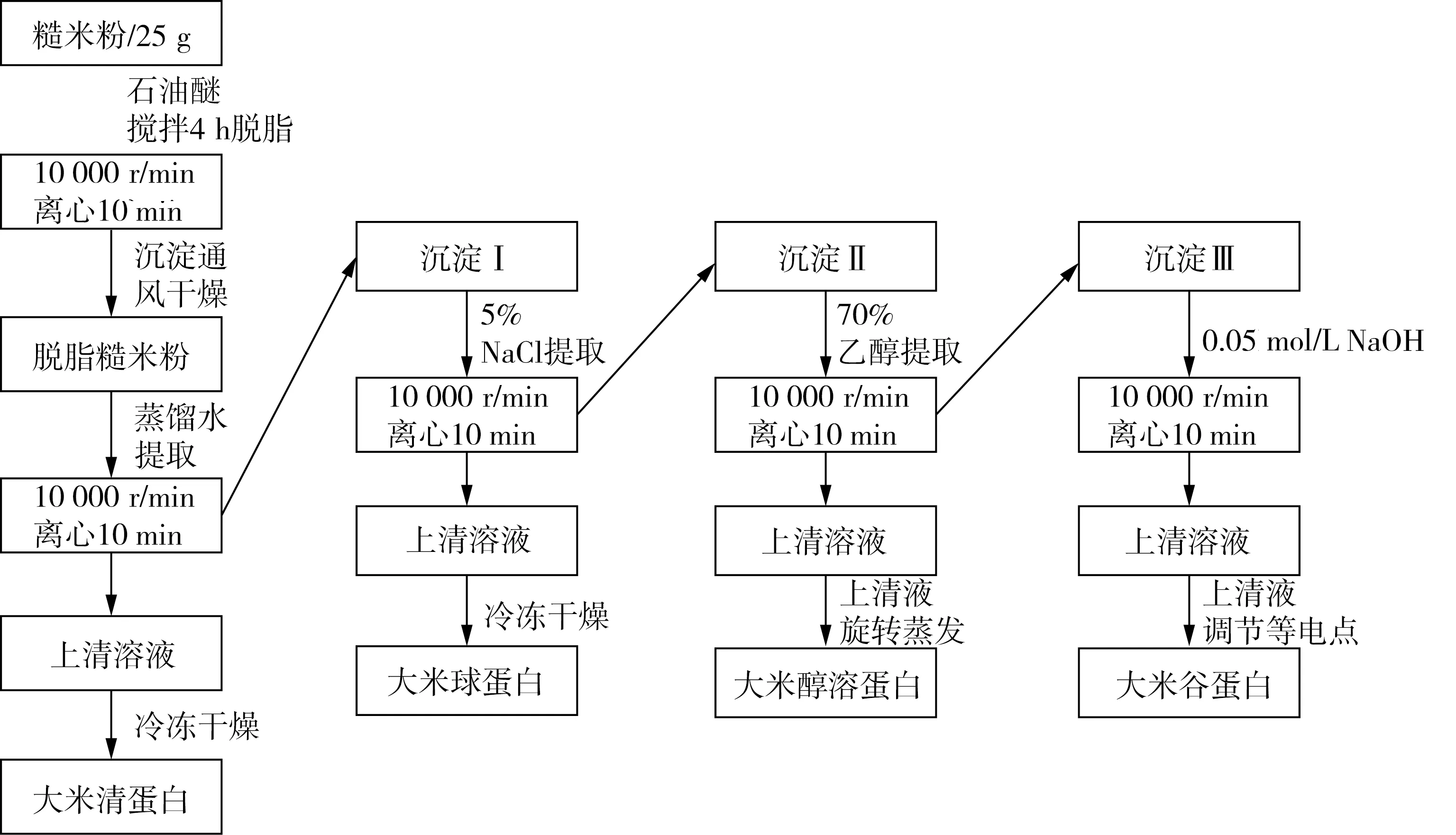
图1 Osborne分级法提取糙米中的蛋白质
1.3.5 傅里叶红外光谱仪检测
采用压片法进行傅里叶红外光谱检测,样品与KBr的比例约为1:100于研钵中研磨均匀,并用压片机进行压片。在400~4 000 cm-1范围内对样品进行扫描测量,分辨率为4 cm-1。
1.3.6 砷含量检测
准确称取0.3 g样品于消解管中,并加入2 mL 30%(V/V)过氧化氢溶液以及5 mL 65%(V/V)浓硝酸,置于通风橱静置40 min后,将消解管放入微波消解萃取装置中消解60 min,待消解完毕后,放入电加热器中设定160 ℃,进行赶酸,赶酸结束后用2%稀硝酸将消解管中样品定容至10 mL容量瓶,经0.22 μm微孔滤膜过滤后,用电感耦合等离子质谱仪(ICP-MS)测试样品中砷含量。
1.3.7 蛋白氨基酸组成分析
称取0.2 g样品放入水解管中,加入10 mL 6 mol/L HCl后密封,于110 ℃的烘箱下水解24 h。将水解液用旋蒸仪进行旋蒸以除去盐酸,后加入0.02 mol/L HCl定容至50 mL,吸取少量水解液经0.22 μm滤膜过滤,装入进样瓶中,采用氨基酸分析仪中对各个蛋白进行氨基酸组成分析。
1.3.8 数据处理与统计
数据用IBM SPSS 22.0进行分析和处理,图表用Origin Pro 2016绘制。
2 结果与讨论
2.1 SDS-PAGE分析
SDS-PAGE测试结果如图2所示,用Osborne法分步提取4种蛋白中,醇溶蛋白有一条清晰的条带,分子质量在14.2 ku左右,表明醇溶蛋白是一个相对单一的组分;清蛋白有3个条带,分子量分别在14.0、20.1、35~37 ku左右;球蛋白有2个条带,分子质量分别在18.5~19.5、37.0 ku左右。谷蛋白比较复杂,存在4个条带,分子质量分别在14.6、20~21、31、37.1~38.0 ku左右。该电泳结果与李亦蔚[7]提取和分离大米蛋白的研究结果较一致。说明了此提取、分离、纯化方法能制备出纯度均一的各级大米蛋白。

图2 SDS-PAGE测试结果
2.2 MALDI-TOF-MS分析
通过基质辅助激光解吸电离飞行时间质谱法(MALDI-TOF-MS)测定分子质量,结果如图3所示。比较4种大米蛋白可知,醇溶蛋白只有一个较明显的峰,分子质量约为14.1 ku,这点与之前的电泳图所得结果较一致,陈露在提取分离得到的镉硫蛋白也发现了类似的结果[5],这表明该醇溶蛋白是一类低分子量的,纯度单一的结合蛋白,其余蛋白的曲线图谱与电泳图谱基本一致,推测其余蛋白可能是多种不同分子质量的蛋白质,也有可能是含有多个亚基。



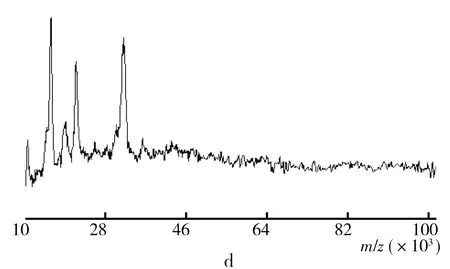
图3 大米醇溶蛋白(a)、球蛋白(b)、清蛋白(c)和谷蛋白(D)的MALDI-TOF-MS测试结果
2.3 紫外扫描分析
以波长为横坐标,吸光度为纵坐标。各蛋白紫外图谱如图4所示,从图4可以看出,醇溶蛋白在257 nm处存在吸收峰,已有报道发现通常在250 nm处存在镉硫蛋白特征吸收峰[8],因此可以初步得到该类蛋白是一种典型的金属硫蛋白。清蛋白在242 nm左右处有强吸收峰,推测该处可能为该砷清蛋白特征吸收峰。

图4 特征蛋白紫外图谱
2.4 傅里叶红外光谱仪分析





图5 大米中醇溶蛋白、谷蛋白、清蛋白、球蛋白的FTIR图
2.5 大米蛋白中重金属分布规律研究
前期研究中发现随着加工精度的增加,重金属去除率也随之增加。在碾米时间为120 s条件下,As总去除率达到42.57%,说明砷在糙米外层含量很高,很可能以砷蛋白形态存在[11]。杨居荣等[12]研究发现出米率为68.6%的精米,与原稻谷相比镉的去除率可达24.10%,这是由于稻米籽粒中约40%的镉富集在占稻米总重9%的糊粉层中,而占稻米总重约71%的胚乳中仅富集了45%的镉。因此本实验选用去壳的糙米作为原料,制备米粉,来研究大米蛋白质中砷的分布具有现实意义。
首先测定砷污染稻谷的重金属含量并对分离得到的四种大米蛋白进行重金属含量分析如表1所示,结果表明:污染大米中砷含量为0.242 mg/kg。通过分离得到的清蛋白中砷含量最高达到2.190 mg/kg,其次谷蛋白砷含量达到0.489 mg/kg,球蛋白和醇溶蛋白砷含量分别为0.110、0.076 mg/kg。砷与蛋白质结合紧密,由此推断其结合强度依次为:清蛋白>谷蛋白>球蛋白>醇溶蛋白。根据提取所得的四种蛋白质量以及对应的蛋白重金属含量,对比原始样品的质量和重金属含量(蛋白质量未给出),计算得到四种蛋白砷含量占砷污染样品中的63.17%,清蛋白的砷含量占总样品的26.03%,表明砷污染大米中砷与清蛋白的结合态为优势形态。

表1 大米及大米蛋白砷含量
2.6 氨基酸组成分析
表2分析了4种蛋白之间氨基酸含量的差异,以及砷结合蛋白后蛋白氨基酸含量的变化。由于无砷污染大米的球蛋白、醇溶蛋白、谷蛋白,与砷结合的球蛋白、醇溶蛋白及谷蛋白之间的氨基酸含量差异较小(该部分数据未给出),因此选用无砷污染大米的清蛋白与砷结合清蛋白进行比较和分析砷对蛋白氨基酸含量的影响。
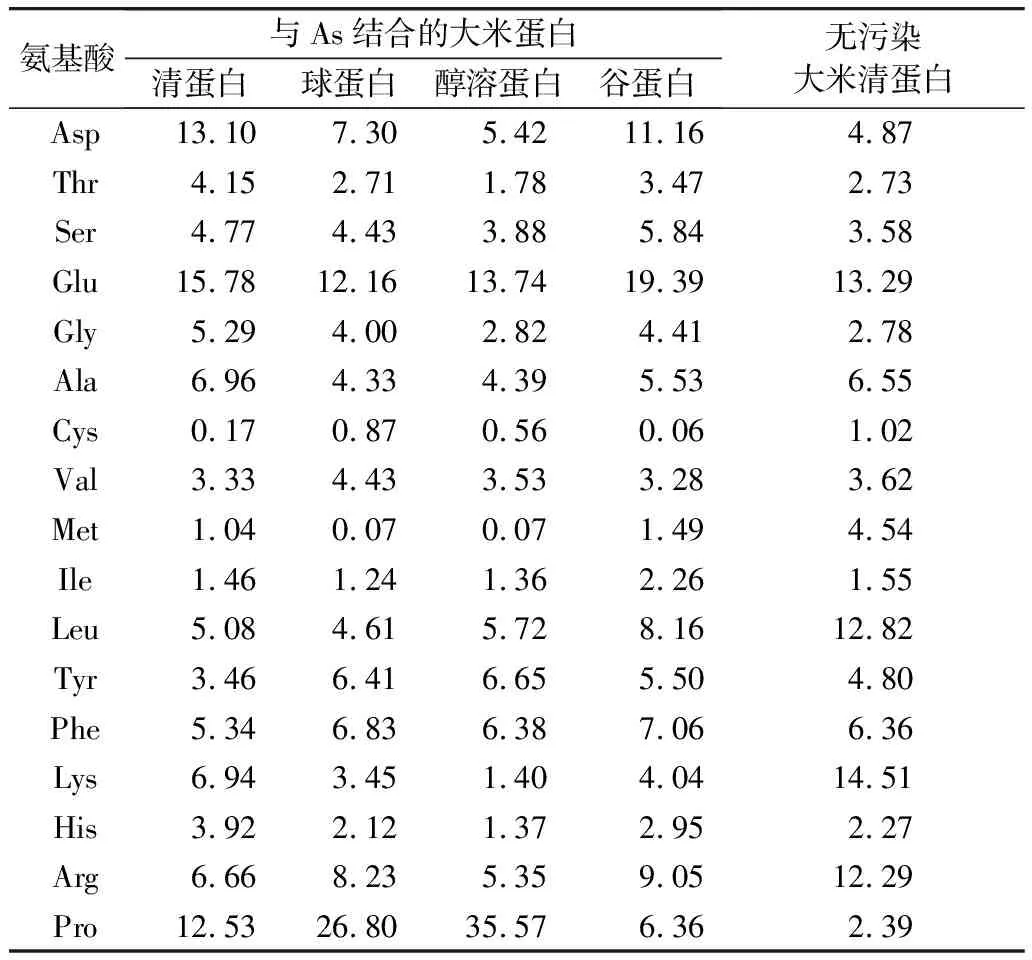
表2 蛋白样品氨基酸组成
比较表3中数据发现,几种蛋白样品的脯氨酸、谷氨酸的含量整体较高,半胱氨酸的含量整体较低。值得注意的是砷结合醇溶蛋白中脯氨酸含量远远高于砷谷蛋白,两者相差29.21%;而砷结合谷蛋白中谷氨酸含量高达19.39%明显高于其他样品,该结果与刘珊珊[13]研究镉结合蛋白所发现的规律较一致。另外比较各种大米蛋白,发现砷结合蛋白中疏水性氨基酸含量较高,推测砷可能通过与疏水性氨基酸中的特征基团结合的方式形成砷结合蛋白。
砷结合清蛋白与无砷污染的大米清蛋白相比,重金属砷的存在提高了大米中天冬氨酸的含量,并降低了赖氨酸含量,该规律与王凯荣[14]等人镉污染对稻米品质的影响中所发现的规律较为一致。并且砷结合清蛋白与无污染的大米清蛋白相比,脯氨酸含量提高了10.14%,推测在砷结合清蛋白中,金属砷可能通过脯氨酸与蛋白质结合。
3 结论
本研究对砷污染的大米进行连续提取,分离得到大米醇溶蛋白、球蛋白、清蛋白和谷蛋白。通过SDS-PAGE、MAlDI-TOF-MS、紫外光谱以及傅里叶红外光谱等方法对四种蛋白表征后,发现砷与蛋白质结合紧密,砷与蛋白质结合的强度依次为:清蛋白>谷蛋白>球蛋白>醇溶蛋白。通过ICP-MS与氨基酸组成分析获取了砷在四种蛋白质中的分布规律:四种蛋白砷含量占砷污染样品中的63.17%,清蛋白的砷含量占总样品的26.03%,由此推测砷与清蛋白是优势的结合态;砷结合蛋白中脯氨酸含量明显高于其他样品,由此推测砷主要与蛋白中的脯氨酸进行结合。
