肠道外致病性大肠杆菌外膜蛋白研究进展
2019-08-19武琥琮刘家奇朱国强
许 姝,张 东,魏 星,武琥琮,刘家奇,王 亨,朱国强
(1.扬州大学兽医学院,江苏扬州225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州225009)
肠道外致病性大肠杆菌病(Extraintestinal pathogenicEscherichia coli,ExPEC)是一种常发肠道外疾病,危害人类、动物的健康,也导致禽类产蛋量的下降及肉用动物的上市延迟,严重的则引起死亡。因此,对于肠道外致病性大肠杆菌的致病机制也是许多学者研究的热点,肠道外致病性大肠杆菌致病机理的研究近些年主要集中在脂多糖(LPS)、外膜蛋白(Outer membrane protein,Omp)、菌毛、鞭毛、等毒力因子方面[1]。
Omp 是肠道外致病性大肠杆菌中含有的独特的脂质双分子层结构的外膜,该结构在增强细菌黏附侵袭能力、物质运输及相关功能物质的合成等方面发挥重要作用[2],并且也能够帮助细菌抵抗宿主免疫系统靶向识别的清除(表1)。因此,深入了解Omp 为探究禽致病性大肠杆菌致病机制奠定理论基础。
1 肠道外致病性大肠杆菌病Omp的组成及理化性质
Omp 是镶嵌在革兰氏阴性菌外膜层中多种蛋白质的统称[2]。研究表明,大肠杆菌的外膜具有独特的曲折成波浪形状的典型非对称性液态脂质双分子层结构[3]。OMP是整合膜蛋白,由一组β 链构造出β 桶空间结构,穿透生物外膜并在整个蛋白质生命周期内均生存在外膜上。在周质侧链之间具有短环,并且在胞外侧具有大的延伸环。Omp β 桶内部的区域可能是中空的,也可能填充部分磷脂双层分子,或者附着一些生物小分子。迄今为止,几乎所有这个类型蛋白质的结构均以反向平行的方式排列偶数个β 链。这种结构特征有助于Omp 在膜中保持高稳定性,帮助病压菌抵抗恶劣和多变的环境。Omp 也可以利用此β 桶结构进行外膜内外环境的相互交流,有些Omp能够直接允许离子通过,甚至可以让水分子通过,有些则选择性允许生物小分子通过,其选择性主要通过Omp 的非跨膜部分实现。细菌Omp 的C 末端结构域是面向周质空间的球状蛋白质,其与肽聚糖非共价相互作用,提供稳定性和细胞完整性。Omp 暴露于细菌细胞外部,是细菌与其周围环境之间的第一屏障。鉴于其的关键位置,Omp充当许多不同的角色,比如作为毒力的粘附因子,吸收营养素的通道,铁载体受体和酶(例如蛋白酶和脂肪酶)[4]。目前对肠道外致病性大肠杆菌病Omp 的热修饰蛋白(OmpA)、微孔蛋白(OmpC、OmpF)的结构与功能了解得较为详细。不仅如此,利用对该3 个蛋白的研究,奠定了后来对许多Omp 性质研究的基础。
OmpA 蛋白,通过分析其结构域,了解该蛋白包括信号肽、N 末端OmpA 结构域和C 末端配体结合结构域。OmpA 的跨膜拓扑在周质末端表现为短转角,在胞外末端具有较长的不规则环。其C 端序列保守,可能在系统进化中发挥着重要作用。N 端构成8 个跨膜反向平行的β桶状结构域,膜的外表面由4 个环(L1、L2、L3、L4)组成,周质面由3 个短转角(L1、L2、L3、L4)折叠组成。一些研究表明,OmpA 的N-末端部分及其表面暴露的不规则环有助于与HBMEC (Human brain microvascular endothelia cell,HBMEC)结合[5]。然而,最近使用大肠杆菌DNA 微阵列分析亲本大肠杆菌菌株RS218 和其OmpA缺失突变体的研究表明,OmpA缺失突变株显示出fim 簇基因的表达显著降低,并且Ⅰ型菌毛在细菌表面表达降低。这些发现表明,OmpA缺失突变株的黏附减少可能与其Ⅰ型菌毛的较低表达有关。与亲本大肠杆菌菌株相比,OmpA缺失突变株体内的渗透效率显著降低[6]。由此可见OmpA 可能增强大肠杆菌的毒力。最近还有一项研究表明,OmpA 抑制剂能够阻止大肠杆菌的粘附,从而在小鼠腹膜败血症模型中起到保护作用[7]。
大肠杆菌OmpC 是一种主要孔蛋白(图1)。结晶学研究揭示,大肠杆菌OmpC 单体由16 个反向平行β 链构成,具有空心桶状结构,是一种对蛋白质变性具有较高稳定性的三聚体。在细胞外侧有8 个长而不规则的环(L1、L2、L4、L5、L6、L7、L8),唯独L3 是沿着桶壁的内面延伸,并将孔隙收缩到一半,在周质侧具有8 条短转角(T1、T2、T3、T4、T5、T6、T7、T8),N 和C 末端残基形成盐桥。最新研究证实大肠杆菌OmpC 孔蛋白是淀粉样蛋白以及其与神经毒肽的结构和功能的相似性表明OmpC 孔蛋白参与神经变性。OmpC 能够通过在神经元细胞膜中形成孔并破坏Ca2+稳态而导致细胞凋亡,引起神经元细胞死亡从而诱导神经变性[8]。这一研究说明可以通过控制OmpC 的表达来降低发病率。
OmpF 孔蛋白是外膜中含量最丰富的蛋白质之一(每个细胞约105个拷贝),是第一个获得晶体衍射的整合膜蛋白。OmpF 是一种对称三聚体(图1),通过其135 个卷曲螺旋中心结构域与BtuB 受体紧密结合。三聚体中的每个单体是由一个有16 个两亲性β 链构成的β 桶组成,在桶单体的细胞外侧具有8 个延伸的环(L1、L2、L3、L4、L5、L6、L7、L8),并且在周质侧具有8 条短转角(T1、T2、T3、T4、T5、T6、T7、T8)。晶体结构显示OmpF 与OmpC 两个孔蛋白之间无明显不同的物理化学特征,属于同源孔蛋白,两者有60 %的氨基酸序列相同,但这两个孔蛋白在结构和功能上显示出微小的差异:OmpC 比OmpF 具有更多的阳离子选择性和更小的孔径[9]。OmpF有较宽的孔隙,优先在较低的渗透压下表达。大肠杆菌的OmpF 和OmpC 孔蛋白基因均具有位于不同环上的抗原表位,它们可能具有一定的免疫特性,并在细菌发病机制中起作用,如粘附、侵袭和血清抵抗。
2 肠道外致病性大肠杆菌病Omp的致病性
2.1 Omp 维持细菌细胞膜的完整性 肠道外大肠杆菌的Omp 是最重要的细菌保护屏障,作为防御细胞外威胁的第一道防线,细菌外膜主要由脂类和几千种Omp 组成,外膜的完整性维持着细菌的活力和参与促进耐药性细菌的形成(表1)。因此,许多药物通常靶向Omp 来破坏病原菌。
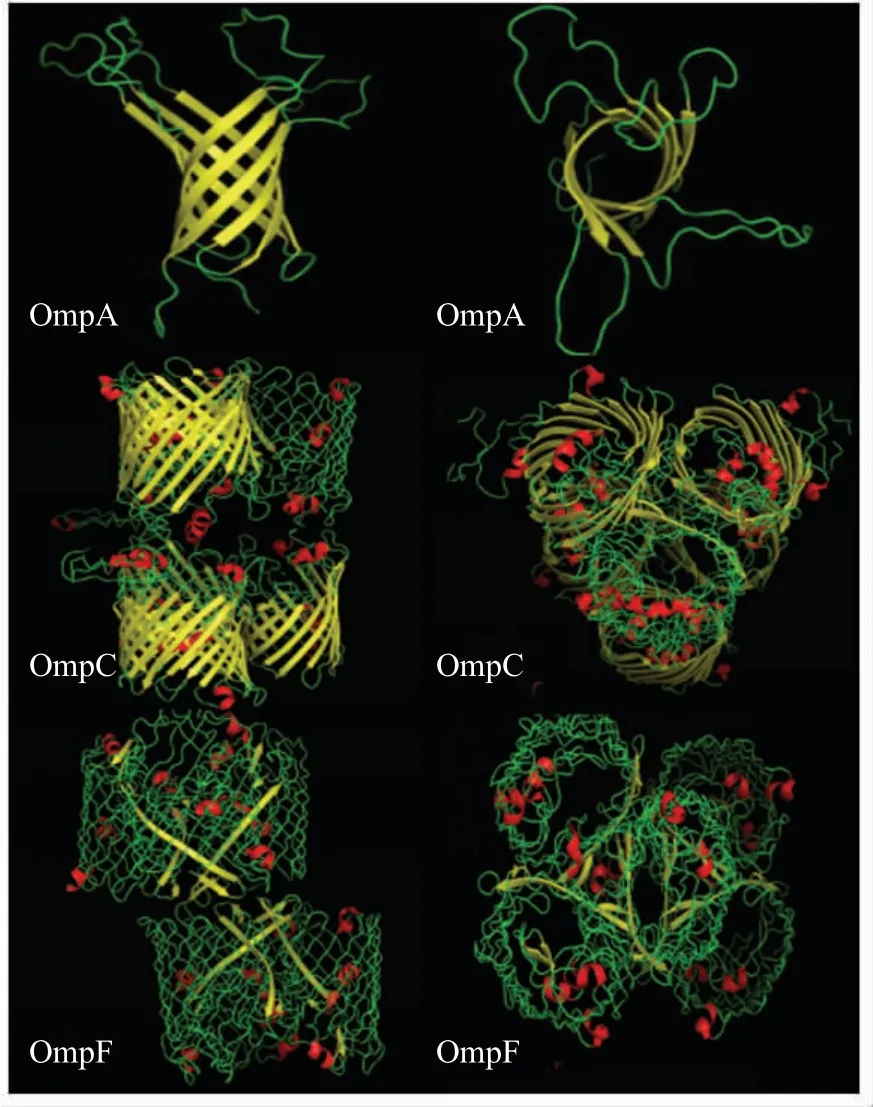
图1 Omp 四级结构图
2.2 诱导细菌产生耐药性 Omp 可以改变细胞外膜的通透性而诱导细菌耐药性的形成。大肠杆菌的Omp,特别是其中的主要蛋白决定细胞形状的遗传信息。近年来,随着异丙醇的长期和广泛使用导致细菌产生耐受性。Omp处于细菌的最外层,直接与外界环境相接触,对其展开深入研究是分析细菌对异丙醇耐受机制的一个重要方面,OmpA、OmpC、OmpF 均是细菌耐受异丙醇重要的Omp。OmpA 是一种跨膜蛋白,在维持细菌外膜结构和功能稳定方面也具有重要作用。有研究发现,在含有L-亮氨酸的培养基中,OmpA 缺失的大肠杆菌突变株无法形成新的外膜孔道,也不能产生酸敏感性,而野生株则相反。这是由于OmpA 缺失的突变株通常外膜功能不稳定,氨基酸的总转运效率随之下降,致使肽类及一些其它大分子产物无法转运,且F 因子介导的细胞接合功能也受到影响[10-11]。OmpA 是允许外界物质进入细胞内的非特异孔蛋白,它的表达量降低可以减少外界异丙醇进入细胞内[12-13]。Omp C为三聚体结构的非特异性孔蛋白,通过控制小分子的通透性,提高细菌对抗生素的耐药程度。一些异丙醇耐受试验表明EnvZ 感受外界渗透压的改变是整个双组份调节系统起功能作用最为关键的一步,并将该信号传递给Omp R引起Omp C 的表达上调,以增强大肠杆菌对异丙醇耐受性[14-15]。Omp F 的生理功能与孔蛋白引起的耐药性有着直接的关系。Omp F 对异丙醇的耐受性比Omp A 和Omp C都弱,但有研究构建了双重突变型(OmpC、OmpF 缺失)菌株,证明了OmpF 的丢失是大肠埃希菌对β-内酰胺类抗生素和氟喹诺酮类药物产生耐药性的原因之一[16-18]。因此更好地了解大肠杆菌中异丙醇耐受性与OMPs 之间的关系,对之后解决大肠杆菌异丙醇耐受性问题提供很大的帮助。
2.3 Omp调节细菌的生物被膜形成 细菌为了抵抗外界不良应激而进化出一系列的调节适应环境机制来形成稳定的生物被膜[20-21]。OmpA 在细菌物种中是高度保守的。这种蛋白质是多功能的,具有多种体外和体内生物学特性,其已被证明参与生物膜形成。有研究表明由于OmpA在细菌外膜中的高丰度,以及从细胞突出的4 个短环结构可能在细菌生物膜中起作用[17]。而外膜孔蛋白OmpC 和OmpF 的表达可通过组氨酸蛋白激酶EnvZ/OmpR 双组份信号调节系统,对环境中的渗透压信号做出响应,形成生物被膜。
2.4 Omp促进细菌的黏附和侵袭能力 大肠杆菌的Omp有助于细菌借助于菌毛吸附于宿主的细胞,从而引起病原体的内转和侵入(表1),或者引起细菌的外部产物如肠毒素等物质释放到真核细胞的表面[19]。Omp 有助于大肠杆菌通过防御屏障,目前在脑膜炎大肠杆菌的研究中,侵袭相关Omp 近年来在禽致病性大肠杆菌中时有发现[20]。帅领等人发现OmpA+株对脑微血管内皮细胞的侵袭力比OmpA-菌株高40 倍左右,多克隆微量OmpA 抗体能抑制OmpA+菌株大肠杆菌对血脑屏障的侵袭[18]。另外有研究表明OmpA 是尿道致病性大肠杆菌发病(UropathogenicEscherichia coli,UPEC)机制中的关键参与者,但是使用小鼠尿路感染模型证明了OmpA 基因的缺失并未破坏UPEC对尿道上皮细胞的粘附和侵袭,OmpA 在UPEC 侵袭上皮细胞后起作用,促进细胞内细菌群落(Intracellular bacterial community,IBC)成熟[21]。根据Hejair HMA 等的研究表明与野生菌株相比,OmpF 和ompC 的缺失株在体外对小鼠脑微血管内皮细胞(Brain microvascular endothelial cells,BMEC)bend.3 细胞的黏附性显著降低,在体外对BMEC bend.3 细胞的侵袭能力也显著降低[22]。这表明OmpF 和OmpC 的缺失可能降低了细菌的粘附,侵袭能力。有些毒力因子自身没有毒性,如果为其提供一个通道或载体作用于宿主,就能让其产生毒力。
2.5 Omp 受体 大肠杆菌侵袭的过程是由多个因子决定的。通过电镜观察发现侵袭进入细胞的大肠杆菌由质膜小泡包裹,且在细胞质、细胞间隙、胞间连接处均未发现游离的大肠杆菌,这些结果表明大肠杆菌和细胞表面受体结合,并以细胞转运的方式侵袭。BMEC 中的受体是与gp96 同源的内皮细胞(Ecgp)。Ecgp 是一层位于内皮细胞腔面的由蛋白多糖、葡聚糖和糖蛋白组成的多功能层,糖蛋白被膜的脱落,会增加BMEC 对生物大分子的通透性,介导参与多种疾病过程[23]。大肠杆菌毒力因子与BMEC表面受体结合,触发并激活特异性的信号转导通路,从而引起细胞骨架重排。表达OmpA 的大肠杆菌可首先介导FAK 的酪氨酸磷酸化,其次是其下游分子桩蛋白和PI3K,进而导致BMEC 与细菌结合部位F-肌动蛋白凝聚化的形成,从而导致细胞骨架重排[24]。
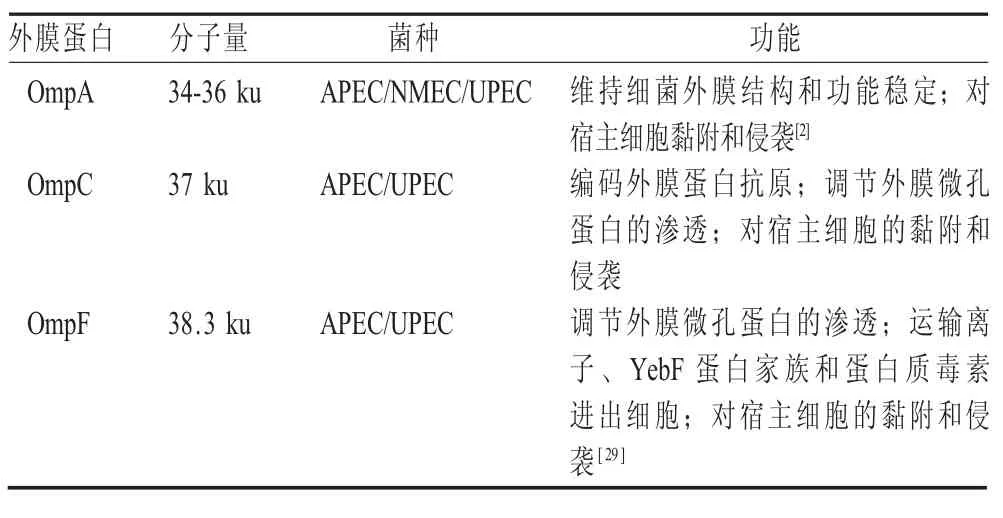
表1 ExPEC 主要外膜蛋白的生物学功能
3 Omp免疫原性
Omp除了与细菌的代谢和毒力有关外,其免疫原性也越来越受到人们的重视。许多革兰氏阴性菌Omp 可作用于参加免疫反应的细胞,刺激机体产生保护性免疫。目前,对于大肠杆菌Omp 的免疫保护功能研究较多。大量试验证明,Omp 具有良好的免疫原性,不仅可以刺激机体的体液免疫,而且对细胞免疫也有刺激作用,并且可通过遗传工程技术大量表达[25-26],某些细菌的不同血清型间有相同的Omp 免疫原,可以产生交叉保护作用。大肠杆菌的OmpA 表现出免疫特性,其细胞外4 个环均具有免疫原性,并且已经证实其可以激活树突细胞和巨噬细胞产生细胞因子,并引起强烈的体液免疫反应[27]。同样孔蛋白OmpC 和OmpF 均可为高毒力菌株提供高度保护,防止致死性感染。此外,OmpC 和OmpF 均可诱导高滴度的IgG抗体,表明这两种蛋白均具有良好的免疫原性[28]。通过免疫产生的IgG1 和IgG2a 反映了免疫应答的类型,血清IgG1 与Th2 型反应相关,而血清IgG2a 与Th1 型反应相关,这在介导细菌调理吞噬作用方面效果显著。OmpC 和OmpF 引发高滴度的IgG2a,尽管低于IgG1,但也表明OmpC 和OmpF 可以诱导显著的Th1/Th2 免疫应答。这可能在某种程度上解释了OmpC 和OmpF 对免疫小鼠提供了抗ExPEC 感染的保护力[27]。
4 Omp在大肠杆菌病防治中的应用前景和展望
首先,Omp 与大肠杆菌耐药性有着密切的关系。其次,开发研制出的新型Omp 疫苗也将具有广泛的应用前景。Li 等人开发了一种新方法,将异种抗血清免疫蛋白质组学与免疫后的细菌攻毒试验相结合,以鉴定不同物种、属细菌家族之间的广泛交叉保护性抗原[29]。OmpA 属于肠杆菌科中高度保守的一类细菌蛋白,是宿主适应性免疫反应的靶点,特别是针对暴露于外膜表面的分子环的靶点,所以OmpA 是疫苗研究中的潜在抗原。来自其它革兰氏阴性菌的OmpA 同源物已经作为疫苗进行了测试。例如,最近完成了含有OprF (OmpA 同系物)的铜绿假单胞菌疫苗IC43 的II 期临床试验。另外最新发现了一种保护性抗原PA0833,其被鉴定为OmpA、OmpC 样蛋白,PA0833 已经被证实在小鼠败血症和肺炎模型中具有保护功效,是用于疫苗开发的有希望的抗原[30]。Liu 等研究表明ExEPEC 的孔蛋白OmpC 和OmpF 可以提供高度保护,抵抗高毒力菌株PCN033 的致死性感染[27]。表明暴露在外膜表面的OmpC 和OmpF 可能成为针对ExPEC 感染疾病的侯选疫苗。而且最近的研究表明,结构生物学在疫苗设计中发挥着越来越大的作用[31],基于蛋白质的3D 结构更容易发现安全,具有保护性、稳定性的抗原。所以根据Omp 的细胞外环结构来设计预防肠道外致病性大肠杆菌的疫苗是新的思路和方向。
