PmOmpA的结构与功能研究及其在疾病防控中的应用
2019-08-19林泽锋黄兰香雷桂花彭远义
林泽锋,黄兰香,雷桂花,李 攀,彭远义
(西南大学动物科技学院,重庆北碚400715)
多杀性巴氏杆菌(Pasteurella multocida,Pm)是一种条件性致病菌,属革兰氏阴性菌,分为A、B、D、E 和F 5个荚膜血清型和16 (1~16)个LPS 血清型[1]。对其分型时常将两种方法组合使用,如A:1,B:2 分型等。其中A:1或A:3 主要引起禽霍乱或牛呼吸系统疾病,B:2 或E:5 主要引起出血性败血症(Haemorrhagic septicaemia,HS),D型主要引起猪萎缩性鼻炎(Atrophic rhinitis,AR)[1-2]。Pm还能够感染宠物、野生动物和人[3]。畜禽感染Pm 后,引起高发病率和死亡率,给养殖业造成重大的经济损失。
外膜(Outer membrane,OM)是革兰氏阴性菌抵御外来攻击和选择性渗透亲水性小物质的非对称性屏障[4]。外膜蛋白(Outer membrane proteins,OMPs)作为OM 的重要成分,约占OM 质量的50%,具有参与细菌-宿主间的相互作用、选择性渗透和适应外部环境等功能[4]。结合电泳和质谱分析,共筛选到35 个Pm OMPs[3]。目前研究较多的Pm OMPs 有OmpA、OmpH、TolC、plpE 等[3]。Hatfaludi等根据功能将Pm 72 个OMPs 和OM 相关蛋白分为结构蛋白、转运蛋白、结合蛋白、粘附蛋白、外膜蛋白组装蛋白和膜相关酶6 类,其中Pm 外膜蛋白A (Pasteurella multocidaOuter membrane protein A,PmOmpA)属于结构蛋白[4]。
PmOmpA 在维持细菌形态和结构完整性、细菌-宿主间相互作用、生物被膜形成和物质交换等方面发挥重要作用;同时还诱导机体产生免疫应答和承受宿主选择性压力,因此常作为重要的疫苗候选抗原和流行病学短期跟踪研究的靶标[5-6]。本文将对PmOmpA的结构和功能,其作为疫苗候选抗原和流行病学靶标的相关研究进行综述,以期为Pm 病的防控、新型疫苗研制和流行病学调查提供参考。
1 PmOmpA的结构
关于细菌OmpA 结构研究最多的是大肠杆菌OmpA(EcOmpA),其可能存在小通道构象、大通道构象和二聚体3 种结构[7-8]。但关于PmOmpA 只有小通道构象的报道[9],尚无关于其大通道构象和二聚体的文献。利用SWISSMODEL[9]以EcOmpA N 端(SMTL id:2ge4.1.A)和C 端(SMTL id:2mqe.1.A)为模板分别模拟构建小通道构象PmOmpA N 端和C 端的3D 结构(图1);利用DNAMAN 8[10]对7 个OmpA 家族蛋白PmOmpA、EcOmpA、鲍曼不动杆菌OmpA (AbOmpA)、猪放线杆菌OmpA (AsOmpA)、溶血性曼氏杆菌OmpA (MhOmpA)、鼠疫耶尔森氏菌OmpA(YpOmpA)和流感嗜血杆菌P5 (P5)的氨基酸序列进行比较分析(图2),结果显示OmpA 氨基酸序列同源性高达55.07 %。
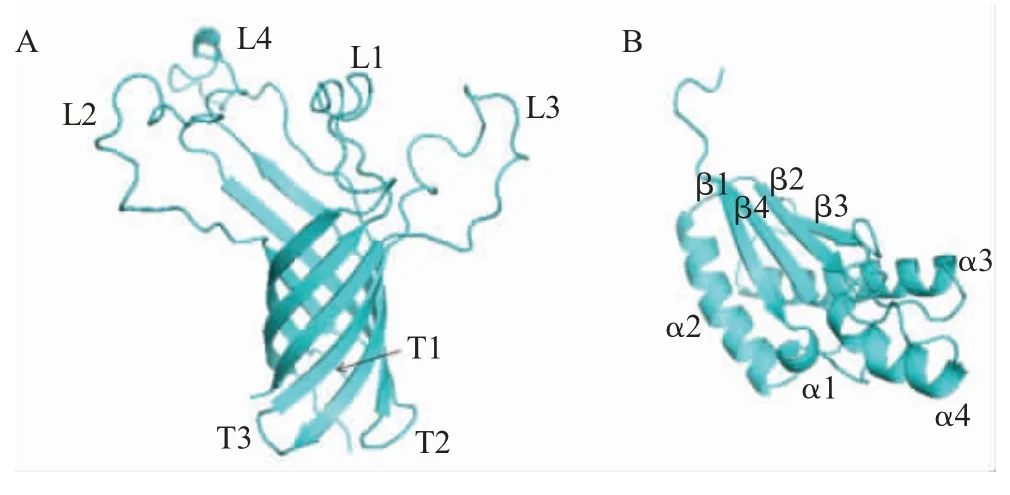
图1 模拟构建PmOmpA N 端(A)和C 端(B)的3D 结构
1.1 PmOmpA 小通道构象 小通道构象PmOmpA 包含N 端和C 端两个结构域(图1)。依据aa176 ~aa187 的Ala-Pro 重复,将EcOmpA 分为N 端和C 端两个结构域,N 端锚定在OM,C 端位于周质腔内[11]。目前并不清楚PmOmpA 为何缺失Ala-Pro 重复,其缺失可能会影响PmOmpA 的组装及孔通道形成[11]。
PmOmpA N 端约含213 个氨基酸残基。aa1~aa21 为信号肽、信号肽酶切割位点Ala21~Ala22/Val22[12](图2)。N 端由8 个β-桶状分子反向平行构成β-桶状结构,在OM 外形成4 个亲水环状结构(L1~L4),在周质腔形成3个转角结构(T1~T3)[12](图1A 和图2)。β-桶状结构拥有非极性外表面和极性内表面[12-13]。β-桶状结构外表面的芳香族氨基酸和碱性氨基酸分别与OM 脂质头部和磷酸基团相互作用,将PmOmpA 锚定在脂膜中[13]。内表面构成亲水性通道,选择性渗透亲水性小分子物质[12]。PmOmpA拓扑结构预测显示,其最长的环状结构L3 含21 个氨基酸[11]。缺失或突变状环结构不影响β-桶状结构的组装,但在转角结构插入几个氨基酸将降低β-桶状结构的稳定性[14]。
PmOmpA C 端约含135 个氨基酸残基。C 端的4 个α螺旋和4 个β 折叠构成βααβαβαβ 混合结构(图1B 和图2)。包括PmOmpA 在内的OmpA 家族C 端中与R286、D271 和K192 等位的氨基酸、NX2LSX2RAX2VX3L 区域、bulge 结构以及二硫键均是保守的(图2),但AbOmpA bluge 结构是不保守的,且不含二硫键。
1.2 OmpA 大通道构象 EcOmpA 大通道构象由小通道构象的C 端插入OM 与N 端共同构成含16 个β-桶状分子的β-桶状结构[7,15]。温度、二硫键C290-C302 (图2)和N 端的寡聚-(R)-3-羟基丁酸修饰是形成大通道的关键[15]。温度高于37 ℃时,EcOmpA 小通道构象不可逆地转化成大通道构象,推测大通道构象是最终构象,而小通道构象仅是过渡态[15]。虽然目前尚未有关大通道构象PmOmpA的报道,但其也拥有关键的二硫键(图2),推测升高温度后PmOmpA 也能够形成大通道构象。
1.3 OmpA 二聚体 Tan 等发现,EcOmpA C 端间可以形成二聚体,稳定EcOmpA 结构[16]。Ishida 等发现温度(≥37 ℃)是EcOmpA 二聚化的关键因素,高温通过降低C 端bulge 结构(图2)的稳定性,激发EcOmpA 二聚化[15]。在EcOmpA 二聚体的维持中,K192 与E310、E312 间的盐桥、Q190、Q223 和N288 的非特异极性作用、N 端环状结构L1、L2 和L4 间的极性作用和疏水性作用以及β-桶状分子中的芳香族氨基酸均发挥一定的作用[7]。Marcoux等发现K192 的作用尤为重要,K192 突变为A192 后,大部分EcOmpA 以单体形式存在[8]。目前尚无PmOmpA 二聚体的报道,但其拥有相似的bulge 结构和与K192、E310 等位的氨基酸(图2),推测其也能形成二聚体结构。温度(≥37 ℃)是形成二聚体和大通道构象的重要因素,因此Ishid 等猜测在该温度的激发下二聚体最终将转化为大通道构象[15]。
多序列比对7 个OmpA 家族蛋白:PmOmpA、EcOmpA、AbOmpA、AsOmpA、MhOmpA、YpOmpA 和P5。↓表示PmOmpA 信号肽酶切割位点;T1~T3 和L1~L4 分别表示PmOmpA N 端的转角结构和环状结构;β1 ~β4 和α1~α4 分别表示PmOmpA C 端的β 折叠和α 螺旋;和分别表示起始于周质腔和OM 外的假定β-桶状分子;------表示保守的NX2LSX2RAX2VX3L 序列;▲表示PmOmpA D272 和R287 位置,分别与AbOmpA D271和R286 等价;矩形框表示可能的bulge 结构;表示C 端形成的二硫键;★表示EcOmpA Q190、Q223 和N288;◆表示EcOmpA K192;表示EcOmpA E310 和E312;表示EcOmpA K267、K294 和D291。

图2 利用DNAMAN 8 多序列比对PmOmpA 和其它OmpA 家族蛋白的氨基酸序列
2 PmOmpA 的功能
2.1 维持细菌形态和结构完整性 目前认为细菌OmpA最主要的功能是与肽聚糖非共价结合,维持OM 稳定和细菌结构的完整性。缺失AbOmpA 会改变细胞壁结构,降低细菌的稳定性[17]。
Koebnik 等研究显示,EcOmpA C 端中可能与肽聚糖相互作用的保守氨基酸,位于α-螺旋一侧NX2LSX2 RAX2VX3L(图2 显示为α3 螺旋)[15]。Park 等发现,AbOmpA C 端高度保守的R286 和D271 与肽聚糖二氨基庚二酸(m-DAP)的羧基和/或氨基形成盐桥[17]。Tan 等通过鼠伤寒沙门氏菌OmpA (StOmpA)晶体结构发现了肽聚糖结合槽,该肽聚糖结合槽由C 端α 螺旋α1、α2 和α3以及连接结构α1~α2、β2~α3 和α4~β4 构成[16]。肽聚糖结合槽的发现,进一步佐证了NX2LSX2RAX2VX3L 和R286 与D271 的作用。图2 显示,R286 位于α3 螺旋的NX2LSX2RAX2VX3L 序列,D271 位于β2 ~α3,均位于肽聚糖结合槽中。PmOmpA 也含有相似的NX2LSX2 RAX2VX3L 序列、与D271 和R286 等价的氨基酸位点以及与肽聚糖结合槽相似的结构,推测PmOmpA 也能与肽聚糖非共价结合,参与维持OM 稳定和细菌结构的完整。
Carpenter 等发现低盐环境中,由于PmOmpA C 端K205 和E236 分别与OM 磷脂和胆碱静电吸引,C 端即靠近OM;而高盐环境(1 mol/L NaCl)中,Na+和Cl-屏蔽脂质分子和C 端氨基酸的电荷,降低静电吸引,C 端即远离OM[13]。Samsudin 等发现EcOmpA C 端也能与OM 结合,其认为C 端与肽聚糖结合时,OM 与C 端间的静电吸引会扭曲肽聚糖的结构,破坏细胞壁的完整性[18]。
虽然单体EcOmpA 会扭曲肽聚糖的结构,但EcOmpA二聚体却能避免该情况。Marcoux 等发现二聚体结构能稳定EcOmpA 的整体结构,并推测其能够增强与肽聚糖的结合[8]。后来Samsudin 等发现,EcOmpA 二聚体通过增加C 端底部的负电荷和延伸N 端与C 端的连接结构,促进C 端与肽聚糖的结合[19]。Ortiz-Suarez 等发现EcOmpA 二聚体还能降低介导OM 和C 端结合的aa280~aa300 位的灵活性和接触面,阻止C 端与OM 的结合,从而增强OM的稳定性和细菌结构的完整性[7]。基于PmOmpA 可以形成二聚体结构,推测PmOmpA 也能通过增加C 端底部的负电荷、延伸N 端与C 端间的连接结构和降低C 端中与OM 结合的氨基酸的灵活性和接触面,促进PmOmpA 与肽聚糖的结合。
2.2 细菌-宿主间相互作用 Dabo 等利用抗PmOmpA抗体预处理Pm 后,降低了细菌对细胞基质中纤连蛋白(Fn)的粘附性[11]。他们也确实在环状结构L2 中发现了2个K/R-X-K/R HP 结合位点。而重组表达的rPmOmpA 蛋白不仅能与Fn 结合,还能与MDBK 细胞和细胞基质的肝素(HP)结合[11]。但只有未经热处理的rPmOmpA 能结合HP,而热处理的rPmOmpA 不能结合HP,表明构象影响PmOmpA 与HP 的结合[11]。而Shailja 等发现含不同亚型PmOmpA 的牛源Pm 与宿主的相互作用强度也不相同,OmpA allele(I)型Pm 对MDBK 细胞的粘附侵袭能力和对小鼠的定殖能力和致病性均高于OmpA allele(Ⅱ)型Pm[20]。
关于PmOmpA 与宿主相互作用的位点,目前仅证实了HP 的结合位点,但通过预测还发现了其它可能的结合位点。E-Kobon 等预测牛源菌株PmOmpA 环状结构L1~L3 的带电氨基酸可能与宿主特异性结合有关,而猪源菌株却无该现象,推测这些带电氨基酸不参与引起猪慢性肺炎[18]。Verma 等在PmOmpA C 端中发现了10 个可能参与Pm 粘附和侵袭的保守氨基酸,并发现了Arg-Gly-Asp(RGD)结构域,该结构域能与宿主受体特异性结合,促进细菌的粘附[12]。依据Stathopoulos 提出的大通道构象,E-cOmpA C 端会在OM 外形成环状结构[7,15]。推测PmOmpA在形成大通道构象时,C 端RGD 结构域会裸露在OM 外,参与细菌-宿主间的相互作用。
2.3 生物被膜形成 Kubera 等发现能够结合PmOmpA 环状结构或环状结构间的药物,这些药物虽然不会影响已形成的生物被膜,但能够有效抑制生物被膜的形成[1]。Orme等发现大肠杆菌在形成生物被膜时,EcOmpA 呈高水平表达[21]。Viviana 等发现AbOmpA 的过表达与鲍曼不动杆菌引起的肺炎、菌血症和死亡有关[22]。本研究室发现,在小鼠体内,Pm 强毒株PmCQ2 PmOmpA 表达量高于弱毒株PmCQ6,而体外结果却是相反的[23]。推测高水平表达PmOmpA 能够促进Pm 生物被膜的形成和粘附,增强Pm的致病性。生物被膜在为细菌提供营养物质、群体感应、耐药和定植等方面发挥重要作用[24]。因此可以将PmOmpA 作为候选药物靶标,治疗巴氏杆菌病。
2.4 物质交换 在大肠杆菌OMPs 中,OmpA、OmpF 和OmpC 孔通道直径相似,但由于OmpA β-桶状结构内的盐桥网能够控制通道的开放和关闭,因此OmpA 控制物质进出的速率比后两者低两个数量级[7,13,25]。Carpenter 等发现PmOmpA β-桶状结构内也可以形成类似的盐桥网,其中盐桥R156~E58 和E146~K93 关闭孔通道,而氨基酸的质子化或去质子化会改变盐桥结合状态,形成新的盐桥R156~E146 和E58~K93,开放孔通道[13]。在大肠杆菌中,虽然OmpF 的转运速率快于OmpA,但研究显示OmpA 却能够转运分子量更大的物质[25]。EcOmpA 大通道构象解释了OmpA 为何能够转运更大物质,但由于大通道构象的存在尚有争议,因此大通道构象转运更大物质的假设尚未有定论。有研究显示,其它OmpA 还参与细胞毒性因子分泌[26]、dsDNA 转运[27]以及氨基酸摄取[15]。虽然PmOmpA 尚无该方面的报道,但推测PmOmpA 也能够参与多种物质的转运,促进细菌的致病性或发挥生理功能。
3 作为疫苗候选抗原
PmOmpA 是暴露在OM 外的高免疫原性蛋白,能够诱导机体产生免疫应答,常作为重要的疫苗候选抗原[28]。E-Kobon 等发现N 端环状结构L1~L3 和L1 可能分别为牛源和部分猪源Pm 的抗原表位[5]。Gong 等发现Pm pOmpA DNA 疫苗能够诱导Th1 型免疫应答和高水平抗体滴度,为禽提供部分保护作用;pOmpA+pOmpH 二价疫苗和pOmpHA 融合疫苗也能够提供比弱毒疫苗更强的保护作用[28]。而Dabo 等发现,rPmOmpA 虽然能够诱导Th2 细胞产生强劲的免疫应答和高滴度IgG1,但不能为小鼠提供免疫保护,添加rPmOmpA 反而降低OMPs 的免疫保护效果[29]。抗PmOmpA 单克隆抗体也不能提供保护作用[4,28]。因此,Gong 等认为PmOmpA 的免疫效果尚不确定[28]。
4 作为流行病学研究靶标
受不同宿主选择性压力影响,OMPs 呈不同程度的异质性[5]。PmOmpA 短期内不会发生剧烈突变,但由于其突变率高于看家基因,因此常作为流行病学短期跟踪的研究靶标[5-6]。
Davies 等根据OmpA 与OmpH 分子质量的异质性和次要蛋白间的差异,将Pm 菌株分为不同的OMP 型[30-33]。结合荚膜血清型与OMP 型,显示F/1.1、F/1.2、D/3.1 和D/3.2 菌株主要与绵羊肺炎有关,分离自健康母羊生殖道的主要是A/1.2、F/1.1 和F/2.1 菌株[33]。88 %的猪肺炎由不含毒素的OMP 型1.1、2.1、3.1 和5.1 的A 型菌株以及不含毒素的OMP 型为6.1 的D 型菌株引起,76 %的猪萎缩性鼻炎(PAR)由含毒素的OMP 型4.1 的D 型菌株和含毒素的OMP 型6.1 的A 型菌株引起[30]。将Pm 宿主源性和OMP 型结合得到16 个OMP 组,分析显示4 组OMP菌株会在牛、猪和禽之间相互传播,16 组OMP 菌株会在猪和禽间传播,而大部分禽源(1、2、5、10、12 和13 组OMP)、牛源(1、6、9、11 和14 组OMP)、绵羊源(2、3和15 组OMP)和猪源(1、2、5 和8 组OMP)菌株不会在宿主间传播[32]。OMP 型无法区分引起禽霍乱的菌株,这与禽源Pm 适应多种生态位有关[31]。也无法用OMP 型区分牛源Pm 所引起的疾病和地域来源,但85 %的菌株OMP 型为1.1、2.1、3.1、4.1 和6.1 (共13 个OMP 型)[32]。
虽然OMP 型在一定程度上能够反应Pm 菌株间的差异,但不能直观显示不同血清型或不同宿主源菌株PmOmpA 核苷酸序列或氨基酸序列间的差异,因此利用PmOmpA 核苷酸序列或氨基酸序列对Pm 进行分型,追踪菌株的宿主源是有必要的。Singh 等发现A 型菌株OmpA与B:2 菌株的氨基酸序列和核苷酸序列的同源性分别为83.8 %和80 %[34]。且A 型Pm PmOmpA 核苷酸序列比B型菌株的短[12]。Vougidou 等将PmOmpA 核苷酸序列分为11 个基因型(ompA1~ompA11),发现ompA4、ompA5 和ompA7 为牛源菌株的主要基因型,羊源菌株基因型主要为ompA8 ~ompA11,猪源菌株基因型主要为ompA1 ~ompA3,但发现1 株牛源和2 株羊源菌株的基因型与猪源菌株的更近[6]。Verma 等依据PmOmpA 氨基酸序列将Pm分为Ⅰ~Ⅶ4 个组,每个组包含若干OmpA 型,如Ⅰ组含1.1~1.4 4 个OmpA 型[12]。该组大部分为牛源菌株,但2 株兔源和1 株羊源菌株属于1.2 型,1 株羊源菌株属于1.3 型。Ⅶ组中OmpA 7.2 型由3 株禽源和1 株牛源菌株组成。基于PmOmpA 核苷酸序列和氨基酸序列的聚类,Teerasak 等发现猪源(P1~P4)和牛源(C1、C2)菌株均属于各自的分支,除牛源菌株1C 和12C 属于猪源分支,表明1C 和12C 原来的宿主为猪[5]。Teerasak 等进一步根据PmOmpA 高突变环状结构的氨基酸序列将Pm 分为30 个LST 型,牛源菌株主要属于LST19 和LST8,猪源菌株主要属于LST12(P1)、LST15(P2)和LST18(P3)[5]。其中,LST12 和LST15 的猪源菌株荚膜血清型为A 型,LST18的猪源菌株则为D 型,表明PmOmpA LST 分型可以用于区分猪源Pm 的不同血清型。
5 展 望
Carpenter 等模拟构建了PmOmpA 小通道构象[13],而PmOmpA 二聚体和大通道构象仍停留在推测阶段。因此,可借鉴晶体学和波谱学等方法,研究PmOmpA 小通道构象、二聚体和大通道构象的结构。蛋白结构决定其功能,但并不能完全表明蛋白在细菌中的作用。可以通过基因敲除技术,深入研究PmOmpA 的生物学功能。
PmOmpA DNA 疫苗能够同时诱导体液免疫和Th2 细胞应答(细胞免疫),并且提供有效的保护作用[19]。而rP-mOmpA 蛋白仅能够诱导Th1 细胞应答(体液免疫),且不提供有效的保护作用[4]。提示PmOmpA DNA 疫苗是通过诱导宿主的细胞免疫发挥抗感染作用,而体液免疫可能不参与该过程。与PmOmpA 同源的P5 蛋白,其N 端环状结构L4 为能够诱导产生抗体却不能提供保护作用的诱骗型表位[21]。因此,推测PmOmpA 可能含类似的诱骗型表位,参与逃避宿主的免疫应答。所以,含PmOmpA 的DNA 疫苗、OMVs 疫苗、OMPs 疫苗和全菌灭活疫苗等,可能会因此降低疫苗的保护效果。优化PmOmpA 抗原表位或者制备不含PmOmpA 的疫苗,可能会得到更好的保护效果。
PmOmpA 作为流行病学短期跟踪研究靶标,将Pm 分为多个与宿主存在一定联系的亚型,并发现可能发生宿主转移的菌株。但若转移后菌株的PmOmpA 适应了新宿主的选择性压力,仅依靠PmOmpA 分型是无法追踪Pm 真正的宿主来源。因此,将PmOmpA 分型结合MLST 分型和/或基于基因组的遗传进化分析,能够更好地追踪Pm的宿主源及研究其适应性突变。
