五种基于CHD基因的性别鉴定方法对雀形目鸟类有效性的实验评估
2019-08-19李显达邢晓莹徐艳春
苏 倡 李显达 邢晓莹 李 波,3 马 跃,3 吴 伟 徐艳春,3*
(1.东北林业大学野生动物资源学院,哈尔滨,150040;2.黑龙江中央站黑嘴松鸡自然保护区管理局,嫩江,161499;3.国家林业和草原局野生动植物检测中心,哈尔滨,150040)
性别鉴定是鸟类研究工作的一项基础工作[1],在种群监测、行为研究、性比分析、婚配系统分析、引种繁育、饲养管理、疾病防治和遗传进化等诸多方面都具有十分重要的作用[1-2]。全世界现存的9 800多种鸟类中有50%的物种是单态型鸟类[3],表现为雌雄体色十分相似,通过羽色、体尺等形态学指标判定其性别比较困难。人们根据经验建立了一些方法来判别单态型鸟类的性别,例如:体尺测量、鸣声判定、翻肛鉴别、腹腔镜检、类固醇鉴定和核型分析等[2]。这些方法中,如体尺、鸣声、类固醇水平等方法可靠性差;翻肛鉴别、腹腔镜检和核型分析等方法要么耗时长,价格昂贵,操作过程繁琐,要么对鸟类健康带来伤害,甚至危及生命[4-5]。鸟类性别鉴定的困难为鸟类学研究和监测工作带来了很多不便[6]。
鸟类性染色体上存在着哺乳动物对应的染色体螺旋蛋白结合基因(CHD)[7],该基因在Z染色体和W染色体上的同源序列之间外显子高度保守,而内含子序列和大小差异很大[7]。由于大多数鸟类性染色体表现为雄性同配(ZZ型)、雌性异配(ZW型),所以雄鸟只有CHD-Z基因,而雌鸟有两个同源拷贝即CHD-Z和CHD-W[3]。根据这个特性,在内含子两侧的保守序列上设计PCR引物,Z染色体和W染色体上的扩增产物会表现出片段大小的差异,借此可判断鸟类性别[3,8]:有一个条带的为雄性个体,有两条大小不同条带的为雌性个体。
根据这一原理,Griffiths等设计了鸟类性别鉴定引物P2、P3,通过PCR扩增的方法成功鉴定了野生金刚鹦鹉(Cyanopsittaspixii)的性别[9]。因为这一鉴别采用的 PCR策略具有鉴定快速、特异性高、通用性高、取材容易且采样量小等优点[10],在后来的鸟类性别鉴定中被广泛采用[11]。
雀形目(Passeriformes)有5 700余种,占全世界现存鸟类种数的60%[12],单态型鸟类很多,通过体色和体型等外部特征鉴定其性别比较困难。因而,CHD基因的PCR方法就成为单态型鸟类性别鉴定的主要方法[11,13-15]。但是由于雀形目种类繁多、适应辐射极广[16],且数量庞大,所以基因的变异较多,经常因为PCR引物通用性不够而导致部分物种甚至部分个体的CHD基因很难扩增[17]。目前,文献报道较多的有5对CHD基因通用引物用于雀形目鸟类性别鉴定,包括P2/P8[3]、2550F/2718R[18]、CHD1F/CHD1R[15]、sex1’/sex-mix[11]和IntP2/IntP8[17](表1)。文献中都明确阐述了这些方法的有效性,但在实际工作中,效果并不很理想。在森林鸟类环志和种群监测中,主要单态型雀形目鸟类采用这些方法是否有效还不清楚。本研究以柳莺科(Phylloscopidae)、鹡鸰科(Motacillidae)和岩鹨科(Prunellidae)鸟类为对象,评估了上述5对引物在其性别鉴定中的有效性,为这些鸟类种群性别结构分析提供借鉴。

表1 5对引物成功鉴定性别的雀形目鸟类信息Tab.1 Application of five universal PCR primer pairs of CHD gene for sexing Passerine birds

续表1
注:文献中一些种类的科的划分与《中国鸟类分类与分布名录》(第三版)[20]稍有差异
Note:Family affiliation of some species in these cited literatures is different from the present used taxonomy described inAChecklistontheClassificationandDistributionoftheBirdsofChina(third edition)[20]
1 材料与方法
1.1 材料
实验所需样品大部分来自黑龙江高峰鸟类保护环志站(49°06′N,125°15′E)和东北林业大学帽儿山鸟类环志站(45°24′N,127°39′E)。在鸟类环志工作的同时,采用雾网捕捉的方法在野外捕捉雀形目鸟类共6种214只,分别为树鹨(Anthushodgsoni)20只、棕眉山岩鹨(Prunellamontanella)35只、黄眉柳莺(Phylloscopusinornatus)76只、黄腰柳莺(Ph.proregulus)36只、褐柳莺(Ph.fuscatus)20只和灰脚柳莺(Ph.tenellipes)27只。这6种鸟类均为单态型,表现为雌雄同色[21],依靠形态学方法不能有效区分其性别。环志过程中,将鸟从雾网上取下,完成戴脚环、体尺测量、称重、记录后,用洁净的镊子从其胸腹部不同位置拔取3—5根廓羽[5,22],不影响其体形轮廓,然后放飞。将羽毛置于纸质样品袋中,标记采集时间、环号等信息,室温干燥保存。此外,国家林业和草原局野生动植物检测中心惠赠了20只柳莺科及棕眉山岩鹨死体(表2)。将每只个体剖开腹腔,探查卵巢和睾丸等器官,判断其性别,然后采集肌肉组织少许,提取DNA,考察每对引物扩增的正确性。

表2 20只性别鉴定阳性对照鸟类信息Tab.2 The information of 20 birds used as positive control in sexing experiments
1.2 总DNA的提取与PCR扩增
用灭菌的解剖剪剪取羽毛基部2 mm[5,22],置于1.5 mL离心管中,加入消化液:310 μL TNE buffer(pH=8)、20 μL蛋白酶K(10 mg/mL)、20 μL 1mol/L DTT,56℃恒温消化过夜,直至羽根完全溶解,用DNA提取试剂盒(AxyPrep Biosciences,杭州)提取总DNA。提取肌肉组织的DNA时,取肌肉组织 50 mg 于1.5 mL 离心管中,用灭菌的眼科剪将其剪成碎块,依次加入消化液:295 μL TNE buffer(pH=8)、25 μL蛋白酶K(10 mg/mL)、35 μL 10%SDS溶液,56℃水浴消化1 h以上,再用相同的方法提取总DNA。
提取的DNA用NanoPhotometer-N50超微量紫外分光光度计(德国Implen公司)测量浓度,统一稀释到约10 ng/μL的浓度备用。
PCR反应在10 μL体系中进行,包括正反向引物各0.2 μL(10 μmol/L)、2×EasyTaq SuperMix(Transgen,北京)5 μL、ddH2O 1.8 μL、DNA模板3 μL。阴性对照采用ddH2O为模板,其余组分完全相同。扩增采用PE-9700型DNA扩增仪(PE,美国),反应程序为94℃/3 min预变性,94℃/30 s再变性,50℃/45 s退火(P2/P8,CHD1F/CHD1R,2550F/2718R退火温度为48℃,sex1’/sex-mix退火温度为50℃,IntP2/P8退火温度为51℃,退火温度也会因物种不同而做适当调整),72℃/50 s延伸,共循35次,最后72℃延伸10 min。扩增产物用2.8%的琼脂糖凝胶电泳分离(80V稳压,1 h),以DL1000 marker和DL2000 marker(Takara)为分子量标准估算扩增产物的大小,用凝胶成像仪拍照并记录实验结果[11]。
为了评估5对引物扩增的灵敏度,在性别已知的5种20只鸟类中找出同时满足以下两个条件的物种:一是该物种至少包含雌雄两个个体,二是5对引物均能稳定扩增这两个体的DNA。最终选定编号为10#和11#的褐柳莺雌雄个体。将其DNA稀释为7个浓度梯度,分别是20 ng/μL、10 ng/μL、5 ng/μL、1 ng/μL、100 pg/μL、10 pg/μL以及1 pg/μL。在10 μL的体系中,DNA模板的最终浓度分别是2 ng/μL、1 ng/μL、500 pg/μL、100 pg/μL、10 pg/μL、1 pg/μL以及0.1 pg/μL。用同样的电泳方法记录扩增结果。
2 结果
2.1 5对性别鉴定引物鉴定的正确率和成功率
用5对引物对性别已知的20只鸟类的DNA进行PCR扩增,比较PCR鉴定和解剖学鉴定的结果是否一致。结果如表3,P2/P8、sex1’/sex-mix和IntP2/IntP8在20只个体中的扩增成功率为100%,2550F/2718R有1只个体没有成功扩增,成功率为95%,CHD1F/CHD1R扩增的成功率最低,仅为70%。在正确率上,CHD1F/CHD1R、sex1’/sex-mix和IntP2/IntP8都有1只个体的PCR性别判定结果与解剖学判定的不同,错误率为95%。P2/P8和2550F/2718R 的错误率较高,分别为20%和15%。因此,sex1’/sex-mix和IntP2/IntP8的正确率和成功率最佳。

表3 5对引物性别鉴定的正确率Tab.3 Sexing correctness of five pairs of primers
2.2 5对引物PCR体系的灵敏度
灵敏度测试结果如图1、表4。引物P2/P8的体系在较高的DNA浓度条件下扩增产物电泳结果比较清晰、准确,呈现出雌性为2个条带,雄性为1个条带。但是当DNA浓度降低时,即使同一样品,重复实验时PCR扩增效果也不稳定,当模板DNA终浓度低于500 pg/μL时便无扩增产物检出。这一结果也与以往的一些研究相符[11]。引物CHD1F/CHD1R和2550F/2718R扩增体系的灵敏度相似,都表现出雄性单条带,雌性双条带。虽然在模板DNA浓度在10 pg/μL时也有扩增产物出现,但100 pg/μL以后扩增就不够稳定,电泳条带经常很淡,甚至不易辨认。引物sex1’/sex-mix体系的效果最好,扩增产物稳定,电泳结果清晰、准确。同时,在10 pg/μL的低浓度DNA条件下仍能显示出微弱但清晰可辨的条带。引物IntP2/IntP8扩增效果也很好,在100 pg/μL的DNA浓度下条带显示良好,但模板浓度低至10 pg/μL时则没有扩增条带。以上结果表明,引物sex1’/sex-mix扩增体系的灵敏度最高,IntP2/IntP8次之,CHD1F/CHD1R和2550F/2718R居中,P2/P8最差。
2.3 5对引物扩增成功率的大样本测试
根据灵敏度测试结果,在10 μL PCR反应体系中,采用10 ng DNA模板,在保证各对引物能够稳定扩增的前提下,用6个物种214只个体的大样本评估每对引物扩增的成功率。
如表5所示,引物P2/P8和CHD1F/CHD1R总扩增成功率仍然很低,均低于60%。P2/P8扩增片段长度为300—400 bp,在W染色体上扩增片段大于Z染色体的扩增片段;CHD1F/CHD1R与P2/P8相反,在CHD-W的扩增片段小于CHD-Z的扩增片段,两片段长度范围约为300—600 bp。
引物2550F/2718R扩增片段长度约为500—700 bp,CHD-W的扩增片段小于CHD-Z扩增的片段,总成功率为85%。但其W染色体扩增产物的条带经常不太清晰,表明2个片段扩增效率不平衡。使用该对引物扩增树鹨DNA时,除CHD-W和CHD-Z基因的扩增产物外,几乎所有个体均有1条250 bp左右的非特异性条带,但该条带对性别判定没有影响。

表4 5对性别鉴定引物扩增体系灵敏度的测试结果Tab.4 Sensitivity of PCR systems of five primers pairs for sex identification

图1 不同模板浓度下5对引物扩增体系的灵敏度Fig.1 Sensitivity of five pairs of primers amplifying a series of template concentrations 注:各电泳图中,奇数泳道为10#♀,偶数泳道为11#♂。模板浓度1、2泳道 为2 ng/μL;3、4泳道为1 ng/μL;5、6泳道为500 pg/μL;7、8泳道为100 pg/μL;9、10泳道为10 pg/μL;11、12泳道为1 pg/μL;13、14泳道为0.1 pg/μL;15泳道为阴性对照(ddH2O);M:marker DL2 000(TaKaRa) Note:In each electrophorogram,odd lanes are sample 10#♀ and even lanes are sample 11#♂.The concentrations of template are:Lane 1 and 2:2 ng/μL,Lane 3 and 4:1ng/μL,Lane 5 and 6:500 pg/μL,Lane 7 and 8:100 pg/μL,Lane 9 and 10:10 pg/μL,Lane 11 and 12:1 pg/μL,Lane 13 and 14:0.1 pg/μL.Lane 15 is negative control(ddH2O).M:marker DL2 000(TaKaRa)
引物sex1’/sex-mix的总扩增成功率97%,两个扩增产物的电泳条带均比较清晰。两片段长度为250—300 bp,CHD-W扩增片段大于CHD-Z扩增片段。但部分黄眉柳莺雌性个体的CHD-W片段有优先扩增现象,致使一部分个体的电泳图上所见CHD-Z片段条带偏粗或在250 bp大小的区段存在2条相距很近的条带。
引物IntP2/IntP8总扩增成功率63%,CHD-W扩增片段大于CHD-Z扩增片段,两片段长度为250—300 bp。
3 讨论
性别鉴定中,某种方法是否具有实用意义主要看3个方面的表现:鉴别的正确率、PCR反应的灵敏度和鉴别的成功率。正确率显然是第一重要的,一种方法不能有足够高的正确率,将会对种群性比的估算带来偏差,如果选择繁殖个体,则可能错误地选择了同性个体。正确率未知的情况下,这些偏差是无法纠正的。
本研究的评估显示,在20只已知性别的个体中,引物sex1’/sex-mix和IntP2/IntP8的正确率最高,均达到了95%,引物P2/P8和2550F/2718R次之,均为80%,而引物CHD1F/CHD1R的正确率最低,仅有65%(表2)。这些错误主要来自CHD-W或CHD-Z基因其中的一个扩增失败,未出现假阳性扩增的现象。这说明,正确率低的原因更有可能是在引物区的碱基变异没有包含在引物中,如果采用简并引物来包含这些变异,可能会有所改善。就目前对所测试的雀形目鸟类来说,sex1’/sex-mix和IntP2/IntP8是比较可靠的。
灵敏度是反应体系能够扩增出来的最低模板量。一个体系的灵敏度越高,就越可能节省模板,越适合于微量材料。羽毛是DNA含量较低的材料,与肌肉和血液样本不同,从羽毛样品得到的总DNA浓度通常较低[23],所以越灵敏的PCR体系,在实际应用中越有价值。
本研究评估显示,5对引物中引物sex1’/sex-mix的灵敏度最高,达到10 pg/μL,IntP2/IntP8次之,为10—100 pg/μL,CHD1F/CHD1R和2550F/2718R为100 pg/μL,P2/P8最差,仅为500 pg/μL(表4)。体系的灵敏度主要取决于引物的摩尔数与模板DNA和目的片段的摩尔数之比。反应体系中,引物的摩尔数是确定的,而模板DNA目的片段的摩尔数存在一定的不确定性。因为DNA会发生化学降解和机械剪切,机械剪切往往容易发生在较大片段的中部,而酶促降解则较多发生在特定的位置。因为不同样品保存条件不同,所经历的机械剪切和酶促降解也有所不同,因此,体系中虽然加入等量的模板DNA,但不同样品的反应中DNA片段数和保留完整的目的片段数都有所差异。从表4可以看出,如果DNA较少的时候,引物sex1’/sex-mix的表现最优,IntP2/IntP8次之。
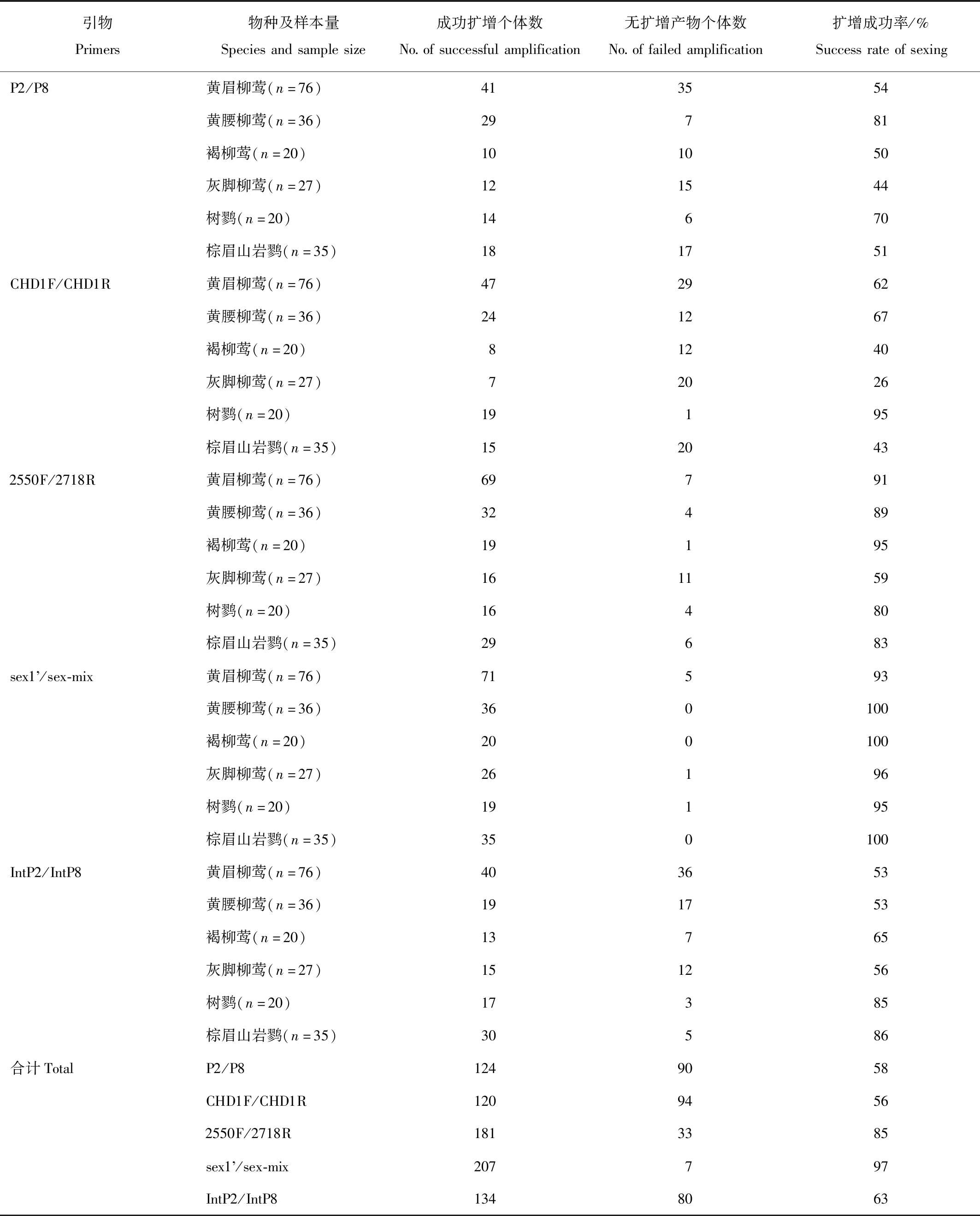
表5 5对性别鉴定引物扩增成功率Tab.5 The success rate of five primers pairs for sex identification
成功率是除了正确率以外最为关心的问题。一个PCR体系能否扩增成功,除了引物质量和浓度、酶活力、离子强度、体系pH及缓冲能力、反应程序及执行质量等因素以外,单纯从模板因素考虑,引物区的变异度是第一大影响因素。越是靠近引物3′端的变异越容易导致PCR失败,直接降低成功率。对于雀形目鸟类,遗传多样性较高,种群内的变异度较高,CHD基因不同区段的变异度不同[24]。在不同区段上设计引物,受到的影响程度就会不同。我们采用大样本测试发现,引物sex1’/sex-mix的总扩增成功率最高,达到97%;引物2550F/2718R次之,达到85%;其余3对引物的扩增成功率仅在63%或更低。
综上所述,从鉴定正确率、反应体系灵敏度和鉴定成功率3个指标组合分析,对树鹨、棕眉山岩鹨、黄眉柳莺、黄腰柳莺、褐柳莺和灰脚柳莺这6种单态型鸟类,引物sex1’/sex-mix是性别鉴定的最优选择,引物IntP2/IntP8和2550F/2718R可以慎用,而引物P2/P8和CHD1F/CHD1R不建议使用。
