熊猫源唾液乳杆菌的分离鉴定及部分生物学特性分析
2019-08-19王黎明张文平谢军金周杰珑
王黎明 张文平 王 洁 谢军金 周杰珑*
(1.西南林业大学生命科学学院,昆明,650224;2.成都大熊猫繁育研究基地,成都,610081)
大熊猫(Ailuropodamelanoleuca)是仅仅分布在中国四川、甘肃、陕西三省的特有物种,虽然近几年大熊猫栖息地保护工程取得了巨大成就,大熊猫数量有所上升,已经达到2 000只左右[1]。大熊猫在漫长的进化历史中,仍保留着肉食性动物的胃肠道,没有盲肠、肠道短且结构简单,食物通过速度非常快,致使食物不能充分发酵,并且竹子中的营养水平较低。早期研究证明,在这种饮食情况下,为满足机体营养所需,大熊猫体内的肠道微生物进化并适应以竹子为主的饮食,在营养物质消化中起到重要的吸收和转运功能。不久前研究发现肠道微生物帮助大熊猫更好地消化竹子中的淀粉、半纤维素、果胶等容易消化的成分获取能量,更加表明在大熊猫从出生到亚成体这一食物转变过程中肠道微生态平衡的重要性[2]。可是,大熊猫在食物转变过程中,易出现消化功能不良,免疫力下降,腹泻,导致肠道正常菌群失衡进一步引发严重的肠道疾病甚至死亡的情况[3]。
抗生素具有治疗和预防疾病的作用,但随着抗生素滥用导致社会对抗生素残留、耐药细菌的产生、和二重感染的担忧,许多国家限制了非治疗性抗生素在动物生产上的使用[4-5]。最近几年随着研究者对肠道菌群在疾病发生过程中的作用的不断认识,益生菌作为一种抗疾病的替代品越来越受到人们的重视,益生菌通过调节黏膜和全身免疫功能以及改善肠道微生物营养平衡对宿主产生有益影响[6-7]。益生菌(Probiotics)定植于宿主肠道、生殖道、口腔等。常见的益生菌主要包括芽孢杆菌(Bacillus)、乳酸菌(lactic acid bacteria)、酵母菌(yeast)等,其中乳酸菌在促进人和动物健康,减少抗生素使用、特殊的风味和益生作用等方面越来越受到重视。乳酸菌具有抗病毒、抗肿瘤、抗菌、抗应激以及抗心血管相关疾病等作用[8-9]。早在1988年王强等[10]就开展了对大熊猫源益生菌的研究。雷蕾等[11]从17只健康成年大熊猫粪便中分离鉴定出13株乳酸菌。陈新亮等[12]从健康散养的溜达鸡小肠黏膜中分离出1株唾液乳杆菌LactobacillussalivariusC-1-3。发现其对常见的致病菌大肠杆菌(Escherichiacoli)、沙门氏菌(Salmonellaparatyphi)和金黄色葡萄球菌(Staphylococcusaureus)都具有良好的抑制作用,且该菌株能够降解纤维素。李琳琳等[13]采集陕西八眉猪的粪便和肠道组织,筛选出1株耐受性和抑菌性良好,生长曲线稳定且黏附性较好的乳酸菌。Wang等[14]从鸡肠道中分离的1株唾液乳杆菌,发现不仅能够产生胆盐水解酶而且通过进一步研究表明胆盐水解酶抑制剂将有望作为AGPs的替代物来改善动物的生长性能。在21世纪“保菌”时代,乳酸菌既可以作为微生态制剂应用于畜牧行业中,也可以应用于工业生产、食品行业、医药和化妆品行业以及口服疫苗生产等。鉴于此,本研究旨在从处于食物转变期的幼年健康大熊猫粪便中分离生物学特性优良的乳酸菌,为研究、开发和利用熊猫源微生态制剂奠定基础。
1 材料与方法
1.1 主要试剂
指示菌:大肠杆菌CMCCB44102、金黄色葡萄球菌CMCCB50094、铜绿假单胞菌(Pseudomonasaeruginosa)CMCCB10104、乙型副伤寒沙门氏菌CMCCB50094,标准菌株LGG(Lactobacillusrhamnosus)ATCC7496均购置广东环凯微生物有限公司。Man-Ragosa-Sharpe(MRS)(购自青岛高科园海博生物科技有限公司)。药敏纸片(购自杭州微生物试剂有限公司)。溶菌酶、细菌基因组DNA 提取试剂盒(离心柱型)均购自北京天根生物科技有限公司。2×PCR Master Mix购自生工生物工程(上海)有限公司。细菌通用引物(27F,1492R)和耐药基因引物的合成及16S rDNA均由测序生工生物工程(上海)有限公司完成。乳酸菌成套生理生化鉴定管(购自青岛高科园海博生物科技有限公司)。
1.2 样品采集与菌株分离
采集成都大熊猫繁育研究基地12个月左右的2只健康、发育良好的双胞胎大熊猫(芝麻,芝士)的新鲜全粪,排出后立即放入无氧环境的冻存盒中4℃保存,20 min内运至实验室。选取大熊猫粪样的中间部位且不挨着地面部分称取5 g粪加入装有45 mL无菌生理盐水蓝盖瓶(带玻璃珠)中于300 rpm的摇床震荡15 min后制成10-1稀释液,随后按10倍稀释法分别制成10-2、10-3、10-4、10-5、10-6的粪样稀释液。取100 μL稀释样液均匀涂布MRS平板,置于37℃恒温培养箱厌氧培养48 h后,接种环挑取疑似乳酸菌单个菌落在MRS平板上反复划线纯化,直至镜检无杂菌。
1.3 细菌的生态学鉴定
通过革兰氏染色、乙酰甲基甲醇(V-P)试验、吲哚试验、糖发酵试验(杭州微生物有限公司)、触酶试验、明胶液化试验、硝酸盐还原试验、H2S生成试验、15℃、 45℃ 及pH4.5生长试验,将分离得到的细菌再做进一步鉴定分类。
(1)采用细菌基因组DNA 提取试剂盒(离心柱型)(北京天根生物科技有限公司)提取细菌总 DNA。(2)16S rDNA 的PCR 扩增:以细菌的总 DNA 为模板,采用细菌通用引物(27F,1492R)进行PCR扩增。PCR反应体系(30 μL):PCR反应体系为2×TaqPCR Mastermix 25 μL,10 mmol/L 27F引物2 μL,10 mmol/L 1 492R引物2 μL,DNA模板1 μL,ddH2O 20 μL。(3)PCR反应条件为:95℃预变性7 min,95℃变性30 s,55℃退火30 s,72℃延伸90 s,30个循环,72℃延伸10 min。将 16S rDNA 序列扩增产物用 2%琼脂糖凝胶 120V,30 min电泳。(4)扩增产物序列的测定由上海生工生物技术有限公司完成。(5)序列比对:基因序列上传 NCBI,并与GenBank中的序列进行比对,根据序列同源性确定种属。利用Clustal×2.0进行相关序列比对,采用最大简约法和邻接法进行分析,分支置信度值通过重采样1 000次利用MEGA 6.0软件。绘制 16S rDNA 系统发育树。
1.4 细菌的体外生物学特性的分析
1.4.1 耐酸、胆盐受试实验
将分离菌株接种MRS液体培养基37℃培养24 h后,调整菌体浓度至108cfu/mL,10 000 r/min 离心10 min收集菌体,无菌条件下接种至pH2.0、pH3.0、pH4.0和pH7.0以及0.1%、0.2%和0.3%猪胆盐的MRS液体培养基,37℃恒温分别培养1、2 h后,进行稀释,平板计数,计算活菌数,以0 h活菌数为参考。
1.4.2 抑菌实验
将分离菌株和标准菌株鼠李糖乳杆菌(LGG)活化后接种MRS液体培养基37℃培养24 h后,调整菌体浓度至108cfu/mL,通过10 000 r/min 离心10 min;然后将上清液经0.22 μm微孔滤膜过滤,获得无细胞上清液(cell-free solution,CFS);采用牛津杯法测定乳酸菌经发酵得到的无细胞上清液的抑菌能力。选用致病性大肠杆菌CMCCB44102、金黄色葡萄球菌CMCCB50094、铜绿假单胞菌CMCCB10104、乙型副伤寒沙门氏菌CMCCB50094为指示菌。将上述指示菌菌液调整至107cfu/mL然后吸取100 μL均匀涂布于NB培养基固体平板,待其吸收后,在每个培养基的适当位置用无菌镊子放置3个直径6 mm牛津杯,并轻轻按压牛津杯使其与琼脂紧密结合,吸取200 μL分离菌株无细胞上清液分别加至3个牛津杯,立即37℃恒温培养,于24 h后用游标卡尺分别测量并记录抑菌圈直径(抑菌圈直径为100%抑菌所产生的透明圈环直径)。
1.5 药敏实验
1.5.1 耐药基因型的检测
采用细菌基因组DNA提取试剂盒(离心柱型)提取乳酸菌DNA。以乳酸菌的基因组DNA为模板,用设计合成的26对耐药基因引物(附表1),进行PCR扩增。将PCR扩増的产物进行琼脂糖凝胶电泳。将琼脂糖凝胶电泳阳性的PCR扩增产物送往公司进行测序。将测序结果在美国国立生物技术信息中心(NCBI)上用BLAST软件在GenBank中进行同源性分析。
PCR反应体系(25 μL)TaqDNA酶 0.3 μL;10×TaqDNA reaction Buffer 2.5 μL;Mg2+2 μL;dNTP 0.5 μL;TaqDNA 上游引物1 μL;下游引物1 μL;模板DNA 1 μL;ddH2O 16.7 μL;PCR反应条件:94℃预变性10 min;94℃变性30 s;退火温度根据附表1设定,时间30 s;72℃延伸30 s;循环数35次;72℃延伸10 min,4℃保存。
1.5.2 耐药表型的检测
采用 K-B 法[15]对分离菌株进行药敏试验。所有待检菌株的药敏实验按照“临床与实验室标准研究所(CLSI,2009)”的步骤完成。用无菌生理盐水稀释待检菌株的24 h培养物至108cfu/mL,取100 μL均匀涂布于MRS培养基上,选择36种抗生素药敏纸片,在每个培养基的适当位置放置抗生素药敏纸片。37℃培养24 h后测定各药敏纸片的抑菌圈大小。同时以致病性大肠杆菌作为质控菌株。
1.6 数据分析
所有数据均以平均值±标准差表示。将数据结果用 Graphpad Prism 5.2 绘图软件绘制柱状图。
2 结果与分析
2.1 菌株分离、鉴定结果
从2只幼年大熊猫新鲜粪样中共筛选出10株菌株命名编号记录(表1)。所有菌株在MRS培养基上的菌落形态呈近圆形,乳白色,菌落小,表面湿润,有光泽,无褶皱中间突起,边缘整齐;革兰氏阳性,显微镜下呈单个或成对短杆状。分离菌株特征和乳酸菌一致,是一种兼性厌氧菌,其运动性、过氧化氢酶活性、明胶液化、淀粉水解、枸橼酸盐、硫化氢、吲哚、V-P、葡萄糖产气、尿素、D-核糖和七叶苷反应均为阴性;石蕊牛乳产酸、葡萄糖、蔗糖、麦芽糖、乳糖和甘露醇反应均为阳性。
2.2 菌株16S rDNA 扩增与序列分析
分离菌株经活化后,然后按照细菌DNA提取试剂盒说明书提取纯培养物的DNA,以细菌总DNA为模板所扩增得到的16S rDNA的PCR产物与预期的大小一致,即约为1.5 kb(图1)。PCR产物回收测序后将各分离菌株测序结果提交至GenBank上进行16S rDNA比对,根据GenBank序列同源性比较,10株分离菌株与Lactobacillussalivariusstrain JCM 1231(GenBank登录号NR-112759.1)同源性98%以上。采用最大似然法构建分离菌株的遗传进化树(图1)。

图1 细菌16S rDNA PCR扩增Fig.1 PCR amplification of 16S rDNA
2.3 耐酸和胆盐耐受试验
胃液里含有大量的胃酸,能顺利通过胃液到达肠道定殖是益生菌的关键特性。试验发现,在较低的pH值2.0环境,菌株ZM02,ZZ03培养2 h后仍有76.62%、80.75%的存活率,其余菌株生长均受到抑制;胆汁耐受性是菌株在消化道中生长和生存的重要条件。在这个试验中,在胆盐浓度为0.3%的条件下菌株ZM02,ZZ03培养2 h有97.76%、99%的存活率。
2.4 菌株上清液抑菌试验结果分析
分离菌株上清液对大肠杆菌CMCCB44102、金黄色葡萄球菌CMCCB50094、铜绿假单胞菌CMCCB10104、乙型副伤寒沙门氏菌CMCCB50094均呈现不同的抑制作用,同鼠李糖乳杆菌(LGG)抑菌直径相比,大肠杆菌抑菌效果最佳为ZM01,其抑菌圈直径(10.45±0.43)mm;乙型副伤寒沙门氏菌抑菌效果最佳为ZZ03,其抑菌圈直径(12.58±0.24)mm;铜绿假单胞菌抑菌效果最佳为ZZ04,其抑菌圈直径(13.99±0.29)mm;金黄色葡萄球菌抑菌效果最佳为ZM06,其抑菌圈直径(16.85±0.32)mm。具体结果见图3。

表1 分离菌株信息Tab.1 Isolation strain information table
2.5 菌株耐药性实验结果
采用 K-B 法对所分离鉴定的唾液乳杆菌株,选择36种抗生素药敏纸片的药敏试验,结果显示10株唾液乳杆菌对36种抗生素耐药程度不同,对青霉素类(盘尼西林除外)、其他抗生素类的呋喃妥因、亚胺培南和氯霉素类无耐药菌株出现。对单环内脂类(氨曲南)、磺胺类、硝基咪唑类和多粘菌素类B无敏感菌株。对于其他种类抗生素表现出不同程度的耐药性,结果见表2。

图2 分离菌株16S rDNA进化树Fig.2 Lactobacillus 16S rDNA evolutionary tree
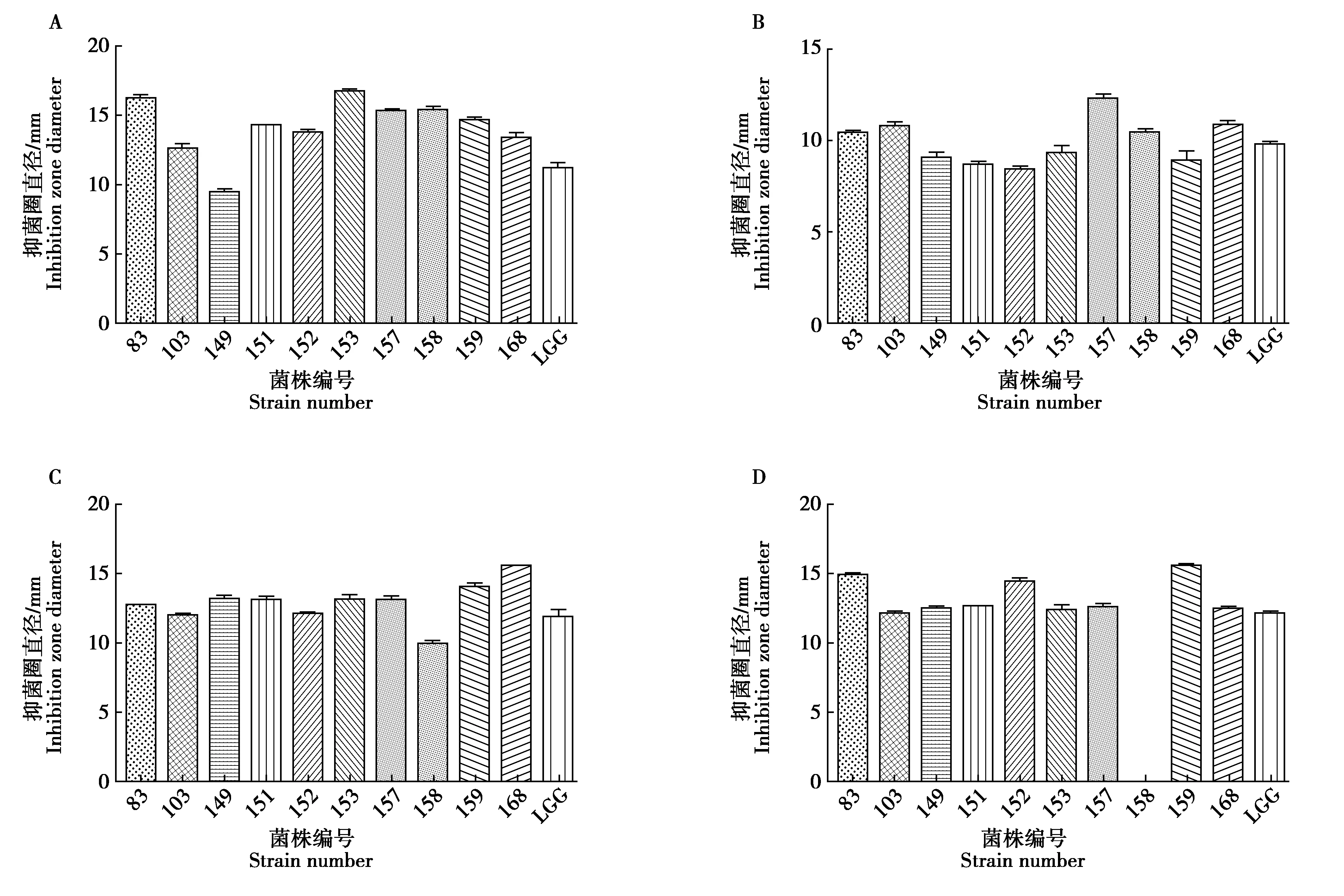
图3 分离菌对大肠杆菌金黄色葡萄球菌(A)、大肠杆菌(B)、铜绿假单胞菌(C)、乙型副伤寒沙门氏菌(D)抑菌实验结果Fig.3 Experimental results of bacterial inhibition against Staphylococcus aureus(A),Escherichia coli(B),Pseudomonas aeruginosa(C)and Salmonella paratyphi(D)
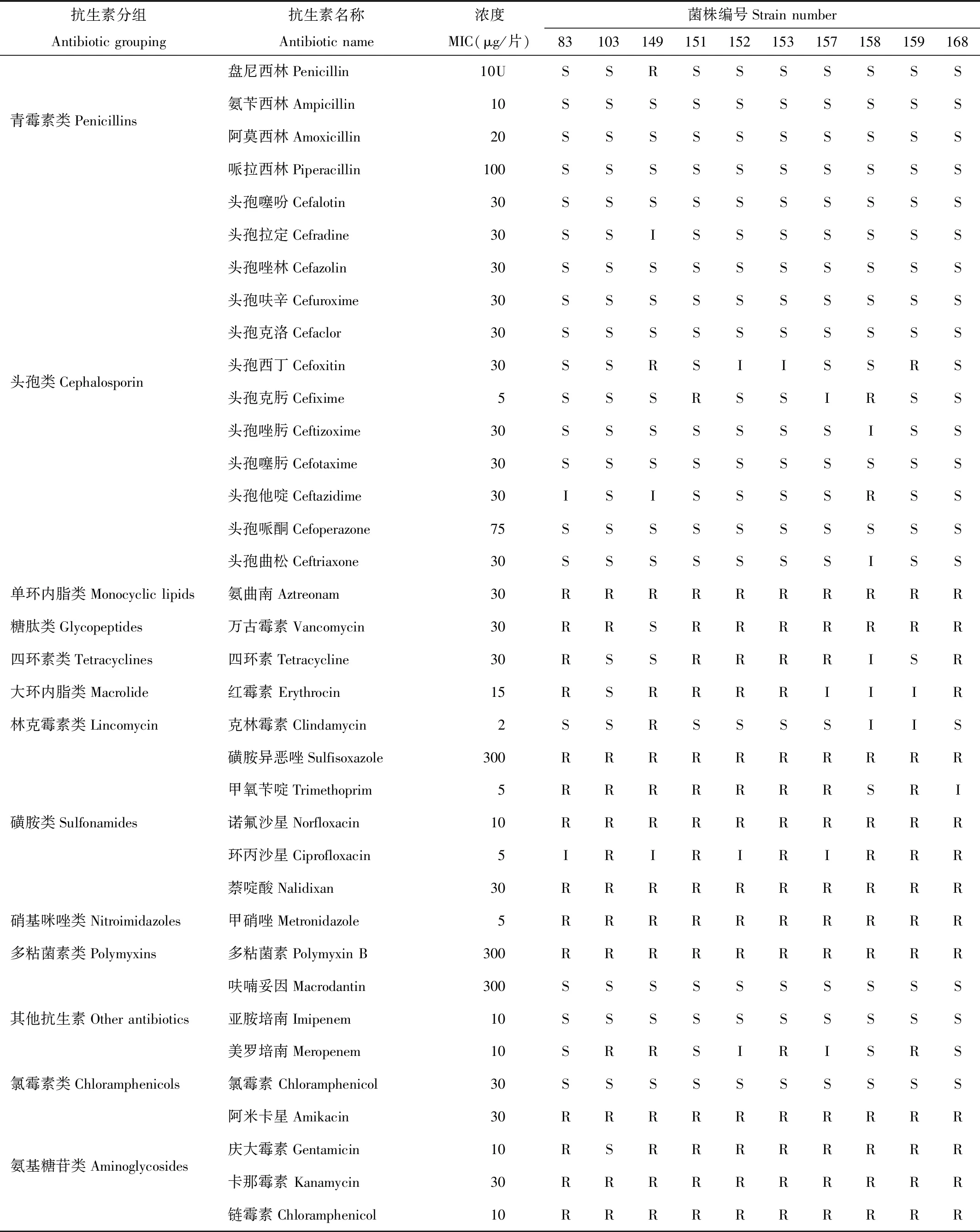
表2 药敏实验结果Tab.2 Drug sensitivity test results
采用PCR技术对所有分离鉴定的菌株进行用26对耐药基因引物扩增菌株获得相应扩增产物,将各凝胶电泳阳性扩增产物的序列测定结果与GeneBank中的相应序列进行比对,结果表明,26对耐药基因中的只检出四环素耐药基因(tetM)(检出率9/10)。经琼脂糖凝胶电泳后,阳性电泳结果见图4。
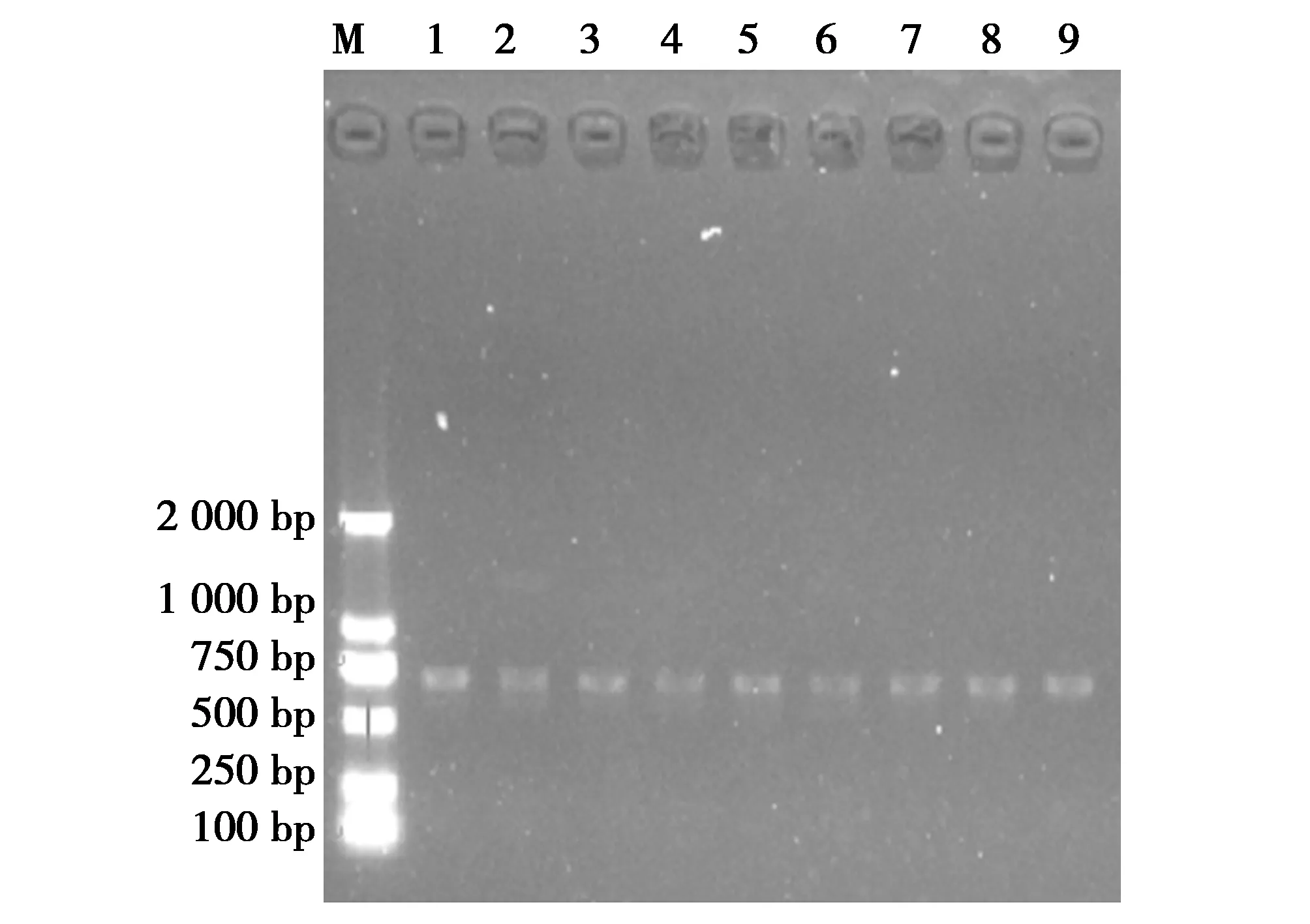
图4 大熊猫肠道乳酸菌耐药基因检测结果Fig.4 Genetic testing results of intestinal lactic acid bacteria resistance in giant pandas 注:M:D2000 DNA Marker;1-9(tetM):ZM01,ZM03,ZM04,ZM05,ZM06,ZZ01,ZZ02,ZZ03,ZZ04
3 讨论
唾液乳杆菌属于乳杆菌科(Lactobacillaceae)、乳杆菌属(Lactobacillus),广泛地存在于人和动物的肠道。近年来,唾液乳杆菌作为一种具有极大潜力的益生性乳杆菌,已成为近年研究的热点唾液乳杆菌并不断被用来制作成适用于人和动物益生制剂。我国卫生部2010年65号公告批准将唾液乳杆菌作为食品生产加工使用的菌种之一[16]。乳杆菌是大熊猫肠道中正常菌群的一部分,其菌群构成也会随着年龄、季节、食性的转变而发生改变。研究表明处于食性转变的幼年大熊猫肠道中乳酸菌丰度最高,多样性也最高[2]。因此,本研究通过采集健康幼年双胞胎大熊猫的新鲜粪便,进行乳酸菌的筛选工作,最后从两个样品中分离鉴定得到10株唾液乳酸杆菌,随后对分离菌株进行部分的生物学特性及药敏分析。最后得到1株生物特性好且无耐药性号的菌株,以期为后续开发熊猫源乳酸菌制剂,或将唾液乳杆菌与一种或多种其他益生菌结合在一起制成复合型菌制剂的研究及应用提供广阔的发展空间。
定殖在肠道的乳杆菌生长代谢过程中可通过分泌有机酸、细菌素等物质抑制其他细菌的生长,并与病原菌竞争生长空间从而发挥其拮抗作用[17-18]。倪敬轩等[19]通过从健康仔猪新鲜粪便中分离到的唾液乳杆菌对猪源致病性大肠杆菌也表现了极强的致病性。为预防和治疗仔猪腹泻肠道疾病奠定了基础。腹泻等肠道疾病是动物养殖中最常见的一种肠道疾病,在大熊猫保护工作中亦是如此[20]。目前对于大熊猫肠道疾病的治疗主要是使用抗生素。但近年来由于抗生素的大量使用导致产生致病性耐药菌株,使其疗效越来越差[21-22]。因此,通过开发和利用益生菌制剂作为抗生素的补充或替代抑制病原菌生长、减少病原菌定植、改善肠道屏障功能、维持肠道共生微生物菌群平衡、增强机体免疫力进而抵御部分胃肠道致病菌的感染就显得越来越重[23-24]。本研究分离得到的唾液乳杆菌除了菌株ZZ02对乙型副伤寒沙门氏菌没有抑制效果外,其余都有抑制效应,可能是同一种属的菌株在生物学上特异性引起的。
60年前人们就开始利用抗生素来治疗细菌性疾病,随着大量的新品种抗生素相继问世,抗生素滥用现象越来越严重。导致耐药性问题也逐渐地显现出来,使人们在治疗与防治感染性疾病时面临新的考验。因此,对于筛选新的益生用菌株进行耐药性的检测是非常必要的。
大部分乳酸菌对抗革兰阴性菌(Gram negative bacilli)的抗生素具有耐药性,例如链霉素、庆大霉素和卡那霉素。此外,已有研究发现唾液乳杆菌对万古霉素具有耐药性[25-26]。本研究通过药敏实验和PCR技术对分离菌株进行检测,结果表明:10株唾液乳杆菌对青霉素类、头孢类、氯霉素类、林克霉素类及其他抗生素类(亚胺培能)不耐受。对单环内脂类、糖肽类、氨基糖苷类、四环素类和磺胺类的抗生素耐受性高。每种菌株至少对17种抗生素的不耐受。而通过26对耐药基因检测,只检测到四环素类(tetM)耐药基因。在这9株含耐药基因的唾液乳杆菌中,有两株经K-B法药敏结果显示对四环素高度敏感,可能是由于乳酸菌具有主动或被动的通过接合质粒或转座子与其他细菌交换遗传物质的潜在能力,这种潜在的能力是其能够从其他细菌获得抗生素耐药性基因[27-28],因此,这两株菌虽含有该耐药基因但未表达。
综上所述,本研究通过从2只幼年健康大熊猫的新鲜粪便中筛选乳酸菌株,采用牛津杯法、活菌计数法和耐受性实验、药敏实验从分离的10株唾液乳杆菌中筛选到一株编号为103的唾液乳杆菌株。该菌株在pH2.0、胆盐浓度为0.3%的条件下培养2 h有25%、88%的存活率;不含耐药基因,对临床肠道疾病常用抗生素敏感。该菌株可为后续得到熊猫源微生态制剂提供发展空间。
附表1 26种耐药基因PCR引物序列

Attached list.26 drug resistance genes PCR primers
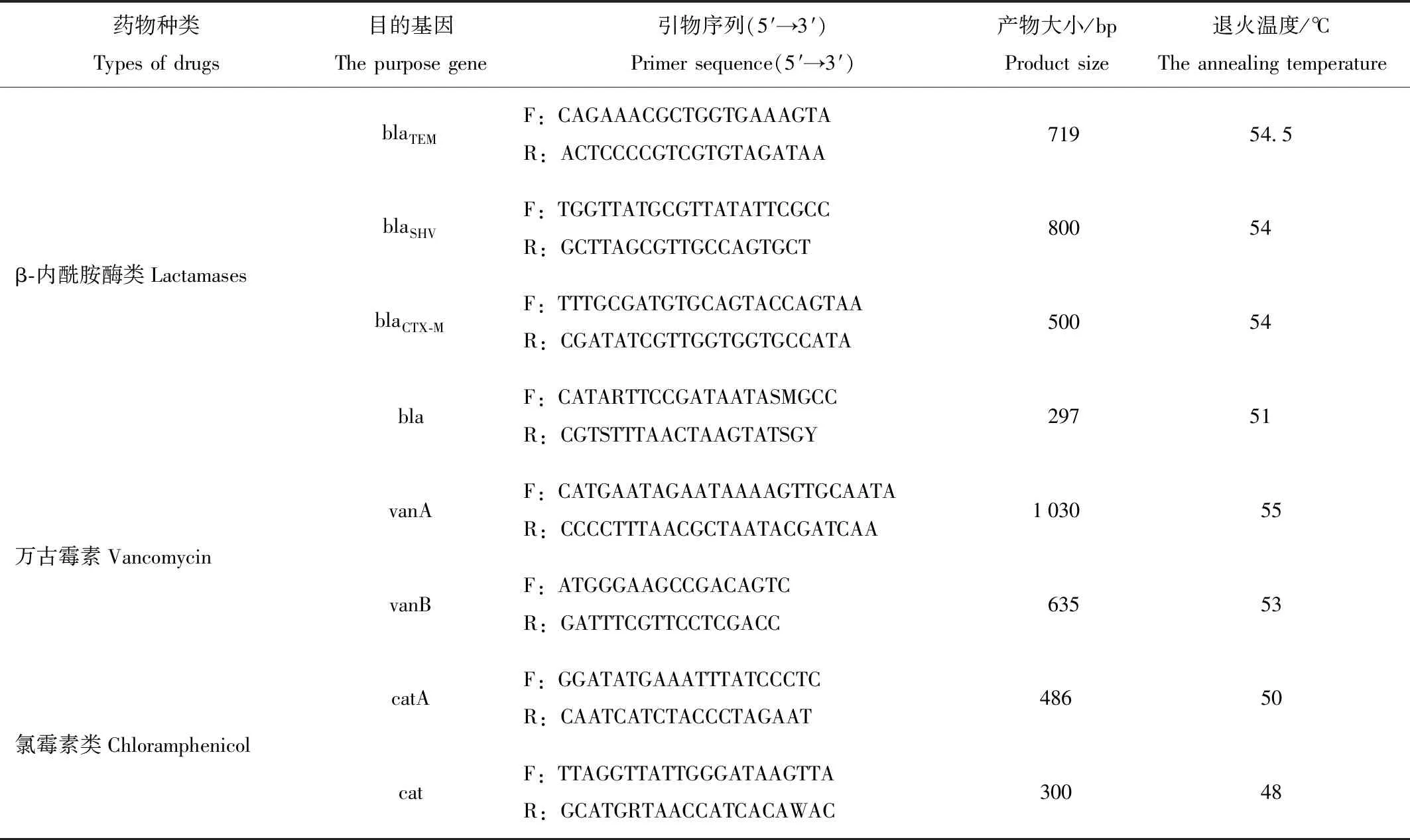
续附表1
