利用Illumina测序技术分析圈养成年滇金丝猴肠道菌群多样性
2019-08-19张飞燕谢丽分张庆宇邬继文吕龙宝
金 洁 张飞燕 谢丽分 刘 超 张庆宇 邬继文 吕龙宝,2*
(1.中国科学院昆明动物研究所,昆明,650000;2.中国科学院昆明灵长类研究中心,昆明,650223)
滇金丝猴(Rhinopithecusbieti)是中国特有的珍稀濒危动物,也是世界自然保护联盟(IUCN)红色名录中的濒危(EN)物种,其珍贵程度与大熊猫(Ailuropodamelanoleuca)齐名。滇金丝猴是全世界除了人类之外,栖息地海拔最高的灵长类动物,仅分布于我国西南横断山脉,金沙江、澜沧江和怒江之间滇西北和藏东南的狭小区域,海拔2 800—5 000 m之间的高山针叶林和狭长针阔混交林中,总数约3 000只。滇金丝猴不仅具有重大的观赏和经济价值,还有很高的医学研究价值。目前人工圈养滇金丝猴数量不到30只。在滇金丝猴的人工饲养和繁育中,动物肠道菌群结构的改变与失衡常引起其腹泻、消化吸收功能障碍、二重感染等疾病。胃肠道微生物的研究和利用是野生动物繁殖及种群保护的重要措施[1]。
肠道微生物直接参与宿主的食物消化、营养吸收、能量代谢、免疫应答等诸多生理活动[2],维持肠道微生态平衡,提高食物消化利用率,减少肠道疾病发生,对滇金丝猴个体健康和人工繁育至关重要。目前,针对滇金丝猴肠道菌群的研究较少,其整个胃肠道菌群的信息仍处于未知状态。本研究利用高通量测序,弥补了传统培养技术耗时长、不能完全反映样本中微生物信息等缺陷,全面解析了滇金丝猴的肠道菌群结构,旨在为滇金丝猴营养与健康的研究提供参考依据,对开展人工饲养、繁育和改良饲料配方均具有重要的理论和指导意义。
1 材料与方法
1.1 样品采集
在中国科学院昆明灵长类研究中心,采集5只圈养成年(5—10岁)滇金丝猴的新鲜粪便于采粪管中,迅速放到液氮罐中带回实验室。在无菌条件下取粪便内部分装并分别编号R1—R5,其中R1—R4为健康滇金丝猴粪便,R5为亚健康滇金丝猴的半干粪便,置于-80℃冰箱中保存。采样的健康滇金丝猴精神状况和食欲良好,以人工饲料为食并辅有蒸糕、苹果或红薯,亚健康滇金丝猴精神状况和食欲较健康猴差,仅以蒸糕为食,且体重远低于健康滇金丝猴。
1.2 细菌总DNA提取和PCR扩增
使用MOBIO公司PowerFecalTMDNA试剂盒,按照说明书上操作步骤抽提细菌基因组DNA。抽提完成后用1%琼脂糖凝胶电泳和核酸检测仪检测DNA质量。以滇金丝猴肠道内容物总DNA为模板,针对16S rRNA V3-V4区合成特异引物515F(5′-GTGCCAGCMCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌DNA进行扩增,使用的PCR仪为ABI GeneAmp 9700型。用2%琼脂糖凝胶电泳检测PCR产物。
1.3 PCR产物的混样和纯化
PCR产物质量合格后,根据其浓度进行等量混样,充分混匀后使用1×TAE浓度2%的琼脂糖胶电泳纯化PCR产物,切胶回收目的条带。产物纯化试剂盒使用的是Axygen公司的AxyPrepDNA凝胶回收试剂盒。
1.4 文库构建及测序
连接“Y”字形接头,使用磁珠筛选去除接头自连片段后进行文库模板的富集和氢氧化钠变性,构建好的文库经Qubit定量和检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序。测序工作由北京诺禾致源生物信息科技有限公司完成。
1.5 高通量测序数据处理与分析
使用Cutadapt软件reads进行剪切,根据Barcode拆分出各样品数据,截去Barcode和引物序列得到原始数据。原始数据经FLASH拼接、QIIME过滤、UCHIMEAlgorithm去除嵌合体后得到有效数据,在97%的相似度水平下进行聚类和物种注释。使用QIIME软件计算每个样品的Alpha多样性指数;用R软件绘制稀释曲线、Rank abundance曲线;用KEGG数据库进行PICRUSt基因预测,并在各个分类水平上进行物种组成及多样性分析。
2 结果
2.1 样品序列与OTU聚类
经Illumina HiSeq测序平台得到原始数据后进行拼接和质控,得到Clean Tags,再进行嵌合体过滤,5个样品共得到60 598条可用于后续分析的有效数据。对所有样品的有效数据进行聚类,以97%的一致性将序列聚类成为 OTUs。5个样品共产生791条不同OTU,其中R5样品中OTU(592条)最多,R3样品中OTU(479条)最少,说明R5样品中细菌物种最多,R3样品中细菌物种最少。
2.2 细菌群落丰富度和多样性分析
稀释曲线是描述样品多样性的曲线,如图1A所示,曲线在序列数为60 598条后趋向平坦,说明测序已包含绝大多数样本信息。Rank abundance曲线可反映样品中物种的丰富度和均匀度,如图1B所示,物种丰富度的大小依次为 R5、R1、R4、R2、R3,与上述结论一致。综上,此次测序数据量合理,测序深度已基本覆盖样品中所有细菌。
Alpha多样性用于分析样品内的微生物群落多样性,表1列举了5个样品的菌群多样性(Shannon)和菌群丰度指数(Chao1和 Ace)。由表1可知,R5的细菌菌群丰富度最高,其次是R1、R4、R2、R3;R1的细菌多样性最丰富,其次是R4、R5、R2、R3。此外,覆盖率指数越接近于1,表明测序深度已基本覆盖到样品中所有的物种,本研究中各样品如表1中所示覆盖指数均大于0.99,说明样本中序列没有被测出的概率极低。

图1 稀释曲线和rank abundance曲线Fig.1 Rarefaction curve and rank abundance plot

表1 样品中细菌Alpha多样性指数Tab.1 Alpha diversity of bacteria in samples
2.3 滇金丝猴肠道细菌的组成分析
采用Mothur方法注释得到12个门(phylum)19个纲(class),31个目(order)47个科(family),82个属(genus),65个种(species)。
2.3.1 门分类水平上的细菌组成
从门分类水平,按相对丰度前10作图(图2)。R1—R4 4组健康滇金丝猴肠道内平均相对丰度高于3%(不包含未知菌种)的细菌有厚壁菌门(Firmicutes,78.41%)、拟杆菌门(Bacteroidetes,18.97%),R5亚健康滇金丝猴肠道内相对丰度高于3%(不包含未知菌种)的细菌有厚壁菌门(78.93%)、拟杆菌门(8.13%)、螺旋体门(Spirochaetes,6.09%)、变形菌门(Proteobacteria,3.09%)。由此可见,厚壁菌门、拟杆菌门是健康滇金丝猴肠道菌群中的优势菌群。
2.3.2 属分类水平上的细菌组成
由于从种水平起分类较多,因此选择在属水平作聚类分析,按相对丰度平均值排名前 10 的菌属作聚类热图(图3)。R1—R4 4组健康滇金丝猴肠道内平均相对丰度高于3%(不包含未知菌种)的细菌有瘤胃球菌属(Ruminococcus,6.29%)、未分类的毛螺菌科(unidentified Lachnospiraceae,4.20%)成员、普氏菌属(Prevotella,3.24%)。R5亚健康滇金丝猴肠道内相对丰度高于3%(不包含未知菌种)的细菌有梭菌属(Clostridum,10.19%)、厌氧原体属(Anaeroplasma,6.09%)、琥珀酸弧菌属(Succinivibrio,7.06%)、 瘤胃球菌属(4.70%)。
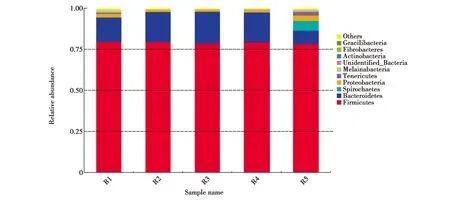
图2 门水平细菌群落结构及分布Fig.2 Bacterial communities and distribution of the samples at the phylum level
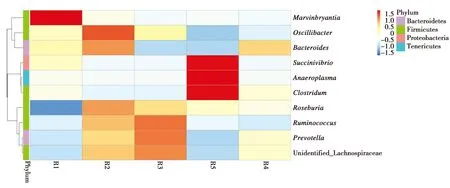
图3 属水平细菌聚类热图Fig.3 Heatmap at genus level
2.4 PICRUSt基因预测
采用PICRUSt方法预测滇金丝猴潜在的肠道微生物基因功能,如图4所示共获得6大类功能(不包含未分类和未知的):细胞工程、环境信息处理、遗传信息工程、人类疾病、代谢作用、有机体系统。基因预测热图结果表明各样品的基因功能存在一定差异,其中R1肠道微生物在遗传信息工程方面的功能较丰富,R4在代谢作用上的功能较丰富,R5在有机体系统、环境信息处理、细胞工程和人类疾病方面的功能较丰富,R2和R3肠道微生物的各功能丰富度较相似。同时,比较功能基因所在KEGG通路上的丰度差异(图5),在各大类功能中丰度最高的分别为:细胞迁移、膜转运、DNA的复制与修复、传染病、碳水化合物代谢、内分泌系统。

图4 PICRUSt基因预测聚类热图Fig.4 Heatmap of PICRUSt gene predicted function

图5 KEGG数据库预测结果统计图Fig.5 Statistical chart of predicted results from KEGG database
3 讨论
本试验采集了4只健康滇金丝猴粪样和1只亚健康滇金丝猴粪样,利用Illumina MiSeq高通量测序分析后共鉴定出12个门、19个纲、31个目、47个科、82个属和65个种。通过稀释曲线、Rank abundance曲线和Alpha多样性指数进行样本的复杂度分析,测序深度已基本覆盖肠道内所有细菌,且各组样品丰富度和均匀度较好,克服了传统分离培养方法难以培养厌氧细菌、耗时、数据不全面等缺点。5只滇金丝猴肠道微生物的种类和数量不完全相同,可能是动物的生理状况有一定差异所致。
研究发现健康滇金丝猴肠道共同优势菌群有:厚壁菌门(78.41%)、拟杆菌门(18.97%),与先前的研究结果相似:非人灵长类动物肠道的优势菌群为厚壁菌门(65%—79%)、拟杆菌门(5.5%—19.3%)[3]。中国恒河猴(Macacamulatta)的肠道优势菌群有:厚壁菌门、拟杆菌门、放线菌门(Actinobacteria)和螺旋体门[4],神农架川金丝猴(Rhinopithecusroxellana)的优势菌群有:厚壁菌门、拟杆菌门、螺旋体门、疣微菌门(Verrucomicrobia)和变形菌门[5],川金丝猴优势菌群有:厚壁菌门(70.35%)、拟杆菌门(21.35%)[6],这一结果的产生可能是由于滇金丝猴和恒河猴、神农架川金丝猴的饮食结构和生存环境存在差异[7]。此外,科学家通过温度梯度凝胶电泳(TGGE)比较野生和圈养的大猩猩(Gorillagorilla)肠道微生物组成,发现圈养和野生的同一种灵长类动物其肠道菌群的多样性存在差异[8]。
厚壁菌门和拟杆菌门是人和非人灵长类动物肠道共同的优势菌门[9],可降解食物中难分解的成分[10]。非人灵长类动物肠道中2者所占比例之和为70.50%—98.30%[3]。高比例的厚壁菌门会导致肠道吸收卡路里的效率升高,促进机体肥胖[11]。在滇金丝猴肠道中,拟杆菌门所占的比例越高,动物健康状况越好[12]。此外,丰度前10的还有纤维杆菌门(Fibrobacteres),该菌门能消化纤维素,常存在于反刍动物的瘤胃中[13]。这一菌群的出现解释了滇金丝猴作为植食性动物的消化机制,暗示其肠道菌群组成与反刍动物菌群组成有相似之处[14]。本研究中亚健康滇金丝猴的优势菌群有:厚壁菌门、拟杆菌门、螺旋体门、变形菌门,其中螺旋体门和变形菌门的含量较健康滇金丝猴显著增加。螺旋体门和变形菌门都分别包括多种致病菌,如:螺旋体(Spirochaeta)、大肠杆菌(Escherichiacoli)、沙门氏菌(Salmonella)、幽门螺旋杆菌(Helicobacterpylori)等[15-16],降低动物肠道中螺旋体门和变形菌门的比例,个体的健康状况可能会得到进一步改善。在属水平上,瘤胃球菌属占有较高比例,助于细胞吸收糖分,利于食物的消化吸收[17]。毛螺菌科(Lachnospiraceae)的细菌参与纤维素的降解[18],产生挥发性脂肪酸为机体及肠道微生物提供能量。研究显示,草食动物肠道内包括毛螺旋菌科、纤维杆菌属(Cellulosimicrobium)等细菌与其食草特性相关[19-20]。本次试验中,健康滇金丝猴肠道中乳酸杆菌属(Lactobacillus)含量较低(丰度未进前10),但普氏菌属(Prevotella)含量较高,其可作为益生菌替代菌分解食物中的糖类[3]。肠道中的拟杆菌属(Bacteroides)有助于碳水化合物的分解。R5滇金丝猴肠道中毛螺菌科成员含量较低,但其含有的优势菌群梭菌属(Clostridum)和厌氧原体属(Anaeroplasma)都与纤维素降解有关[21];琥珀酸弧菌属(Succinivibrio)可利用糖分解产生的有机酸,使胃中产生的有机酸不会积聚,但其在R5中大量出现的原因有待探讨。虽然R5与R1—R4的优势菌群有所差异,但这些菌群都具有同一作用:参与纤维素的降解,造成这一差异的原因可能与动物的个体和饮食有关。滇金丝猴常摄入纤维素含量较高的植物,通过分析其肠道菌群的组成,发现滇金丝猴肠道微生物种类与其食性是密切相关的。
肠道微生物与机体的免疫功能、消化和吸收、酶代谢作用等有关[22]。研究表明,人类肠道中微生物失衡可导致过敏[23]、肥胖[24]和糖尿病等[25]。由此可见,肠道微生物对机体的生理功能有一定的影响。PICRUSt将不可视的微生物,通过与数据库比对和生物功能联系起来。PICRUSt基因预测热图显示,相同功能各样品间热图颜色不同,说明各样品虽然都具有相同的功能,但是由于每个样品中所含微生物的种类和数量有区别,导致各样品的效能存在差异。PICRUSt基因预测表明滇金丝猴肠道中大部分细菌与机体代谢、膜转运和遗传信息处理功能有关。肠道菌群与宿主同步进化,以微妙的方式影响宿主,适应不同的生理和病理状态。破坏正常菌群的结构可能会对这些代谢通路产生阻碍。数以万亿的细菌栖息在动物肠道内,反映了个体健康、亚健康、疾病状况和疾病转归[26],由于人类对肠道菌群基因组的认识有限,此次试验尚有部分基因和功能未知,未来我们会针对性的研究患病和健康个体,以期发现肠道菌群变化与疾病之间的潜在关系。
4 小结
本研究得到圈养条件下成年健康滇金丝猴的菌群结构,为滇金丝猴疾病监测及人工饲料的研究提供数据,以期在对滇金丝猴肠道菌群实时监测的过程中改善其肠道微生物,达到保护和增殖濒危动物的目的。
