花鼠脑组织灌流固定方法的探究
2019-08-19毛剑杰朱青青周洪昌潘永良
毛剑杰 朱青青 陈 坤 周洪昌 钱 晶 潘永良
(湖州师范学院医学院,浙江省媒介生物学与病原控制重点实验室,湖州,313000)
脑组织形态和免疫组化、荧光等实验应用广泛,良好的灌流固定效果是保证实验顺利进行的重要前提[1]。一种好的灌流固定方法不仅能有效提高灌流效率,减少动物痛苦和濒死时间,避免病理假象,还能节约固定液,最重要的是能阻止机体死亡后体内蛋白类物质急速变性,避免组织细胞在自身溶酶体酶的作用下溶解破坏,最大限度地保持组织细胞的活体状态和抗原性[2-3]。在大鼠灌流中生理盐水的温度常为4℃或37℃[4-5],以往研究尚未评价生理盐水温度对后续实验如免疫组化的效果,且未有研究探讨主动脉结扎对脑组织灌流效果的影响。由于小型啮齿动物体型小,繁殖快,广泛应用于各模型的建立[6-7],本文旨在评估是否主动脉结扎和不同生理盐水温度(4℃和37℃)对花鼠(Tamiassibiricus)脑组织在体心脏灌流固定术中应用效果影响,探讨出一套简单、成功率高且适用于多数小型啮齿动物的灌流固定方法。
1 材料与方法
1.1 实验动物及分组
野生成年雄性花鼠24只,抓自黑龙江省伊春市带岭区(128°53′—128°55′E,47°10′—47°14′N),体重95—110 g,单笼饲养,正常明暗周期中适应性驯养1周后随机分成4组,每组6只。第1组:结扎腹主动脉,生理盐水4℃;第2组:不结扎腹主动脉,生理盐水4℃组;第3组:结扎腹主动脉,生理盐水37℃组;第4组:不结扎腹主动脉,生理盐水37℃组。所有关于实验动物的操作均遵循实验动物操作规程,并尽可能减少动物的痛苦。
1.2 主要试剂与仪器
生理盐水及多聚甲醛溶液(41533,国药集团化学试剂有限公司);EDTA抗原修复液(ZLI—9066,1∶50,北京中杉公司);山羊抗DCX抗体溶液(SC—8066,1∶2 000,Santa Cruz Biotechnology,Santa Cruz,CA,USA);生物素兔抗山羊二抗(BA—5000,1∶300,Vector Laboratories,Burlingame,CA,USA);Vector Elite ABC(PK—6100,Vector Laboratories,Inc.Burlingtone,CA,USA);0.05%DAB(D8001,上海西格玛奥德里奇公司,上海);恒流蠕动泵(保定兰格恒流泵有限公司);Leica CM1850冰冻切片机(Leica,Heidelberg,DE)。
1.3 灌流固定
腹腔注射戊巴比妥钠溶液(8 mg/100 g体重),麻醉后迅速打开胸腔,充分暴露心脏,剪去心包组织(图1A-C)。在心尖搏动明显的部位插入灌流针,经左心室到达主动脉升部(肉眼可见),剪开右心耳。打开恒流蠕动泵(图1E),以13 mL/min的流速从主动脉升部灌注生理盐水,直至右心耳流出透明清亮液体,记录生理盐水灌流所需的时间,用于计算其用量。再继续用4%多聚甲醛(4℃)以13 mL/min的流速灌流30 min。打开颅腔,取出脑组织(图1F),进行硬度测试和颜色观察后,置于多聚甲醛溶液中后固定2 h,最后保存至4℃30%蔗糖溶液中。
1.4 硬度测试和颜色观察
将灌流好的脑组织取出,水平放置于平整桌面,用刻度尺垂直水平桌面,测量其高度。接着将印压计通过压头作用于待测组织,通过检测其同等力度下脑袋下陷后的垂直高度,利用前后两次高度,做差比较即可。用印压测试的方法测试其硬度(其中压头重1 649.634 N),并观察记录各器官(大脑、肝脏、肺脏)灌流前后的颜色变化,其具体检测步骤参照以往文献[8]。
1.5 冰冻切片和DCX免疫组化
脑组织在蔗糖溶液中沉底后进行冠状切片,厚度为40 μm,分为6套。取其中一套进行DCX漂片免疫组化染色,步骤参照文献[9-10],并做了适当改进。步骤简单描述如下,脑切片于EDTA抗原修复液90℃水浴孵育15 min,室温放置25 min,0.05% H2O2中孵育30 min。之后在10%兔血清(含0.5%TritonX-100)封闭1 h后,切片在山羊抗DCX抗体溶液(1∶2 000)4℃孵育36 h,室温2 h。生物素兔抗山羊二抗(1∶300)室温孵育2 h,Vector Elite ABC中反应90 min。最后,用0.05%DAB 和0.009%H2O2显色。染色后的脑片贴于防脱载玻片上,晾干后经梯度酒精(75%,95%,100%)各脱水5 min,二甲苯透明10 min,再用中性树胶封片。为了降低染色过程中的变异性,所有染色同步进行,待脑片风干后在显微镜下观察并拍照统计DCX阳性的细胞的数量。
1.6 脑片量化
对应大鼠脑图谱[11]第29—32页,在显微镜放大400倍条件下,量化两侧海马齿状回DCX阳性细胞并计算其密度。每个动物选取4—5张切片。
1.7 统计学处理
采用SPSS 18.0软件进行统计分析,计量资料数据以平均值±标准误(Mean±SE)表示,以P<0.05为差异有统计学意义。

图1 图片显示花鼠灌流固定的一些主要步骤。打开胸腔,暴露心脏和剥开心包膜(A—C),从左心室插入灌流针到主动脉升部,剪开右心耳和结扎腹主动脉(D),打开蠕动泵,用生理盐水和4%多聚甲醛灌流固定(E),取出脑组织(F)Fig.1 Photomicrographs displaying some of the main steps of perfusion and fixation for Siberian chipmunk.Open the chest,expose the heart and peel pericardium(A-C),pass the perfusion needle through the left ventricle into the ascending aorta,cut the right atrium and ligature the abdominal aortas(D),run the peristalsis pump,do the perfusion and fixation with normal saline and 4% paraformaldehyde(E),remove the brain(F)
2 结果
2.1 生理盐水用量
双因素方差分析表明,是否结扎腹主动脉和不同生理盐水的温度(4℃ 和 37℃)对灌流时生理盐水的用量都有显著影响。结扎腹主动脉组所需生理盐水的用量明显低于不结扎腹主动脉组(F(1,21)=67.53,P<0.01);而生理盐水4℃组所需生理盐水的用量明显高于37℃组(F(1,21)=4.36,P<0.05)(图2)。
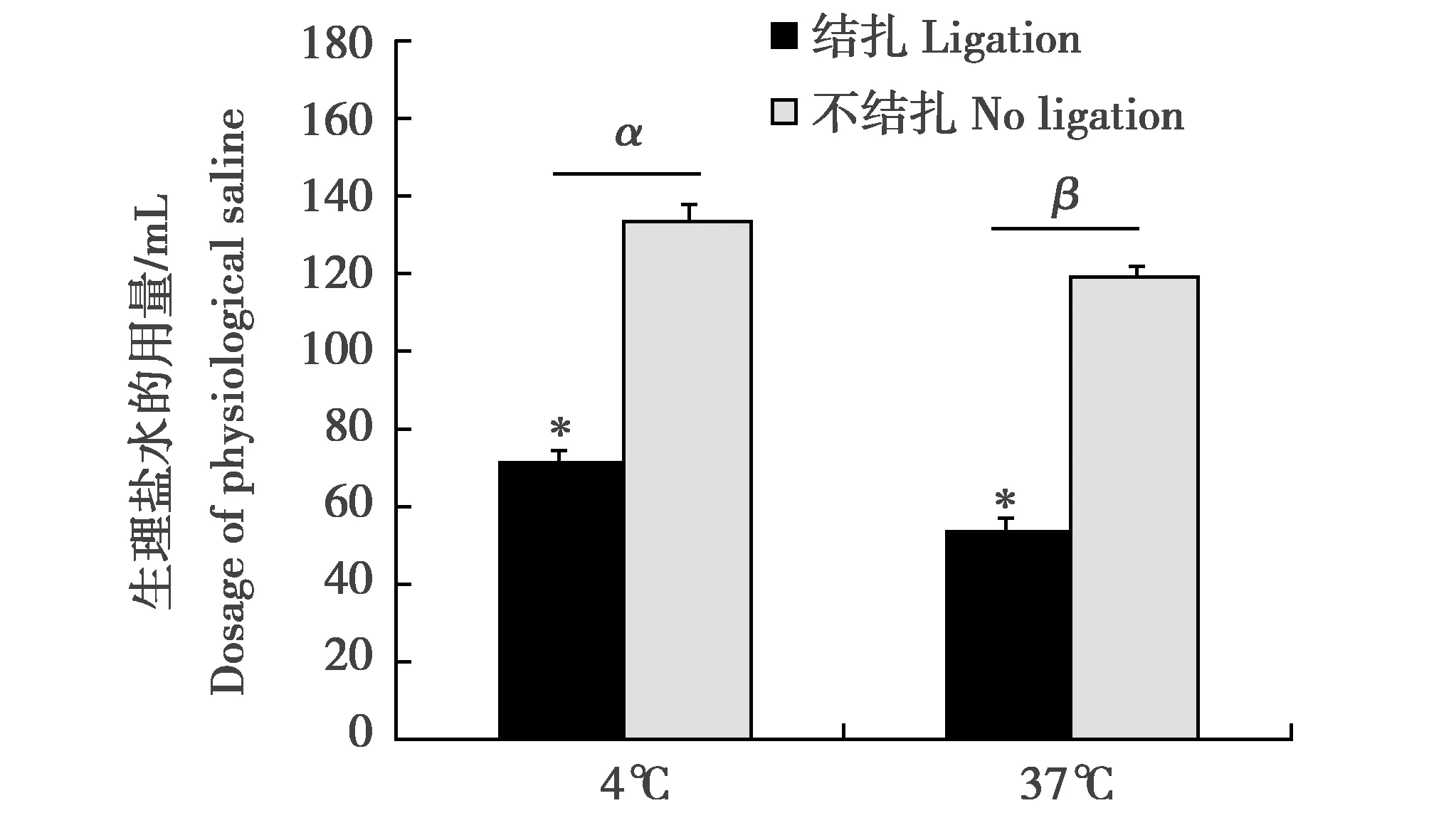
图2 是否结扎腹主动脉及不同温度(4℃和37℃)对脑组织灌流时生理盐水用量的影响。*表示达到P<0.05显著的处理效应,而希腊字母表示温度差异。误差线表示标准误(SEM) Fig.2 The effects of the ligation of the abdominal aortas and temperature(4 ℃ and 37 ℃)on the volume of normal saline.* Indicates significant treatment effects at P<0.05.While Greek letters indicate temperature differences.Error bars represent standard errors of the mean(SEM)
2.2 脑组织的硬度
双因素方差分析表明,是否结扎腹主动脉(F(1,21)=0.77,P>0.05)和生理盐水的温度(4℃ 和 37℃)(F(1,21)=2.35,P>0.05)对脑组织硬度无显著影响(图3)。
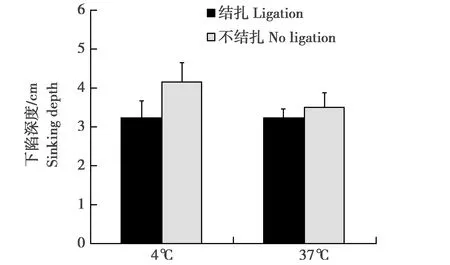
图3 是否结扎腹主动脉及不同温度(4℃和37℃)对灌流后脑组织硬度的影响。误差线表示标准误(SEM) Fig.3 The effects of the ligation of the abdominal aortas and temperature(4 ℃ and 37 ℃)on the hardness of brain tissue.Error bars represent standard errors of the mean(SEM)
2.3 各组织器官灌流前后的颜色变化
4个实验组的脑组织颜色在灌流后均为乳白色,肺脏颜色仍为浅红色。不结扎腹主动脉组肝脏的颜色则由原来的暗红色明显变白,而结扎腹主动脉组肝脏颜色没有发生明显变化。在结扎或非结扎组,不同温度的生理盐水对各组织器官颜色的变化无明显影响。
2.4 海马DG区DCX阳性细胞的密度
双因素方差分析表明,是否结扎腹主动脉对DCX阳性细胞密度无显著影响(F(1,21)=0.001,P>0.05)。生理盐水温度对海马DG区DCX阳性细胞的密度有显著影响(F(1,21)=4.37,P<0.05)。生理盐水4℃组的海马DG区DCX阳性细胞密度与37℃组相比显著更高(图4,图5)。
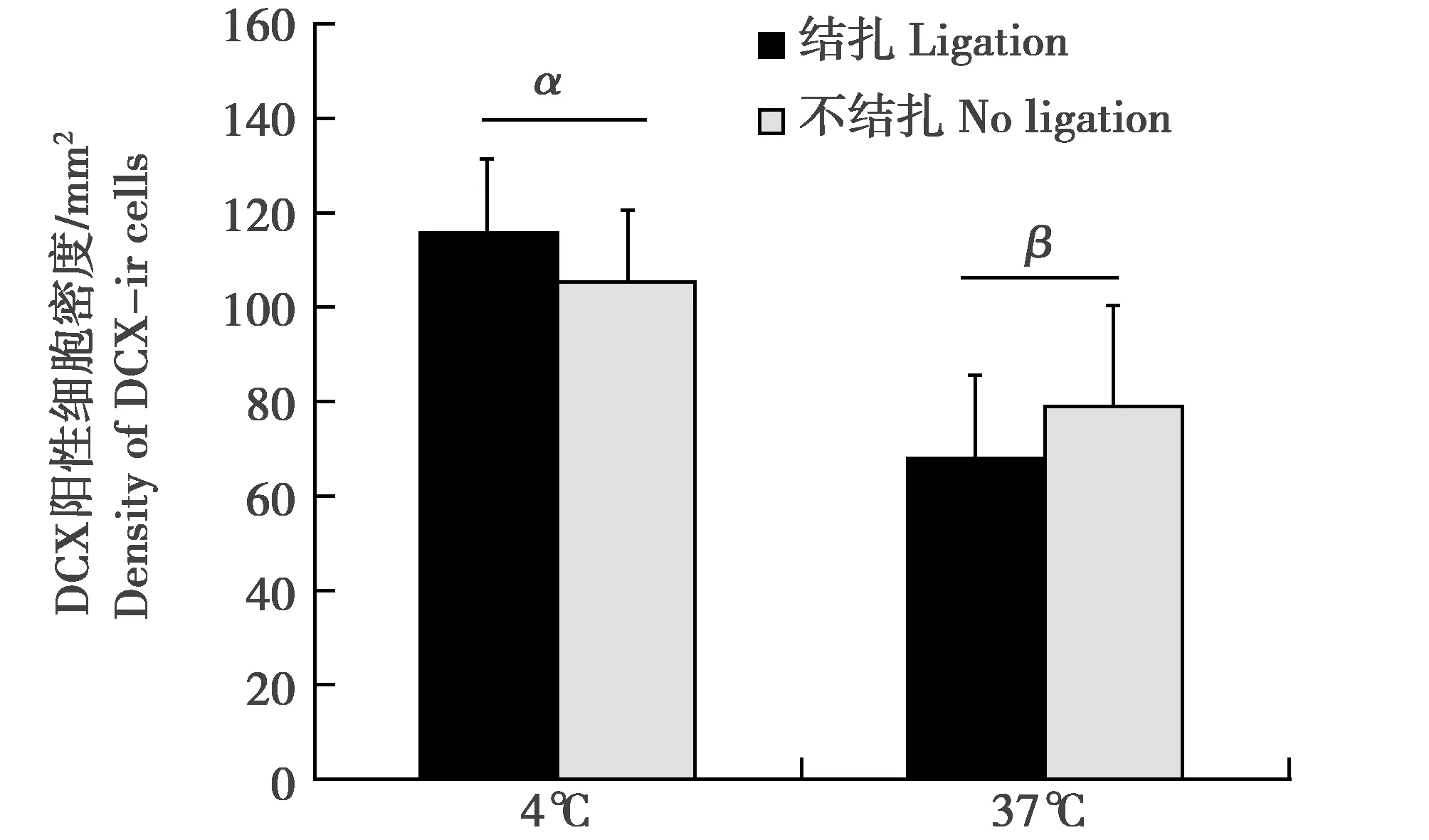
图4 是否结扎腹主动脉及温度(4℃和37℃)对海马DG区域被DCX标记的阳性细胞密度的影响。希腊字母表示温度差异,误差线代表标准误(SEM) Fig.4 The effects of the ligation of the abdominal aortas and temperature(4 ℃ and 37 ℃)on the density of DCX-labeled cells in the dentate gyrus DG of the hippocampus.Greek letters indicate temperature differences.Error bars represent standard errors of the mean(SEM)

图5 4℃(A)或37℃(B)生理盐水灌流后花鼠海马DG区域的DCX阳性染色示意图(×100)。GCL:颗粒细胞层,MCL:分子层,Hilus:门区 Fig.5 Composed photomicrographs displaying DCX staining in the dentate gyrus DG of the hippocampus in chipmunks perfused with 4℃(A)or 37℃(B)normal saline(×100).GCL:granular cell layer of the DG,MCL:molecular cell layer of the DG
3 讨论
脑组织固定常用于脑形态学研究[12]。良好的组织固定是保持细胞形态完整和抗原性的关键,固定可防止组织细胞的自溶与腐败,保持细胞内蛋白质、脂肪、糖等各种成分与生活时相仿[1],脑组织耐氧能力差,对灌流固定条件较为严苛,条件不当就难以完整地保留细胞内的物质[13]。由于各文献报道的脑组织灌流固定条件有所出入,且目前尚无文章对不同条件下的固定效果做统一评价,如是否结扎腹主动脉和生理盐水温度,本文在此方面进行了研究并试图探讨出一套适用于多数小型啮齿动物的灌流方法。
结扎腹主动脉组灌流时所需的生理盐水用量少于不结扎组,省时,省液,且脑组织硬度无明显差异,提示相比单位时间里多聚甲醛流过脑组织的量,脑组织硬度可能与多聚甲醛固定时间更有关。不论是否结扎腹主动脉,脑组织颜色均由鲜红色转变为均匀的乳白色,由于灌流的循环路径不经过肺循环,因此肺脏均保持粉红色。由于结扎了腹主动脉的实验组在灌流时,液体只通过上腔静脉途径而不会经过肝脏,因此结扎组的肝脏颜色没有发生明显变化,始终呈现暗红色。而在没有结扎的实验组中,灌流液会经下腔静脉途径流经肝脏,使肝脏从原来的暗红色转变成白色。免疫组织染色显示,是否结扎腹主动脉对DG区DCX阳性细胞的密度没有显著影响,且脑组织结构清晰,神经元形态完整,印证了固定液对组织的作用时间可能比单位时间流经组织的量,更为影响灌流固定的效果,上述结果说明结扎主动脉不会影响灌流固定后续的实验效果。
生理盐水温度为4℃时其用量显著高于37℃时,这可能跟血管内皮细胞有关。以往研究发现血管内皮细胞对温度变化很敏感,较低的温度会引起其收缩和损伤,导致血管壁的通透性增加[14]。因此,在当前研究中,低温(4℃)生理盐水可能引起血管内皮细胞损伤,而使部分用于清除血液的生理盐水渗出到组织间隙,导致需要更多的生理盐水清除体内的血液。免疫组化结果显示:生理盐水4℃时,DCX阳性细胞密度明显高于37℃,说明灌流温度对DCX阳性细胞的表达存在影响。打开动物胸腔后,大脑缺血缺氧,导致机体开始死亡。以往的研究发现,神经细胞对氧气高度敏感,降低温度可以减少脑组织氧耗并通过降低无氧代谢率来防止脑组织中乳酸堆积,因而可增加神经细胞对缺氧缺血的耐受性从而延缓神经细胞的凋亡[15-16]。因此,低温生理盐水灌注可能延缓了机体死亡后因缺氧引起的DCX阳性细胞的凋亡。
经过此次实验探讨,本文总结出了一套简单且适用于小型啮齿动物免疫组化的灌流方式,即采用左心室心尖入针到达主动脉升部,在结扎腹主动脉后,用4℃的生理盐水快速清除体内的血液,再用4℃的4%的多聚甲醛进行灌流固定,该方法操作简单,省时、省液,有效提高灌流固定效果。
致谢:感谢湖州师范学院医学院张孝利、闻佳颖、杨雨晨同学在实验开展过程中的帮助。
