利用Illumina MiSeq测序平台分析健康与腹泻食蟹猴粪样菌群
2019-08-19张飞燕胡正飞张玉林谢丽分邬继文吕龙宝
张飞燕 金 洁 刘 超 胡正飞 张玉林 谢丽分 邬继文 吕龙宝,2*
(1.中国科学院昆明动物研究所,昆明,650000;2.中国科学院昆明灵长类研究中心,昆明,650223)
食蟹猴(Macacafascicularis)又名长尾猴或爪哇猴,体型较猕猴为小,性情比较温顺,毛色由黄褐色或灰色到暗灰色,腹部颜色略浅。尾长与体长相近似或略长。食蟹猴作为非人灵长类的近亲,与人类的遗传物质高度同源,同源性达 75%—98.5%,在组织结构、生理和代谢功能等许多方面显示出与人类相似的特征,是理想的医学实验用动物,所获得的数据和资料更能准确反映其疾病的自然性,而且能够使研究者从病因、发病机理、临床症状等方面对疾病进行更广泛和深入的研究[1-3]。近年来,已广泛应用于神经生理学 、病毒学等方面的研究[4]。
在人工圈养猴场中,腹泻是食蟹猴最常见的疾病,腹泻主要是指猴子大便次数增多及粪质稀薄呈稀便、水样便而言,引起腹泻的因素很多,但具体原因尚未确定。腹泻与肠道菌群多样性的变化有关。许多研究报道肠道菌群有助于维持宿主的健康,它们对宿主的生理,能量代谢起重要作用,并影响免疫系统[5-6]。既往研究报道了腹泻食蟹猴的病原菌分离鉴定。然而,对于利用高通量测序手段对健康和腹泻食蟹猴的细菌微生物多样性知之甚少。因此,本研究利用高通量测序手段对云南健康和腹泻食蟹猴的粪便菌群微生物多样性进行了初步比较分析,探讨腹泻与食蟹猴粪便菌群关系,为食蟹猴的预防及相关微生态制剂的应用提供科学依据。
1 材料与方法
1.1 样品采集
采取饲养于中国科学院昆明灵长类中心普通级环境(SCXK(滇)K2017-003)的6只成年腹泻雄性食蟹猴和6只成年健康雄性食蟹猴的粪便,准备好粪便容器,带上无菌手套收集新鲜粪便样本立刻放到冰上,用粪便取样器截取样品中段里部2 g左右,健康组编号HM1—HM6、腹泻组编号DM1—DM6,迅速放到液氮罐中,带回实验室-80℃冰箱待检查。采样过程在粪便排泄6 min内完成。动物实验在中国科学院昆明灵长类研究中心进行(SYXK(滇)K2017-0008。
1.2 主要试剂和仪器
Phusion®High-Fidelity PCR Master Mix with GC Buffer,高效高保真酶(New England Biolabs 公司),胶回收试剂盒(AXYGEN公司);PCR仪:ABI GeneAmp®9700型。
1.3 细菌总DNA提取和PCR扩增
采用SDS方法对12个样本的DNA进行提取,之后用脂糖凝胶进行电泳检测DNA的纯度和浓度,稀释样品至1 ng/μL。以稀释后的基因组 DNA 为模板,针对16S RNA的V3—V4区(338F-806R),使用带 Barcode 的特异引物进行PCR扩增。PCR产物使用琼脂糖凝胶进行电泳检测;根据PCR产物浓度进行等量混样,充分混匀后使用浓度2%的琼脂糖胶电泳纯化PCR 产物,剪切回收目标条带。使用Thermo GeneJET 胶回收试剂盒(Thermo Scientific 公司)回收。
1.4 文库构建和上机测序
使用Thermofisher 公司的Ion Plus Fragment Library Kit 48 rxns 建库试剂盒进行文库的构建,构建好的文库经过Qubit 定量和文库检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序。测序工作在诺禾致源完成。
1.5 生物信息分析流程
测序后的数据进行优化处理得到Clean Reads,将所有样品的Clean Reads按97%的一致性将序列聚类成为OTUs,OTU聚类分析,进行样品复杂性分析(计算Chao指数、Ace指数、Sobs指数和覆盖指数(Coverage)等多样性指数。每个样本都做了稀释性曲线和Shannon指数曲线。并从各个分类水平上进行健康组与腹泻组两组之间优势菌群和差异菌群组成分析。
2 结果和分析
2.1 测序水平
本研究利用Illumina MiSeq测序平台对健康食蟹猴和腹泻食蟹猴粪便共12个样本的V3-V4区进行测序研究,测序数据经过优化分析,健康组共得到432 276条有效序列,每个样本的有效序列都超过60 000条,平均每个样本获得72 046条。腹泻组共有473 090条有效序列,每个样本的有效序列都超过70 000条,平均每个样本获得78 848条。这些序列共分属于14个门、23纲、44目、77科、160属、142种。通过对测序数据按97%的相似水平进行聚类分析,健康组平均每个样本获得672个OTU,腹泻组平均每个样本获得509个OTU。
2.2 样品的复杂度分析
基于OUT聚类分析结果,通过样品稀释曲线和等级聚类曲线分析(图1),12个样品稀释曲线随着测序量数据的增加曲线趋向平坦,并且覆盖度good’s coverage达到99.97%,说明测序数据量渐进合理,更多的数据量只会产生少量新的物种(OTUs),目前的测序量能够覆盖样本中的绝大部分物种。两组样本检测到的OTU丰富度Chao指数(700.446±41.123 vs.543.229±90.379,P<0.05)、Ace指数(707.902±38.843 vs.546.624±93.145,P<0.05)、Shannon指数(6.511± 0.265 vs.6.125± 1.071,P>0.05)、Simpson指数(0.970±0.007 vs.0.960±0.039,P>0.05)。通过Shannon、Simpson指数分析,腹泻组的粪便微生物多样性下降但差异不显著,通过Chao指数、Ace指数分析,腹泻组的微生物群落丰富度显著下降(表1)。通过Venn图分析健康组和腹泻组共有771个OTU,健康组独有168个OTU,腹泻组独有125个OTU。
基于PCA主成分分析,图中正方形和圆形分别表示来源为健康与腹泻食蟹猴粪便样本,第一个主坐标(PC1)捕获了33.8%的变异,第二个主坐标(PC2)捕获了14.4%的变异,健康组与腹泻组各聚在一边(图2)。PCA结果表明,健康食蟹猴和腹泻食蟹猴的细菌群落组成存在明显差异。
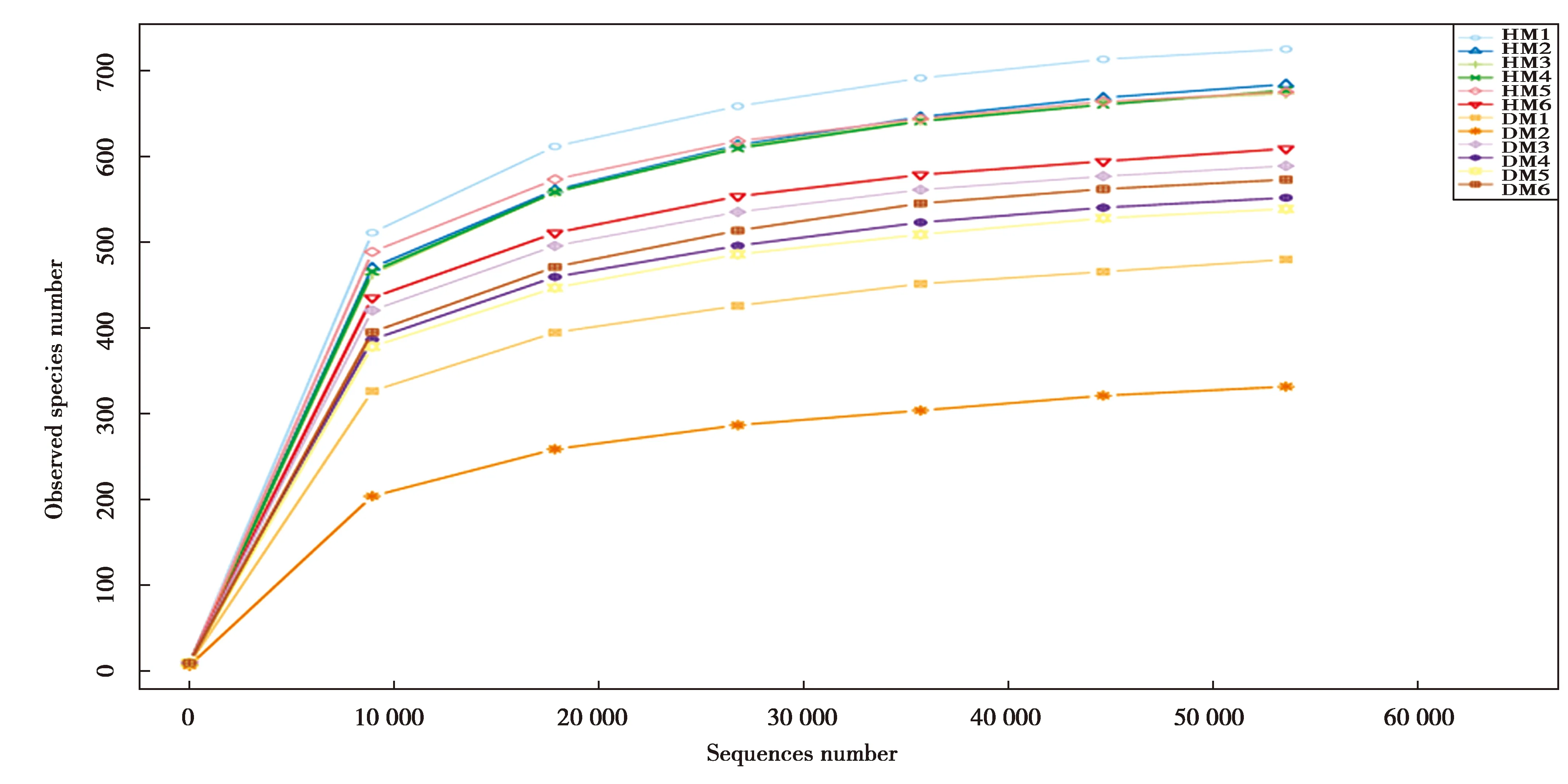
图1 稀释曲线Fig.1 Shannon rarefaction curves
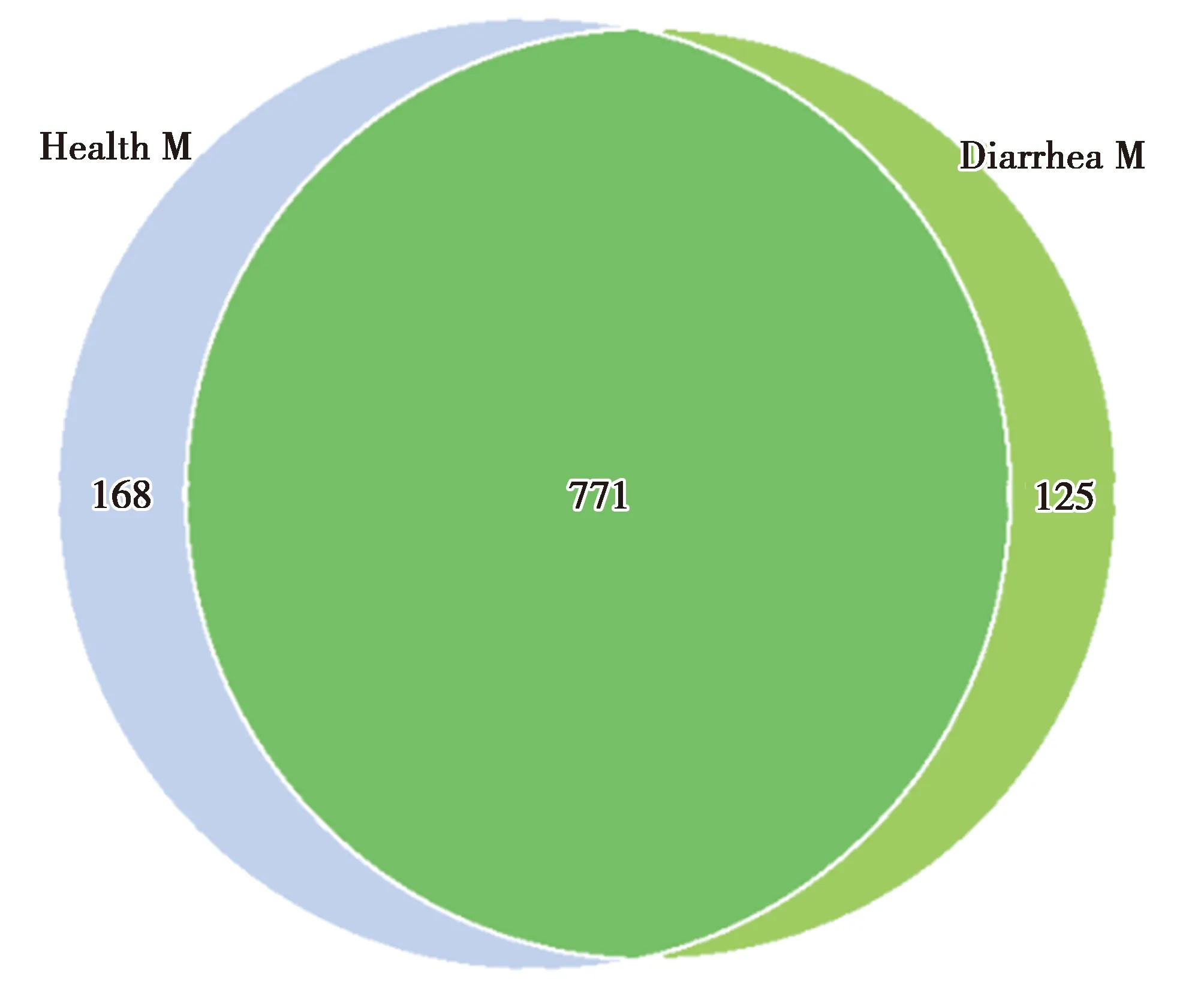
图2 韦恩图Fig.2 Venn graph
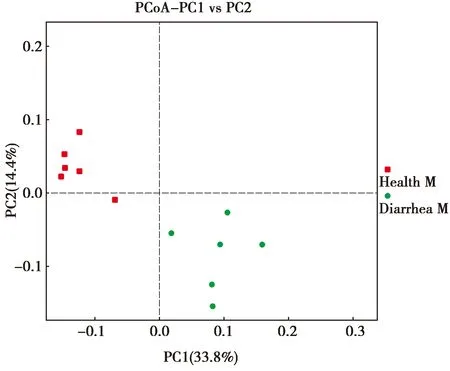
图3 PCA分析Fig.3 PCA analysis
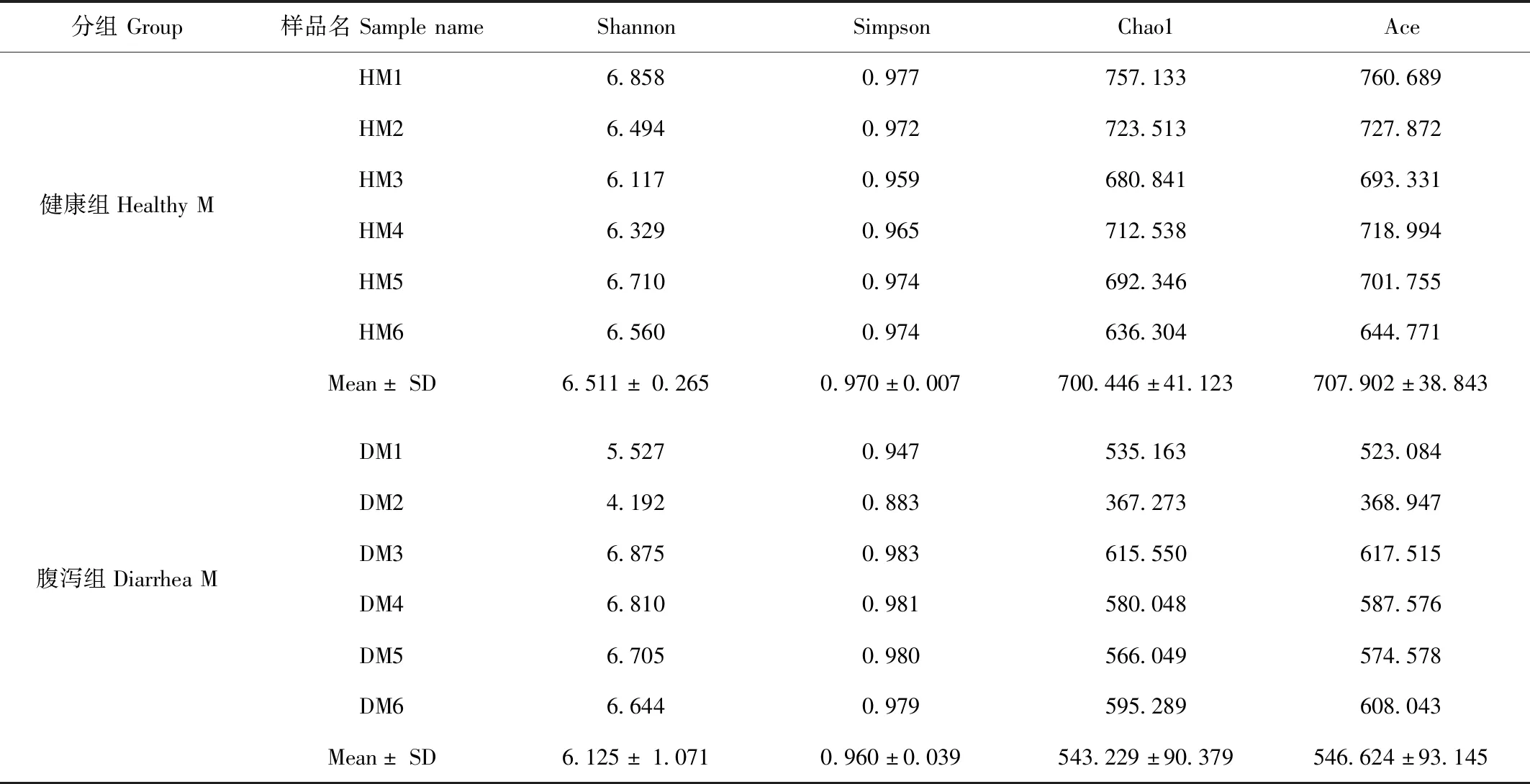
表1 Alpha 多样性指数分析Tab.1 Alpha diversity
注:分析方法采用独立样本t检验,显著水平为 0.05;数据采用平均值±标准差
Note:The analysis method used independent samplettest,and the significance level was 0.05.Data were taken as mean standard deviation
2.3 在不同分类水平上优势菌群组成分析
在门水平上,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为2大优势菌门。厚壁菌门在健康组和腹泻组的平均含量为55.85%和46.82%,拟杆菌门在健康组和腹泻组的平均含量为39.96%和45.4%。其次丰度大于1%的门健康组有螺旋体门(Spirochaetae),腹泻组有变形菌门(Proteobacteria)、螺旋体门。
在属水平上乳酸杆菌属(Lactobacillus)、链球菌属(Streptococcus)、未分类的普雷沃氏菌科(Prevotellaceae)为主要菌属,其中乳酸杆菌属在健康组的平均含量为13.42%,明显高于腹泻组(2.77%),链球菌属在健康组的平均含量5.52%高于腹泻组3.82%,未分类的普雷沃氏菌科unidentified Prevotellaceae在健康组的平均含量6.13%大于腹泻组3.73%。
2.4 物种组成差异比较分析
通过MetaStat方法研究组间具有显著性差异的物种,从不同层级的物种丰度表出发,展示不同分类水平具显著差异top10的物种。在门水平上,健康组与腹泻组的优势菌门都为厚壁菌门,门之间没有显著差异。在纲水平上,健康组芽孢杆菌纲(Bacilli)的平均含量19.03%显著高与腹泻组的7.7%(P<0.05)。在目水平上,健康组乳酸杆菌目(Lactobacillales)平均含量(19.03%)显著高于腹泻组(7.7%)(P<0.05),慢生单胞菌目(Bradymonadales)只存在腹泻组中。在科水平上健康组的乳酸杆菌科(Lactobacillaceae)平均含量13.42%显著高于腹泻组的2.7%。在属水平上,乳酸杆菌属和罕见小球菌属(Subdoligranulum)在健康组腹泻组中差异显著,乳酸杆菌属在健康组中平均含量为13.42%显著高于腹泻组的2.7%(P<0.05),罕见小球菌属在腹泻中的平均含量1.9%显著高于健康组0.6%(P<0.05)。
另外通过LEfSe(LDA Effect Size)分析(LDA阈值为1),乳酸杆菌目,芽孢杆菌纲,乳酸杆菌科,乳酸杆菌属,拟普雷沃菌属(Alloprevotella)在健康组中显著富集,弯曲杆菌科(Campylobacteraceae)弯曲杆菌属(Campylobacter)在腹泻组显著富集。
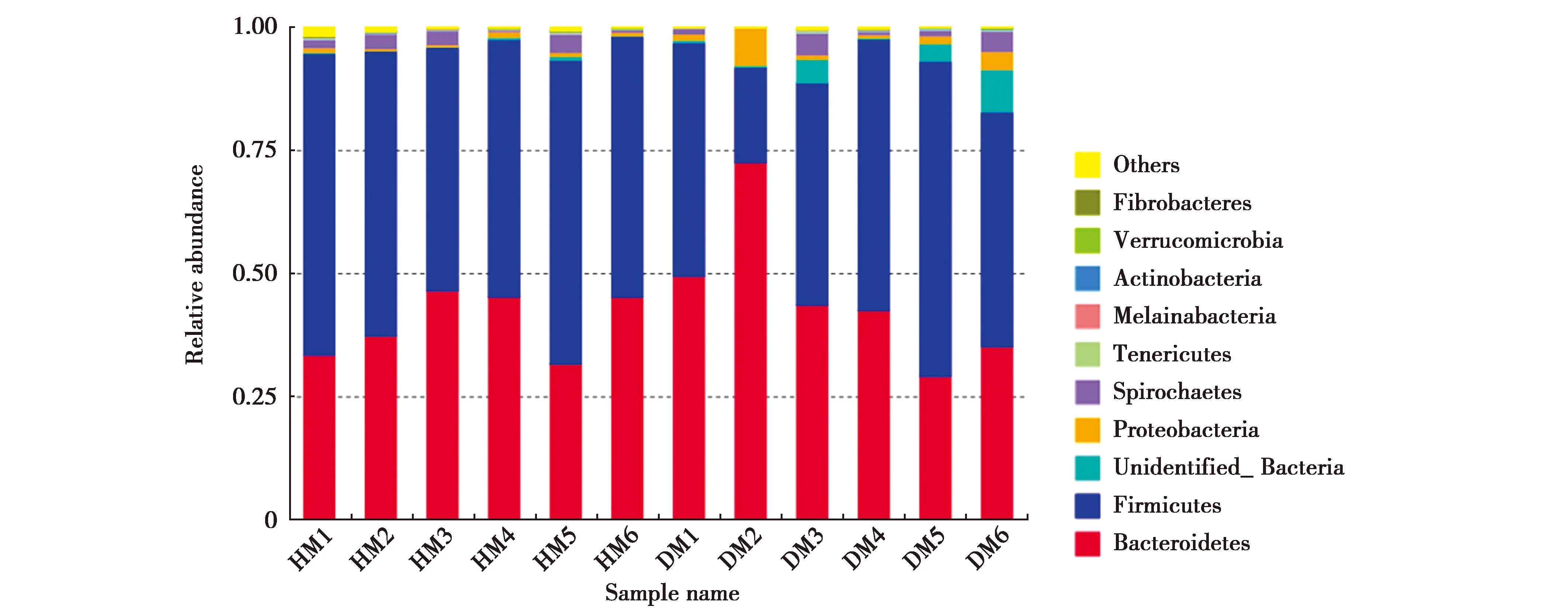
图4 在门水平上的菌群组成Fig.4 Community analysis pieplot on phylum level

图5 在属水平上的菌群组成Fig.5 Community analysis pieplot on genus level
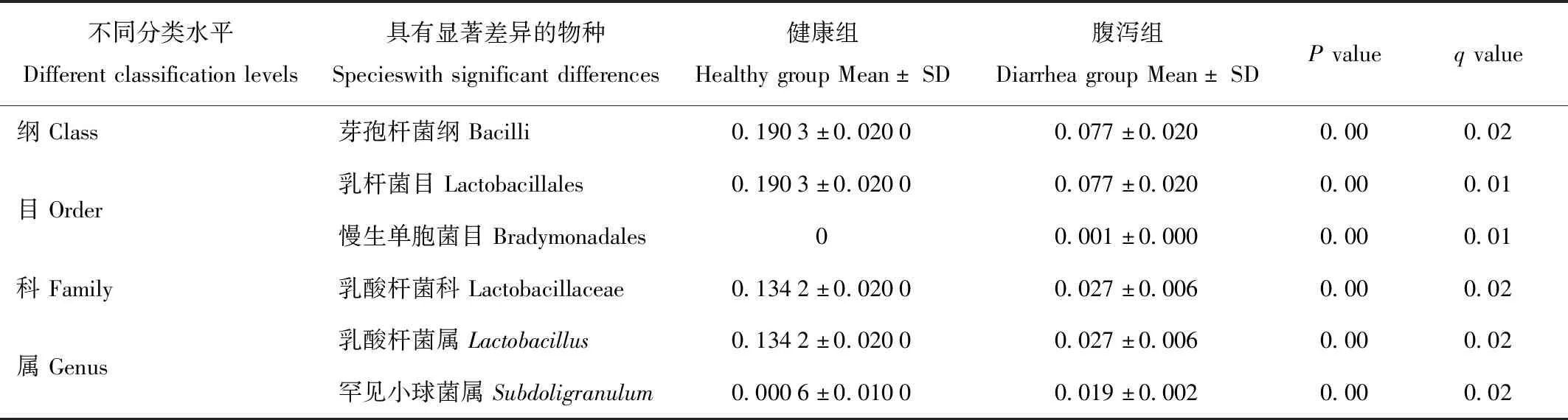
表2 MetaStat分析组间差异显著的种Tab.2 Comparison of microbial community structure in phylum level in diffrent groups by Metastats

图6 LEfSe(LDA Effect Size)分析图Fig.6 LEfSe analysis of different species
3 讨论
食蟹猴是自然界中较为常见的一种猴,主要分布在泰国、老挝、马来西亚等国家的热带雨林。由于生活环境的改变使得表现为腹泻的慢性肠炎成为饲养食蟹猴最常见的疾病。造成腹泻的原因有很多,细菌感染、病毒感染、寄生虫感染、食物毒素污染和消化不良等均是腹泻的常见病因。中国科学院昆明灵长类研究中心检疫、饲养等均十分专业,在排除猴免疫缺陷病毒(SIV)、结核感染的养殖食蟹猴中,更排除了饲养条件造成的失误。除了动物生活环境的改变,并未发现明显异常。对饲养食蟹猴腹泻病原微生物方面的检测,并不能证明其与特定的病原微生物相关,抗生素虽在短期内可缓解腹泻症状,但从整个慢性病程看,并无效。无论何种原因造成的腹泻,肠道菌群都出现严重的比例失调。
动物的消化道拥有一个复杂的生态系统,被称为微生物群,宿主自身需要依赖微生物菌群的协助,才能降解食物中的纤维素、木质素等物质,它们对宿主的生理、能量代谢起重要作用,并影响免疫系统[7-8]。本研究利用高通量测序技术对健康和腹泻食蟹猴粪便菌群进行差异分析。本试验的Shannon 稀释曲线趋近平缓及本试验的覆盖度(good’s coverage)达到99.99%,说明了对所取样本微生物群落的检测比率接近饱和。目前的测序量能够覆盖样本中的绝大部分物种。通过Venn图分析,健康组与腹泻组共有771个OTU,健康组独有168个OTU,腹泻组独有125个OTU。通过对健康组与腹泻组食蟹猴Alpha多样性指数进行分析,腹泻食蟹猴粪便菌群结构发生一定的改变,但这种结构改变在微生物多样性指数方面没有表现出显著地差异(P>0.05),这与王剑等报道的健康与腹泻川金丝猴细菌微生物多样性差异结果一致[9]。在群落丰富度指数方面表现出显著地差异(P<0.05),腹泻组的菌群丰富度显著下降。这和通常认为的腹泻发生后肠道微生物结构趋于简单的结论相符[10]。从PCA主成分分析结果图中可以看出,健康组(HM1—HM6)与腹泻组(DM1—DM6)2组样本形成明显的2个族,表明健康组与腹泻组的菌群是存在差异的。
通过对健康组与腹泻组的物种组成进行分析,发现腹泻组食蟹猴的粪便中有益菌属乳酸杆菌属明显下降,致病菌属弯曲杆菌属(Campylobacter)在腹泻组中显著升高。周勤等[11]报道的采用传统分离培养调查食蟹猴中弯曲杆菌感染的阳性率较高为57.48%,主要为空肠弯曲杆菌(Campylobacterjejuni)和大肠杆菌(Escherichiacoli),且通过比较不同养殖场实验猴弯曲杆菌的感染率发现弯曲菌适于潮湿的环境条件,说明弯曲菌可以通过改善饲养环境来进行控制。从而推断腹泻样本中是由于有益菌属乳酸杆菌属定植减少,致病菌属弯曲杆菌属增多,致使菌群失调。乳酸杆菌被视为动物胃肠道中重要的益生菌,拥有多种消化酶完善机体消化功能,同时通过代谢产生乙酸、丙酸、丁酸等降低环境pH值,从而抑制腐败细菌及有害细菌的生长繁殖[12]。弯曲杆菌属是一类主要寄存在哺乳动物和禽类肠道中的革兰氏阴性杆菌,该属中的空肠弯曲杆菌、大肠弯曲杆菌(Campylobactercoli)、胎儿弯曲菌(Campylobacterfetus)等可通过直接接触和食品污染而使人类致病。并且目前已经认识到空肠弯曲杆菌在世界范围内是引起人类细菌性胃肠炎的一个最主要致病因素。人感染该菌后主要表现为急性肠炎,如出现腹泻、不适、发热、腹痛和血便等症状[13-14]。由弯曲菌引起的腹泻与沙门氏菌(Salmonella)引起的腹泻同样普遍,并已超过了志贺氏菌(Shigella)引起的腹泻。这将对饲养、实验人员的健康构成威胁,因此我们应加强工作人员防护,并从改善饲养环境入手,降低或消除实验猴弯曲菌感染 。
目前已有报道通过饮食添加益生菌、益生元达到治疗和预防腹泻等IBS疾病(肠易激综合征)已取得显著成效[15-17]。尤其是增加日粮中膳食纤维含量,调节肠道微生物中双歧杆菌(Bifidobacterium)数量,达到治疗和预防腹泻等IBS病的目标。能否通过添加微生态制剂,或调整圈养食蟹猴饲粮结构,尤其是增加纤维含量,达到降低食蟹猴胃肠道疾病的发生,提高食蟹猴的品质。未来在食蟹猴益生菌研究及腹泻防治方面还需进一步的研究。
