扶正解毒祛瘀方联合奥沙利铂对人结直肠癌裸鼠移植瘤的影响
2019-08-19张桂贤赵秀梅刘晓芸刘洪斌柴仲秋
张桂贤,赵秀梅,刘晓芸,刘洪斌,周 冰,柴仲秋
2018年结直肠癌(colorectalcancer,CRC)新发病例约为110万,发病率及癌症相关死亡原因在男性中为第3位,而在女性中已上升至第2位[1]。在中国,CRC发病率的上升速度是国际平均增速(2%)的2倍,尤其在上海等东南沿海发达城市,发病率已达到实体瘤的第2位,严重威胁着人类的健康和生活质量[2-3]。化疗是CRC综合治疗中非常重要的手段,含L-OHP在内的FOLFOX4方案被NCCN指南推荐为II,III期大肠癌患者的一线治疗方案[4-5],但是化疗耐药影响了其疗效的进一步提高。因此,寻找低毒、有效的化疗增敏药物具有重要意义。
中医药辅助治疗因其不良反应少,依从性好而在近些年来备受关注。尤其是在增强CRC术后化疗效果、减轻毒副作用、降低术后复发和转移率和延长生存期等方面凸显优势[6-7]。本次研究,以扶正解毒祛瘀为立法组方,以参苓白术散,桃红四物汤和小承气汤为基础,针对大肠癌术后常见的气虚毒瘀证型进行治疗,观察扶正方是否能为化疗在药物增敏、减毒方面提供有益的辅助作用。
1 材料
1.1 细胞及动物 人结直肠癌HT-29细胞购自中国科学院典型培养物保藏委员会细胞库。SPF 级雄性BALB/c裸鼠40只,4~6周龄,体重16~18 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001;饲养于动物中心屏障级动物室(许可证号:SYXK(津)2011-0003)中,温度(23±1)℃,湿度40%~50%。实验前适应性喂养3天,饮水,摄食,每日12 h交替照明。
1.2 药物与试剂 扶正方由太子参(30 g)、薏苡仁(30 g)、生槐花(20 g)、知母(15 g)、当归(15 g)、黄 柏(15 g)、 桃 仁(15 g)、 红花(15 g)等中药组成,由天津市滨海新区中医医院提供。按照临床用药煎煮方法浓缩成2.015g生药/g的浸膏,装于密闭玻璃瓶中,4℃保存,批号:20150909。注射用L-OHP(南京制药厂有限公司,批号:201411132,规格:50 mg/瓶);RNA提取试剂(Trizol Reagent),反转录酶(M-MLV),RNA酶抑制剂(RNase Inhibitor)(美国Thermo fisher Scienti fic公司);引物合成(北京Ivitrogen生物技术公司);兔源PCNA,Cyclin D1,β-actin抗体(美国CST公司),兔源P21,CDK4抗体(美国Abcam公司);山羊抗兔IgG/辣根酶标记二抗(北京中杉金桥生物技术有限公司)。
1.3 仪器 KHB ST-360酶标仪(上海科华);HH-2数显恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);Kubota3500冷冻离心机(日本久保田公司);超声波细胞破碎仪(美国SONICS公司);H1220烤片机,RM2235切片机,ASP 200S型全自动组织脱水机,EG 1150H包埋机,EG 1150C型冷冻台,DM4000B 型显微镜,DM4000B 型图像采集仪(德国Leica公司)。
1.4 方法
1.4.1 人结直肠癌裸鼠移植瘤模型的建立 取对数生长期生长状态良好的人结直肠癌HT-29细胞,吹打成细胞悬液,取0.3 mL注射到裸鼠右前肢腋下,进行传代培养扩增。经过10~14天,待皮下肿瘤生长至直径约1~1.5 cm时,选择肿瘤生长旺盛且无表皮破溃的荷瘤鼠, 作为供瘤鼠。将裸鼠脱颈后处死,在超净工作台中,取出瘤组织,进行研磨,制成肿瘤细胞悬液,调整细胞浓度,按1×107个/mL的细胞数量接种到裸小鼠右侧腋下,每只鼠接种0.2 mL。每日观察肿瘤生长情况,待肿瘤直径达5~6 mm时,即可将动物随机分组。
1.4.2 动物分组和给药 将40只荷瘤裸小鼠随机分成空白组、扶正方组、L-OHP组和扶正方+L-OHP组,每组10只。本实验根据“人和动物体重折算系数”换算用药剂量,小鼠给药剂量为人的11倍。空白组给予生理盐水灌胃,扶正方(50g/kg)为灌胃给药;L-OHP(10 mg/kg)为腹腔注射给药(ip)1次。扶正方+L-OHP组为L-OHP腹腔注射给药(ip)1次,扶正方灌胃(ig)给药,每日1次,连续21 d。分组当日即给药,末次给药后,次日称体质量,按规定处死动物,剖取瘤组织,胸腺,脾脏称重。
1.4.3 小鼠体质量,瘤重的变化并计算抑瘤率在首次给药后,第0、3、6、9、12、15、18、21天各小鼠用游标卡尺测量瘤块的长径(a)和短径(b),按公式V=1/2×a×b2,计算肿瘤体积,同时称量动物体重。并观察小鼠的生活状态及注射部位皮肤有无坏死,末次给药后24 h,小鼠摘取眼球取血,收集全血备用。处死动物,解剖脾脏及肿瘤组织并称重,计算脏器系数及抑瘤率。
1.4.4 合并用药疗效判断 按照金氏公式判定两药协同效应:拮抗,相加或增强。q=E(A+B)/(EA+EB-EA×EB),E(A+B)为两药合用时的抑制率。若q<0.85表示联合用药有拮抗效应;若q>1.15表示联合用药有增强效应;而0.55<q<0.85表示联合用药有相加效应。
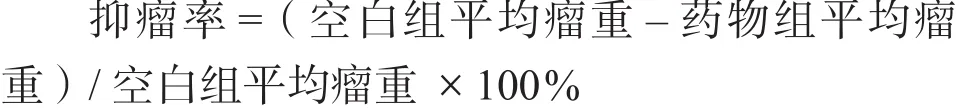
1.4.5 小鼠的脾指数 末次给药后处死小鼠,取出脾脏,用滤纸吸干后称重。

1.4.6 实时荧光定量PCR 检测瘤体样本中Cyclin D1,CDK4,PCNA,P21 mRNA的表达水平。按照试剂说明书的步骤,提取各组肿瘤组织中总RNA,用Nanodrop2000紫外-可见分光光度计检测RNA样品浓度及纯度再进行逆转录。用TaKaRaPCR试剂盒,对cDNA进行PCR检测,引物由Invitrogen公司合成,具体序列见表1。

表1 引物序列
Real-Time PCR采用TaKaRa PCR试剂盒,按试剂盒的操作说明书配置反应体系,进行PCR,扩增条件:95 ℃,5 min ;95 ℃,20 s;60 ℃,20 s;72 ℃,20 s;;50 个循环,72 ℃,5 min。总反应体系为25 μL。采用公式2-ΔΔCt对PCR结果进行数据分析,计算ΔCt= Ct目的基因- Ct内参基因;ΔΔCt=ΔCt给药组-ΔCt对照组;差别倍数 =2-ΔΔCt,其中正常组的数值均为1。
1.4.7 Western blot 检测瘤体内相关蛋白的表达。取100 mg新鲜的肿瘤组织,PBS洗涤1次,加入RIPA裂解液200 μL,提取总蛋白,分装于离心管中。用BCA法测定蛋白浓度,每孔蛋白上样20μg,进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDSPAGE)电泳,湿转法转膜至聚偏二氟乙烯(PVDF)膜上,5%脱脂牛奶封闭1 h,TBST缓冲液洗膜,加入一抗4℃孵育过夜(抗体稀释度分别为PCNA(1:1000),CDK4(1:2000),Cyclin D1(1:1000),P21(1:1000),β-actin(1:1000))。 次 日 取 出,置于洗膜容器中,TBST缓冲液洗膜3次。加入二抗,于室温下水平摇床上孵育辣根过氧化物酶(HRP)标记的二抗1 h。避光条件下滴加增强化学发光(ECL)液,经荧光底物反应后,凝胶成像仪曝光成像、分析条带光密度值。目的蛋白与内参光密度的比值即为目的蛋白的相对表达量。
1.5 统计学分析 应用SPSS 22.0软件进行数据处理及统计学分析,定量数据结果以表示。多组均数间比较采用单因素方差分析,两组均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 对荷瘤小鼠体质量的影响 给药前各组小鼠体质量差异无统计学意义。给药结束后,L-OHP组小鼠体质量减轻幅度最大。与空白组比较,用药后第9、15、18、21天L-OHP组体质量均有下降(P<0.05,P<0.01);与L-OHP组相比,用药后第6、9、12、15、18、21天,扶正方组小鼠体质量增加显著(P<0.01),联合用药组体重增加也较多,其中第9、12、15天,增加显著(P<0.05,P<0.01),见图 1。

图1 扶正方联合L-OHP对荷瘤小鼠体质量的影响
2.2 对荷瘤小鼠皮下移植瘤及脾指数的影响 实验结束时,与空白组比较,L-OHP组,扶正方+L-OHP组瘤重显著降低(P<0.05,P<0.01)。扶正方+L-OHP组瘤重的q为1.23,扶正方与L-OHP联合用药效应表现为增强效应。与空白组比较,扶正方组脏器指数显著增加(P<0.01)。见表2。
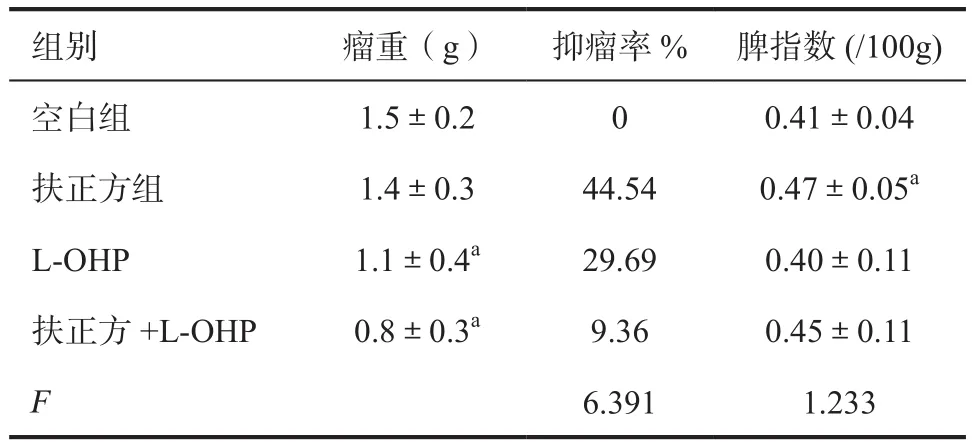
表2 扶正方联合L-OHP对荷瘤小鼠瘤重及脾指数的影响
与空白组比较,L-OHP组,扶正方+L-OHP组瘤体积显著下降(P<0.01),且扶正方+L-OHP组抑瘤作用出现的时间更早,效果更好一些,表现出能够增强化疗药的作用。见图2。
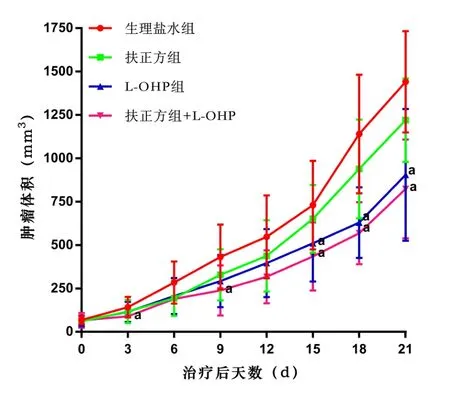
图2 扶正方联合L-OHP对荷瘤小鼠瘤体积的影响
2.3 对cyclin D1、CDK、PCNA和P21蛋白表达的影响 与空白组相比,扶正方组,L-OHP组,扶正方组+L-OHP组,cyclin D1,CDK4,PCNA蛋白表达下调(P<0.05,P<0.01),P21蛋白表达上调(P<0.05),联合用药作用更明显(P<0.01)。与L-OHP组相比较,扶正方组+L-OHP组Cyclin D1,PCNA 显著下调(P<0.01),P21的蛋白表达显著上调(P<0.01)。见图3、表3。

图3 周期相关蛋白Cyclin D1、CDK4、PCNA、P21在各组小鼠肿瘤组织中的表达
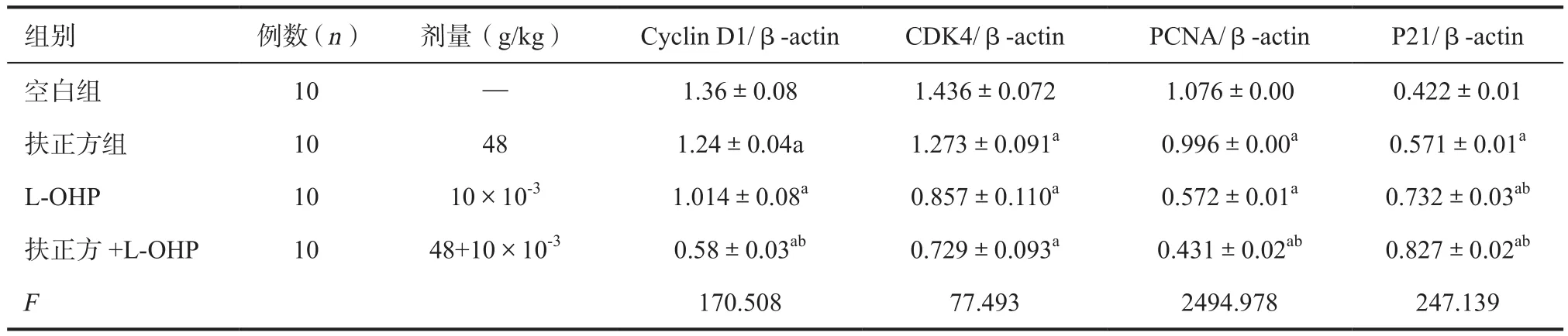
表3 扶正方联合L-OHP对荷瘤小鼠瘤体中周期相关蛋白Cyclin D1、CDK4、PCNA、P21表达的影响
2.4 对cyclin D1,CDK4,PCNA,P21mRNA表达的影响 与空白组相比,扶正方组,L-OHP组,扶正方组+L-OHP组,cyclin D1,CDK4,PCNA蛋白表达下调(P<0.05,P<0.01),P21蛋白表达上调(P<0.01),联合用药作用更明显(P<0.01)。与L-OHP组相比较,扶正方组+L-OHP组PCNA显著下调(P<0.01),P21的蛋白表达显著上调(P<0.01)。见表4。
3 讨论
L-OHP是临床上治疗CRC的传统化疗药物。一些Ⅲ期临床试验的结果表明L-OHP能延长患者的无病生存时间,总体生存时间。但是,L-OHP具有神经毒性,且风险随L-OHP的累计摄入剂量增加而增加。因此,选择能够增强疗效或减少L-OHP毒性作用的药物作为化疗辅助用药,对患者而言是非常有利的[8]。中医认为,在肿瘤进展过程中,“正气亏虚”的影响不容忽视。一方面,肿瘤作为慢性消耗性疾病,正邪交争,不断损耗正气,致使机体不耐攻伐;另一方面,放化疗等治疗手段的应用,在杀死肿瘤细胞,缩小癌灶的同时,抑制免疫功能,破坏机体调控功能,导致正气亏虚[9]。本研究结果显示,应用扶正方做为L-OHP的辅助用药,不仅能够提高化疗药的治疗效果,而且能够增强小鼠的免疫功能、减少化疗副反应,为临床上应用于针对大肠癌术后常见的气虚毒瘀证型提供了理论依据,可以作为术后化疗的有益辅助。
细胞周期既是细胞生命活动的基本过程又是一种非常精细的调节过程,细胞周期根据DNA的含量不同可分为G0/G1期,S期,G2/M 期,细胞周期控制点决定了DNA 复制,细胞分裂起始与结束的循序进展,是调节细胞周期的关键。细胞周期的调节失衡会引起肿瘤基因异常表达,从而出现肿瘤细胞的增殖调控失衡,最后导致肿瘤的形成和发展[10]。细胞周期的调控可分为外源性调控和内源性调控。外源性调控主要是由外界刺激引起的,而内源性调控主要是通过组成对细胞周期进行调控的cyclins-CDKs-CKIs系统,维持着细胞的正常生长和分化[11]。
细胞周期蛋白cyclin D1作为调控细胞G1期的关键蛋白,对细胞周期的调控至关重要。在G1中后期,cyclin D可与它的分子伴侣CDK4或CDK6结合进入细胞核,并激活形成视网膜母细胞瘤蛋白(retinoblastoma protein,pRb)激酶复合物,使下游的蛋白质Rb及其相关蛋白磷酸化,从而启动DNA复制。cyclin D在细胞周期中扮演着多重角色,作为生长因子的感受器,cyclin D介导生长的信号到细胞核内,从而启动细胞的生长分裂。作为细胞周期运行的促进因子,cyclin D和Cdk4或Ck6结合,导致pRB无法抑制E2F转录因子,从而使转录因子被激活,加速基因转录并使细胞由G1期向S期过渡,促进细胞周期的进程,从而促进增殖,与多种肿瘤的发生发展密切相关[12]。而细胞周期抑制因子主要是细胞周期依赖性激酶(CDKs)抑制因子,主要成员包括P21、P27等。P27和P21主要通过抑制CDKs 复合物活性参与细胞周期的调控,阻断细胞由G1期向S 期的过渡,达到对细胞周期的抑制作用,被归为抑癌基因[13]。PCNA与CyclinD1一样,是重要的细胞增殖标志物,是标志细胞增殖状态的重要基因[14]。
本研究结果显示,在治疗期间,未发生与治疗相关的死亡,小鼠接种部位皮肤也未见破溃或坏死。与N.S组相比,扶正方联合L-OHP组荷瘤小鼠平均体积、瘤重均显著下降(P<0.01),效果优于化疗药单用组。经扶正方治疗后,合用组荷瘤小鼠平均体质量下降情况明显改善。而且,我们在对动物免疫器官脾进行脏器指数测定后也发现,扶正方组小鼠免疫器官脏器指数明显大于N.S组。据此,我们推测扶正方对小鼠肿瘤的改善作用,主要是通过减少化疗药的毒性作用,调节机体的免疫功能来实现。
肿瘤的形成与发展有多种机制的参与,一般认为,癌变的重要原因是细胞周期失控,造成具有促增殖活性的CDK过度表达,产生细胞增殖失控而导致癌变。为了进一步观察扶正方的作用机制,本实验对细胞周期相关蛋白进行了一系列检测,从多方面进行了验证。Western blotting 检测发现,经治疗,给药组的CDK4,cyclinD1与PCNA蛋白的表达下调,P21蛋白表达上调,联合给药组作用更明显。
综上,本研究从多方面系统地对两药的联合作用进行了探讨,显示了扶正方和L-OHP联合用药具有合理性,为进一步完善大肠癌的联合用药方案提供了实验依据,希望能够为临床应用提供一些理论支持。
