晚期糖基化终末产物受体、核转录因子在小鼠急性肝衰竭中的作用
2019-08-15张留鲁邵和军
张留鲁 邵和军
(贵州省人民医院感染科,贵州 贵阳 550002)
急性肝功能衰竭具有起病急、预后差及病死率高的特点,经过多年的研究,现已证实以单核细胞、巨噬细胞、淋巴细胞等免疫细胞动员和白介素1(interleukin-1,IL-1)、白介素6(interleukin-6,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)多种炎性因子的过度释放为代表的免疫系统过度活化在急性肝功能衰竭过程中发挥重要作用[1]。晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)是一种模式识别受体(pattern recognition receptor,PRR),可表达于淋巴细胞、单核细胞、淋巴细胞等多种免疫细胞,参与调节免疫应答[2]。核转录因子(Nuclear factor kB,NF-κB) 是许多炎症细胞因子基因的启动因子,可以有效诱导炎症因子、趋化因子、炎性酶等的基因转录表达,对炎症反应级联放大,可在多种炎症性疾病的炎症部位高度活化,NF-κB在炎症反应中起着主要作用,RAGE与配体结合后可激活细胞丝裂原活化蛋白激酶途经,启动活化核因子NF-κB,介导炎性因子的产生,形成持续性的炎症活化正反馈作用,因此,RAGE激活后不仅参与炎症反应,还可加强持续炎症反应并且导致炎症反应慢性化。
1 材料与方法
1.1 材料及实验方法 雄性昆明种SCXK(黔)2012-001小鼠40只,体质量(20±1.7) g。适应性喂养3 d后,随机分为:正常对照组(n=8只),肝衰竭模型4 h组(n=8只)、8 h组(n=8只)、12 h组(n=8只)及24 h组(n=8只)。急性肝衰竭模型复制:新鲜配制D-氨基半乳糖及LPS溶液(用生理盐水将D-氨基半乳糖及LPS配成D-GalN50 mg/mL、LPS1 μg/mL),按D-GalN500 mg/kg、LPS10 μg/kg的剂量腹腔注射一次。肝衰竭组在建模后4 h、8 h、12 h和24 h(实验中18 h后死亡小鼠计入24 h组)眼球取血后断颈处死各组小鼠,留取血液及全部肝脏。血液4 ℃离心1 500 rpm×10 min后,分离血清,置-80 ℃冰箱保存。取各小鼠右叶肝组织1.3 mm3大小于4%中性甲醛固定,其余肝组织置-80 ℃冰箱保存。
1.2 检测指标及方法
1.2.1 血清ALT、AST、TBIL含量检测 血清ALT、AST、TBIL含量测定采用Siemens Advia 1650全自动生化分析仪,由贵州省人民医院生化科严格按照试剂盒要求测定。
1.2.2 光镜下观察肝脏组织结构 肝右叶组织浸于4%中性甲醛缓冲液中固定48 h以后,转移到0.1 mol/L的PBS溶液中保存,常规石蜡包埋切片行HE染色.
1.2.3 免疫组织化学检测晚期糖基化终末产物受体、核转录因子蛋白的表达:采用SP法,微波加热抗原修复,以二氨基联苯胺(DAB)显色。兔抗人RAGE、NF-κB单克隆抗体(武汉博士德生物技术公司)。操作程序按说明书进行。阴性对照以PBS替代一抗,用已知阳性标本作阳性对照。染色结果判断:光镜下观察细胞呈棕黄色为阳性表达细胞,每张切片在高倍镜下随机取5个视野,分别按染色深度和阳性细胞的分布作如下评分:(1)无着色为 0 分,淡黄色为 1 分,棕黄色为 2 分,棕褐色为 3 分;(2)阳性范围:没有阳性细胞为 0 分,阳性细胞百分比<10%为 1 分,阳性细胞百分比11%~50%为2 分,阳性细胞百分比51%~80%为 3 分,阳性细胞百分比>80%为 4 分。以二者分数乘积,通过两者乘积结果进行半定量统计。
1.2.4 荧光实时定量PCR 肝脏组织50 mg加入Trizol 1.0 mL充分匀浆后离心,取上清液,酶标仪测定RNA浓度。进行逆转录,逆转录20 μL体系(5×buffer 4 μL、10 mmol /L dNTP 2 μL、Olig DT 1 μL、RNase Inhibitor1 μL、RNA 反转录酶1 μL、RNase-free H2O 9.0 μL、模板2 μL); 逆转录条件:42 ℃ 60 min、70 ℃ 5 min、4 ℃保存; RT-PCR 20 μL 体系(2 ×SYBR Green 10 μL、primer mix 1.0 μL、RNase-freeH2O 7.0 μL、模板2.0 μL); 循环参数:50 ℃ 120 s、95 ℃ 10 min、95 ℃ 15 s、60 ℃ 60 s ,共40 个循环。RAGE引物序列上游5’-CAGTCAGAGGAAGCGGAGAT-3’,下游5’-CTGGTTGGAGAAGGAAGTGC-3’ ;NF-KBp65引物序列上游5’-GACCTGGAGCAAGCCATTAG-3’,下游5’-ACTGTCACCTGGAAGCAGAG-3’。β-actin 序列:上游5’-GGAGATTACTGCCCTGGCTCCTA-3’,下游5’-GACTCATCGTACTCCTGCTTGCTG-3’。所有引物均采用Primer 3.0 设计并经过NCBI Blast 验证产物特异性。
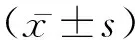
2 结 果
2.1 各组小鼠血清ALT、AST、TBIL浓度 小鼠注射D-GalN+LPS后,模型组AST、ALT浓度逐渐升高,12 h达高峰,24 h维持在较高水平,模型组小鼠血清AST、ALT浓度显著高于正常对照组小鼠(P<0.01);肝衰竭组小鼠血清TBIL浓度逐渐升高,24 h达高峰,肝衰竭组8 h、12 h、24 h组小鼠血清TBIL浓度高于正常对照组小鼠(P<0.05)。见表1。

表1 各组小鼠血清ALT、AST、TBIL浓度
注:与对照组相比,#P<0.01,※P<0.05。
2.2 各组小鼠肝组织学变化 正常对照组小鼠肝小叶结构完整。模型组随着给药时间延长,肝组织的病理改变逐渐加重, 4 h时肝细胞轻度肿胀,嗜酸性变、炎细胞浸润,可见核内包涵体,肝细胞呈点状坏死;8 h时肝细胞气球样变,汇管区及肝细胞间见炎细胞浸润伴出血,可见核内包涵体,肝细胞呈桥接坏死;12 h时可见肝细胞片状坏死融合,核溶解、碎裂,汇管区及肝细胞间见较多炎细胞浸润伴少量出血;24 h时肝细胞坏死更加明显,大片状坏死和少量出血,仅少量肝细胞残存,散在分布,纤维网状支架塌陷。见图1。
图1 各组小鼠肝组织HE染色结果
2.3 免疫组化检测各组小鼠肝组织中RAGE、NF-κBp65蛋白表达变化 RAGE蛋白表达:正常对照组小鼠肝组织中很少表达。肝衰竭4 h组炎细胞及肝窦内皮细胞胞浆低表达, 8 h、12 h组表达呈阳性,炎性浸润区阳性细胞胞浆表达明显增加,24 h组,坏死区炎细胞阳性表达。NF-κBp65 蛋白表达:正常对照组主要为肝细胞染色阳性,细胞胞浆有弱表达。肝衰竭4 h组核阳性表达的细胞数明显增多,8 h组、12 h组表达呈肝细胞胞浆强阳性,肝窦内皮细胞和炎细胞胞浆有阳性表达,随着肝细胞坏死的加重, 24 h组阳性细胞表达减少,坏死区阳性表达明显增加。经检验,模型8 h、12 h、24 h组RAGE蛋白、NF-κBp65 蛋白表达较正常对照组差异具有显著统计学意义(P<0.01)。见图2、图3;
正常组(SABC,×400)

注:箭头所示为阳性表达。
图2 各组小鼠肝组织中RAGE蛋白表达结果

注:箭头所示为阳性表达。
图3 各组小鼠肝组织中NF-κBp65蛋白表达结果
2.4 各组小鼠肝组织中RAGEmRNA 、NF-kBp65mRNA表达水平 建模后肝衰竭组RAGEmRNA表达开始上调,持续升高,24 h达到高峰,经检验,肝衰竭组8 h、12 h、24 h组RAGEmRNA的表达较正常组增加(P<0.05); 建模后肝衰竭组NF-kB65 mRNA水平表达开始上调,12 h达到高峰,24 h维持在较高水平,经检验,肝衰竭组8 h、12 h、24 h组NF-kBp65 mRNA的表达较正常组明显增加(P<0.05)。见表2。

表2 小鼠肝组织中RAGEmRNA 、NF-kBp65mRNA表达
注:与对照组相比,※P<0.05。
3 讨 论
急性肝功能衰竭(acute liver failure,ALF)可由包括药物、毒物、病毒感染等多种原因引起,病理生理学上表现为肝细胞大量坏死、凋亡,导致肝脏合成、解毒、转运和生物转化等功能发生严重障碍,继而出现以严重消化道症状、极度乏力、凝血功能障碍、深度黄疸、肝性脑病、腹水等临床症候群[3]。
RAGE 是细胞表面分子中免疫球蛋白超家族的一员,在体内分布非常广泛,可表达于血管内皮细胞、平滑肌细胞、巨噬细胞、中性粒细胞、肝星状细胞等[4-5]。Harashima等应用免疫组化技术发现,在肉芽肿性炎症、吸烟相关性气道疾病、间质性肺炎等几种持续性炎症性肺病的患者肺内RAGE蛋白表达增强[6],RAGE激活后不仅参与炎症反应,还可加强持续炎症反应并且导致炎症反应慢性化。
NF-κB是许多炎症细胞因子基因的启动因子,可以有效诱导炎症因子、趋化因子、炎性酶等的基因转录表达,对炎症反应级联放大,在多种炎症性疾病的炎症部位高度活化,因此在炎症反应中起着主要作用。研究证实RAGE与配体结合后形成的复合物可激活细胞丝裂原活化蛋白激酶途经,启动活化核因子NF-κB,进而激活RAGE基因启动子,形成持续性的炎症活化正反馈作用。
本研究以昆明种小鼠为动物实验模型,以D-氨基半乳糖和脂多糖成功复制了陈恩强等[7]建立的动物急性肝功能衰竭模型。生化检查示以D-氨基半乳糖和脂多糖处理小鼠后,在4~12 h内均出现ALT、AST、TBIL升高;4 h小鼠的肝脏组织学检查已经出现肝细胞变性表现,8 h内出现细胞明显坏死,而至24 h时肝脏组织学破坏程度达到峰值,出现大片坏死,仅有少量肝细胞残存,本研究建立的动物模型合理地体现急性肝功能衰竭病理生理过程。
本研究实验过程中,随肝细胞损伤程度加重,免疫组化显示RAGE蛋白主要由炎症细胞表达,所以在实验起始阶段,肝脏组织内的表达量极低,在肝细胞损害后,肝组织炎细胞浸润发生后,炎细胞内RAGE蛋白及mRNA水平逐渐升高,并伴随了整个肝脏损害过程的进展。在组织学表现上,RAGE蛋白表达水平变化几乎可以有效地代表肝组织内炎细胞的数量变化,提示RAGE在急性肝功能衰竭模型肝损害过程中有重要的意义。同时免疫组化检测肝组织内NF-kBp65蛋白水平显示肝衰竭4 h时主要表达于肝细胞核,8 h之后多见于肝细胞坏死区染色,此时,NF-κB在肝脏炎细胞及炎性细胞表达增强,12 h、24 h时肝细胞坏死区域及浸润的炎症细胞中表达增加。因此晚期糖基化终末产物受体及核转录因子在D-GalN+LPS 诱导的小鼠急性肝功能衰竭过程中起着重要作用,这为临床上寻治疗肝衰竭提供了理论基础及新的思路。
