基于The Human Protein Atlas和TCGA数据库分析SmuG1在人卵巢癌中的表达及预后意义
2019-08-15郑丽娇黄洁彭冬先
郑丽娇 黄洁 彭冬先
(南方医科大学珠江医院妇产科,广东 广州 510220)
卵巢癌是致死率最高的女性恶性肿瘤,不良的总体预后是各种因素综合作用的结果,其中关键的一点是卵巢癌在早期阶段没有明显的症状和特定的肿瘤标记物,大多数女性被确诊时已为晚期,预后极差[1-2]。因此,深入研究卵巢癌发生发展的机制,寻找新的高度敏感的分子标记物或潜在的治疗靶点显得尤为重要。单链选择性单功能尿嘧啶DNA糖基化酶(single-strand selective monofunctional uracil DNA glycosylase,SmuG1)是一种细胞内糖基化酶[3],在全身各类组织及器官中均有表达,可从核染色质中的单链和双链DNA中去除尿嘧啶,从而有助于碱基切除修复,对于防止突变至关重要[4]。SmuG1在多种实体肿瘤中均有异常表达,与肿瘤易感性、预后密切相关。但在不同的肿瘤中却存在相反的结果,提示SmuG1可能在癌症发生发展中扮演复杂的角色,并且基于癌症的类型及其性质而起不同的作用。目前鲜有SmuG1与卵巢癌关系的报道,因此,本研究利用(the human protein atlas,THPA)及the cancer genome atlas,TCGA)数据库探讨其表达对卵巢癌患者的临床价值。报告如下。
1 材料与方法
1.1 材料 (1)THPA数据库检索SmuG1在人亚细胞中定位以及在组织中的表达情况。(2)TCGA数据库下载卵巢癌患者的临床数据和SmuG1转录组芯片数据,将临床数据与芯片数据进行匹配,同时剔除临床病理参数不详或不完整的病例,最终得到234例研究样本。
1.2 方法 (1)根据SmuG1的表达状况由低至高排序,分为高表达组(High,>0.5分隔值)和低表达组(Low,<0.50.5分隔值),分析SmuG1表达量与临床资料之间的关系。生存分析用 Kaplan-Meier。使用Cox比例风险回归模型进行单因素分析和多因素分析。
1.3 统计学方法 采用SPSS22.0版软件进行统计学分析;采用卡方检验分析SmuG1表达与临床病理特征之间的关系;通过使用Kaplan-Meier方法分析整体存活率;使用Cox比例风险回归模型进行单变量及多变量生存比较,P<0.05为差异有统计学意义。
2 结 果
2.1 THPA数据库检索SmuG1在人亚细胞定位以及在组织中的表达情况 SmuG1定位于人细胞内的中心体和微管,在多种肿瘤组织中存在异常表达,尤其是卵巢癌组织和肝癌组织。见图1。
2.2 TCGA数据库分析卵巢癌患者SmuG1 mRNA的表达水平及其与临床病理特征的关系 SmuG1 mRNA水平与临床分期负相关(P<0.05,相关系数r=-0.5),而与年龄、肿瘤级别、残留肿瘤大小、化疗是否耐药、肿瘤是否复发无关(P>0.05)。按FIGO分期,11例Ⅱ期卵巢癌组织中,10例(90%)低表达,1例(10%)高表达;184例Ⅲ期卵巢癌组织中,83例(45%)低表达,101例(55%)高表达;39例Ⅳ期卵巢癌组织中,24例(62%)低表达,15例(38%)高表达。三者之间进行方差分析,结果差异有统计学意义(P=0.0243)。
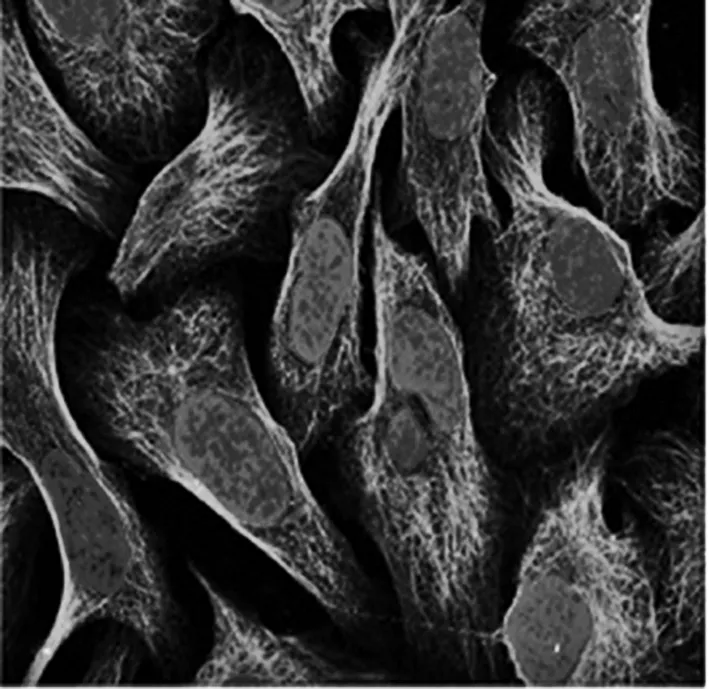
注:引自The Human Protein Atlas数据库,定位在中心体(抗体:HPA05114),绿色为SmuG1抗体结合处。
图1 SmuG1蛋白在HPA05114细胞系中的定位
2.3 生存分析探讨SmuG1 mRNA水平与卵巢癌患者总生存率的关系 Kaplan-Meier生存曲线分析发现高表达SmuG1 mRNA的患者比低表达SmuG1 mRNA患者的存活时间更长,差异有统计学意义(P=0.035)。见图2。
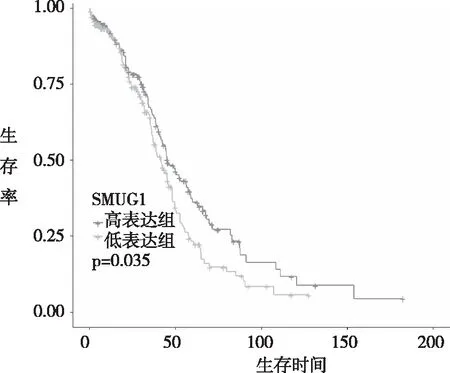
图2 SmuG1 mRNA表达与卵巢癌患者的总生存时间的Kaplan-Meier生存曲线
2.4 Cox比例风险回归模型分析SmuG1对卵巢癌患者总体生存期的独立预后影响 单因素分析发现总生存时间与SmuG1表达量、化疗反应、耐药性以及无病生存期长短相关;多因素进一步分析表明SmuG1的表达水平是卵巢癌患者的显著独立预后指标(P=0.009)。见表1。
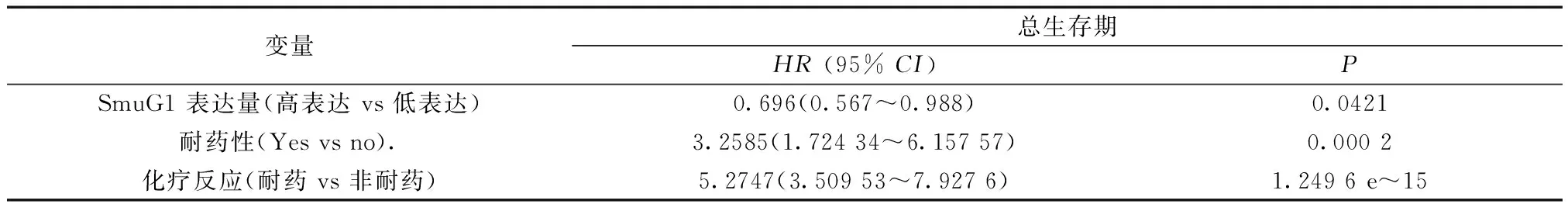
表1 根据cox比例风险模型,SmuG1表达对总体生存率的预后价值
续表 表1

无病生存期(稳定 vs 进展)21.9788(3.068 12~157.44 669)0.002多因素分析SmuG1 表达量(高表达 vs 低表达)0.9 828 298(0.618 97~1.560 583)0.009
3 讨 论
卵巢癌是严重威胁妇女健康的常见妇科肿瘤,死亡率居妇科肿瘤首位。由于 其起病隐匿[5],早期筛查困难,大约2/3的患者在初诊时已发生盆腹腔内的广泛种植[6]。因此,提高卵巢癌的早期诊断水平、探讨其有效的治疗靶点,对改善预后有重要的意义[7]。SmuG1是三大DNA糖基化酶之一,可不受细胞周期调节并且均匀分布在核质中[8-9],具有广泛的底物特异性[10-11]。有研究表明SmuG1转录物的低表达可损害DNA修复,从而增加突变率,增强染色体不稳定性[12]。在小鼠研究中[13],SmuG1的丢失被证明可以增加癌症的易感性。同时发现低SmuG1转录物可能与较差的存活率相关[14]。但是目前尚未有SmuG1与卵巢癌发生发展及预后关系的研究报道。
本研究利用THPA数据库,发现SmuG1定位于细胞内,是碱基切除修复的关键因子,在肿瘤组织中存在异常表达。为了进一步验证,利用TCGA数据库分析234例卵巢癌患者SmuG1 mRNA的表达水平与临床病理特征的相关性,发现SmuG1 mRNA水平与临床分期负相关,与THPA数据库的SmuG1蛋白水平趋势一致。生存分析结果提示SmuG1表达水平高的卵巢癌患者的总生存期更长、预后更好,Cox比例风险回归模型分析提示SmuG1是卵巢癌患者总体生存率的独立影响因子,而不是与初治反应、耐药性等危险因素起协同作用。这与在小鼠研究、乳腺癌以及结直肠癌研究中预后是一致的,但与胃癌的预后相反,一种可能的解释是,在胃癌中,炎症是致癌作用的驱动因素,并且低浓度的SmuG1可有益于修复氧化性碱基损伤(通常见于炎性环境中),在这种情况下,与耗尽相反,SmuG1的升高可以潜在地用作存活的生物标记物。表明SmuG1与肿瘤临床病理类型、癌细胞的侵袭转移以及患者预后相关,并且基于癌症的类型及其性质可能起不同的作用。
综上所述,SmuG1 mRNA水平与临床分期负相关,与预后生存时间紧密相连,揭示SmuG1在卵巢癌的发生发展过程中可能发挥着抑癌作用。TCGA研究纳入的样本量大,临床资料客观完整,可信度高,在一定程度上具有代表意义,分析结果具有一定的提示作用,为进一步研究SmuG1与卵巢癌发生机制提供了一定的理论基础,但结论仍需进一步的验证。
