皮下免疫和舌下免疫治疗特应性皮炎的临床疗效和安全性分析
2019-08-15刘娟娟邓抒琴
吕 静,刘娟娟,柯 丹,陈 征,邓抒琴,喻 云,江 阳
特应性皮炎(atopic dermatitis,AD)又称遗传过敏性和异位性皮炎,是一种常见的和遗传过敏素质相关的慢性、复发性、炎症性、瘙痒性的皮肤病,常伴有血清IgE水平增加及过敏性鼻炎和(或)哮喘史。病因与发病机制尚不完全清楚,目前认为是具有遗传素质背景的个体在受到外界特异性致敏源作用后发生的变态反应性疾病[1]。由此可见,变应原是AD发病的促发因素和加重因素,在AD发病中发挥重要作用。在中国,AD患者常见的变应原为户尘螨和粉尘螨,尘螨暴露与疾病的反复发作密切相关。变应原特异性免疫治疗(allergen-specific immunotherapy,ASIT)也叫脱敏治疗,是目前惟一可以影响过敏性疾病自然进程的病因治疗法,并可防止新的过敏发生[2]。目前ASIT已公认用于治疗过敏性鼻炎和支气管哮喘,而治疗AD正逐渐被认可,是ASIT研究最为集中的皮肤病,但疗效尚存在争议[3,4]。在本文中,笔者针对尘螨过敏的中-重度AD患者分别采用皮下免疫疗法(subcutaneous immunotherapy,SCIT)或舌下免疫疗法(sublingual immunotherapy,SLIT)进行治疗,观察两种方法的临床疗效及治疗过程中不良反应的发生情况,现报告如下。
1 资料与方法
1.1 临床资料
研究对象为2014年1月—2016年9月来我科门诊就诊的150例AD患者,符合Williams所指定的AD诊断标准[5]及免疫治疗适应证。在患者知情同意的基础上,按照其治疗意愿分别采用SCIT或SLIT的治疗方案,预定疗程均为2年。其中SCIT组77例,男40例,女37例;年龄7~63岁,平均年龄(20.5±14.3)岁。SLIT组73例,男50例,女23例;年龄6~59岁,平均年龄(16.8±11.5)岁。两组患者的基本情况具有可比性。所有患者在入组前6个月内无哮喘及荨麻疹发作史 ,4周内未系统使用过糖皮质激素,l周内未使用过H1抗组胺药、白三烯受体拮抗剂等抗过敏药物。排除标准:①伴有Ⅲ型变态反应的患者;②致敏物不明确;③有严重免疫病理改变的疾病和免疫缺陷病;④有变应原诱发过敏性休克史的患者;⑤有心血管系统疾病史及肾功能障碍者;⑥妊娠、哺乳期妇女;⑦恶性肿瘤患者;⑧≤5岁儿童;⑨依从性差,不能坚持长期治疗者。
1.2 方法
1.2.1 变应原皮肤点刺试验及血清特异性IgE检测运用AD评分标准(SCORAD),免疫治疗前AD患者皮损情况进行评估[6],并进行体内变态反应检测,比较治疗前后血清特异性IgE(pecific IgE,sIgE)含量。所有患者均进行阿罗格(德国Allergopharma公司)的吸入组与食物组变应原点刺液共28种皮肤点刺试验,以生理盐水和磷酸组胺分别作为阴性和阳性对照,通过与阳性对照相比判断反应程度。根据风团大小结果分为(+)~(++++)4级。点刺结果显示对粉尘螨或屋尘螨反应为:(++)~(++++),且为主要过敏原的患者纳入试验。其中,尘螨单一致敏130例(86.7%),合并其他吸入物致敏20例(13.3%)。分别在ASIT治疗前和完成1年治疗后,各取受检者静脉血2 ml,分离血清,采用酶联免疫吸附试验(ELISA)测定血清尘螨sIgE,具体方法参照文献[7],sIgE≥0.7 kUA/L为2级,2级及以上为入选患者。本组患者均为中-重度 AD患者(SCORAD≥25)(该评分结合既往病史,入组时皮损趋向缓解和稳定,因需病情得到有效控制后才能行ASIT治疗,严重时或急性期不能入组),截至2017年10月31日,150例患者均已进行1年以上免疫治疗,其中已完成2年疗程者29例(19.3%)。
1.2.2 治疗方案 ①SCIT组:采用阿罗格尘螨变应原注射液(默克雪兰诺公司)在上臂远端1/3处行皮下注射,为氢氧化铝吸附的缓释型屋尘螨混合粉尘螨制剂,用变应原(抗原)溶媒稀释(山西太原药业有限公司),疗程分2个阶段:剂量递增阶段和剂量维持阶段。剂量递增阶段时间为36周,起始剂量为0.5 TU(治疗单位),每周注射 1次,按 0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 ml递增,5 TU、50 TU、500 TU的剂量,疗程同上,共36周。维持治疗阶段从第37周开始,采用维持剂量 500 TU 0.5 ml,每周注射1次,共9次,随后每2周注射1次,共9次,随后每4周注射1次,总疗程为2年(150例患者均坚持免疫治疗1年,其中29例完成2年疗程)。每次注射后,患者在医院至少观察30 min。治疗期间根据病情适当给予抗组胺药物口服及糖皮质激素软膏外用 。所用抗组胺药物种类与SLIT组相同,给予盐酸左西替利嗪或者氯雷他定,根据病情采用一联或二联药物治疗,药物逐渐减量,维持治疗至症状缓解 ,最长达2年。对于并发食物或吸入组其他过敏原的均对患者进行教育,尽量避免接触相应变应原。②SLIT组:使用标准化粉尘螨变应原滴剂(浙江我武生物科技有限公司)舌下含服治疗,分剂量递增期和维持期两个治疗阶段。>14周岁患者的递增期治疗方案为第1周、第2周、第3周分别使用不同蛋白质量浓度的滴剂1号 (1 µg/ml),2号(10 µg/ml), 3号(100 µg/ml),第1~7天均按1、2、3、4、6、8、10 滴顺序服用;第4、 5周使用滴剂4号 (333 µg/ml),每次3滴;第6周以后用5号(1 000 µg/ml)维持,每次2滴,直至疗程结束。以上治疗均在家中进行,每日1次,于每晚睡前将变应原疫苗滴于舌下,含2 min后将其吞咽。<14周岁患儿,递增期使用1~3号,维持期一直使用4号,用法用量同前,至疗程结束。在治疗过程中若出现局部或全身不良反应,按照说明书对剂量进行适当调整。免疫治疗4周内根据皮损及瘙痒的严重程度允许口服H1抗组胺药(盐酸左西替利嗪,氯雷他定)或外用糖皮质激素(丁酸氢化可的松乳膏,糠酸莫米松乳膏)进行辅助治疗。
表1 治疗1年后两组AD患者SCORAD评分结果比较 (±s,分)
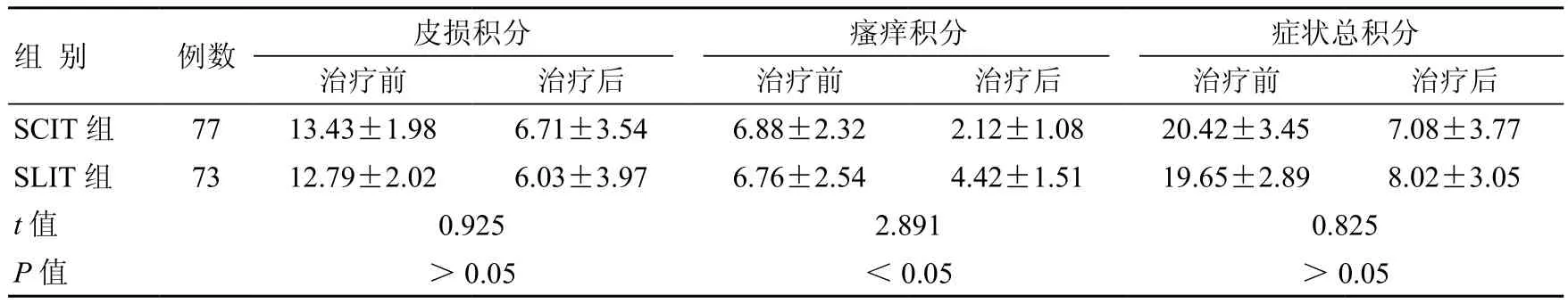
表1 治疗1年后两组AD患者SCORAD评分结果比较 (±s,分)
组 别 例数 皮损积分 瘙痒积分 症状总积分治疗前 治疗后 治疗前 治疗后 治疗前 治疗后SCIT 组 77 13.43±1.98 6.71±3.54 6.88±2.32 2.12±1.08 20.42±3.45 7.08±3.77 SLIT 组 73 12.79±2.02 6.03±3.97 6.76±2.54 4.42±1.51 19.65±2.89 8.02±3.05 t值 0.925 2.891 0.825 P值 >0.05 <0.05 >0.05images/BZ_22_1114_407_1148_441.pngimages/BZ_22_1602_407_1636_441.png
以上两组患者在治疗过程中如出现局部或全身不良反应,则按照产品说明书对剂量进行适当调整。
1.3 不良反应观察
SCIT可引起局部和全身不良反应。局部不良反应包括注射部位周围局部肿胀、潮红、瘙痒等。全身不良反应根据2006年欧洲变态反应和临床免疫 学 会(European Academy of Allergy and Clinical Immunology,EAACI)制定的分级标准进行评判[8]。l级为轻度全身反应:局部荨麻疹、鼻炎或轻度哮喘;2级为中度全身反应:泛发的荨麻疹或中度哮喘;3级为重度全身反应,但非致命性:泛发的荨麻疹、血管性水肿或严重哮喘;4级为严重过敏反应:立刻发生瘙痒、潮红、红斑、泛发的荨麻疹、血管性水肿及喉喘鸣、速发型哮喘、低血压等。SLIT的局部不良反应主要包括口唇和舌下肿胀、瘙痒及口内不适等口腔黏膜反应;全身不良反应有胃肠道反应、荨麻疹、鼻炎和哮喘发作等。参照美国变态反应、哮喘和免疫学会(American Society for Allergy,Asthma and Immunology,AAAAI,ACAAI)联合工作组制定的SLIT不良反应分级方法[9]:①轻度:局部或全身不良反应,症状轻微者;②中度:不良反应需要及时处理,包括药物治疗、调整剂量或中止免疫治疗者;③严重:潜在的致死性不良反应,包括哮喘发作和需要住院治疗者;④过敏性休克。SCIT组要求患者每次按时来院或在就近的诊所接受变应原疫苗注射,注射后观察30 min,如出现不良反应及时予以对症处理;离院后如出现迟发性反应,嘱患者进行相应的处理,必要时回医院治疗。SLIT组要求患者以日记卡的形式记录每天用药剂量、有无不良事件及处理情况等,如无特殊情况每2个月来院复诊1次。
1.4 疗效判定标准
临床疗效根据SCORAD评分,改善率分为4级[10],包括痊愈(95%以上)、显效(61%~95%)、有效(20%~60%)、无效(<20%)。改善率=(治疗前总积分-治疗后总积分)/治疗前总积分×100%。有效率=(痊愈例数+显效例数)/总例数×100%。治疗前后血清sIgE进行比较。治疗过程中不良反应发生率进行统计分析比较。
1.5 统计学方法
以SPSS16.0软件对数据进行统计分析,计量资料用(±s)表示,差异统计学采用t检验,计数资料用构成比表示,差异统计学采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床疗效

表2 治疗1年后两组AD患者临床疗效比较 [例(%)]
表3 治疗1年后两组AD患者sIgE比较 (±s,kUA/L)
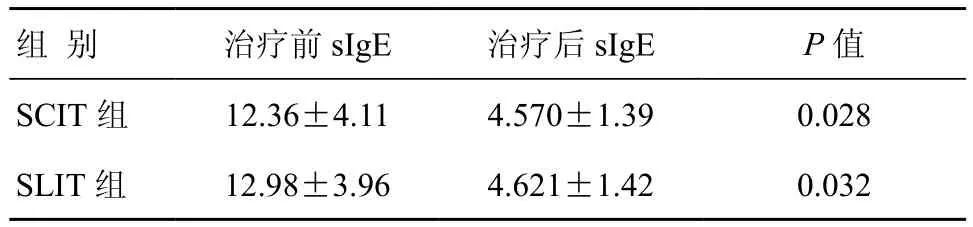
表3 治疗1年后两组AD患者sIgE比较 (±s,kUA/L)
组 别 治疗前sIgE 治疗后sIgE P值SCIT组 12.36±4.11 4.570±1.39 0.028 SLIT组 12.98±3.96 4.621±1.42 0.032
两组治疗前后皮损积分比较:治疗前两组皮损积分无显著性差异,治疗后SCIT组皮损积分略低于SLIT组,但两组相比差异无统计学意义(P>0.05)。两组治疗前后瘙痒积分比较:治疗前两组瘙痒积分差异无统计学意义,治疗后SCIT组瘙痒积分显著低于SLIT组,两者相比差异有统计学意义(P<0.05)。两组治疗前后症状总积分比较:治疗前两组症状总积分无显著性差异,治疗后SCIT组症状总积分略低于SLIT组,两者相比差异无统计学意义(P>0.05)(表1)。在治疗1年后SCIT组有效率为53.25%,SLIT组有效率为52.05%,两组相比差异无统计学意义(P>0.05)(表2)。治疗前后sIgE比较,两组治疗前后血清sIgE比较差异无统计学意义(P>0.05),但每组治疗后sIgE水平均较该组治疗前明显下降,差异有统计学意义(P<0.05)(表3)。
2.2 不良反应
2.2.1 SCIT组不良反应 该组77例患者在免疫治疗的不同阶段均出现过局部不良反应,均为速发型,主要表现为注射部位周围皮肤轻度红肿(直径<5 cm),未作特殊处理而自行消退。共有9例(11.69%)出现过全身不良反应(<14岁患儿4例)。77例患者共接受皮下注射1 911例次,发生局部不良反应1 078例次,占注射总次数的56.41%,均为速发性反应。发生全身不良反应16例次,占注射总次数的0.83%,其中速发性反应12例次(75.0%)、迟发性反应4例次(25.0%)。发生在起始治疗阶段3例次(18.75%),包括胸闷和呼吸困难2例次、荨麻疹1例次(全身);发生在维持治疗阶段13例次(81.25%),包括胸闷和呼吸困难8例次、哮喘发作1例次、荨麻疹4例次(全身和局部各2例次)。根据全身不良反应分级标准[10],l级12例次(75.0%)、2级3例次(18.75%)、3级l例次(6.25%),以上反应均进行对症治疗,未使用肾上腺素。在充分评估不良反应严重程度的基础上调整剂量继续治疗。本组患者无过敏性休克发生。
2.2.2 SLIT组不良反应发生情况 该组73例患者中,4例(5.5%)出现过局部不良反应(<14岁患儿2例),主要表现为口腔局部瘙痒不适,发生在剂量递增阶段,均属于轻度,可耐受且具有自限性。共有8例(10.96%)出现全身不良反应(<14岁患儿3例),轻度6例、中度2例。发生在剂量递增阶段5例(62.5%),包括胃肠道反应1例(表现为腹胀)、荨麻疹2例、全身瘙痒1例、咳嗽l例;发生在剂量维持阶段3例(37.5%),包括荨麻疹2例、情绪兴奋1例。胃肠道反应、荨麻疹和情绪兴奋者属于轻度,未予特殊处理,3~7 d 自行缓解。其他患者口服Hl抗组胺药治疗后症状均缓解。SCIT组和SLIT组全身不良反应的发生率差异无统计学意义(χ2=0.0038,P=0.93)(表 4)。

表4 两组全身不良反应发生率比较
3 讨论
目前部分AD患者常规治疗疗效欠佳,皮损容易复发,因此除缓解症状外病因治疗显得尤为重要。变应原特异性免疫治疗也称脱敏治疗,是针对有明确变应原的过敏性疾病患者,通过较长时间接触剂量递增的变应原后,逐渐提高患者对变应原的耐受能力。当患者再次接触变应原后,可减少炎症递质的释放,不再诱导变态反应发作,或使其发作程度显著减低,从而缓解临床症状。ASIT适用于症状由单一或少数变应原引起,与变应原接触关系密切,且无法避免接触变应原的过敏性疾病患者。目前AD是ASIT研究最为集中的皮肤病,但疗效尚有争议,部分AD患者进行ASIT治疗后出现短暂的病情加重和血清特异性IgE升高,这和短暂的速发型超敏反应有关,提示在临床上AD病情得到有效控制后再行ASIT治疗。目前ASIT主要有5种方式:皮下注射、舌下含服、口服、经皮免疫治疗及淋巴免疫治疗。其中,尘螨的皮下注射和舌下含服常用于治疗AD。2004年世界卫生组织(WHO)推荐舌下脱敏为治疗AD、过敏性皮炎、过敏性哮喘的主要方法之一[11]。一项早期有关7个临床观察的荟萃分析结果显示[12],接受变应原ASIT的AD患者中70.8%有效。迄今已有至少11项设有对照的临床试验发表,最常针对的变应原是尘螨,其中8项结果显示变应原ASIT疗效显著优于对照组。新近一项尘螨ASIT治疗AD的大规模双盲随机临床试验结果显示,ASIT对尘螨过敏的AD患者有效,其疗效呈剂量相关性,并且高剂量组可显著降低治疗所需的外用糖皮质激素用量[13]。Bae等[14]进行了ASIT治疗AD的系统性回顾及Meta分析,发现ASIT可有效治疗重度AD患者;ASIT长时间治疗(≥1年)在AD患者中有显著疗效;皮下注射疗效显著。舌下含服治疗和儿童AD治疗的数据分析未显示统计学意义,可能与纳入的病例数较少有关。
Qin等[15]对107例AD患者进行舌下免疫治疗评估。研究者将受试者随机分为接受粉尘螨滴剂加药物治疗的实验组和仅用药物治疗的对照组,实验结果显示,实验组的有效率(77.78%)显著高于对照组(53.85%),在随访的12个月内,实验组的每日药物评分及视觉模拟量评分均显著小于对照组。研究提示,粉尘螨滴剂舌下含服可以减少治疗药物剂量,提高患者依从性,是一个有效的ASIT方法。基于既往的经验,笔者在试验中选择SCIT或SLIT对AD患者进行脱敏治疗,观察其临床疗效和不良反应情况。结果显示,治疗1年后两组患者虽然在瘙痒积分上存在一定差异(SCLT组较SLIT组改善更明显),但在皮损积分和症状总积分上差异无统计学意义,两组的有效率差异亦无统计学意义。说明SCIT和SLIT治疗AD患者的临床疗效差异并不大。
传统经皮下注射途径给药,称为SCIT,通常以递增剂量的方式给予患者变应原提取物(变应原疫苗)皮下注射,从而改善暴露于致敏变应原时产生的临床症状[16]。该法免疫原性高,临床疗效显著,但因曾发生过严重不良反应其安全性引起人们的极大关注。SLIT作为另一种脱敏治疗的方式,具有应用方便、安全性高的优点,但疗效尚有待提高。SLIT可能作用机制是舌下黏膜组织血运丰富,变应原可迅速被吸收并通过循环进入肺、肠道等器官的淋巴组织,刺激机体免疫系统,产生变应原特异性抗体(IgE),并能激活黏膜中的前炎性细胞、使过敏性疾病患者变应原特异性的Th2向Th1发生偏移 ,调节机体免疫功能,达到有效治疗和预防复发。世界变态反应机构(World Allergy Organization,WAO)意见书认为[17],SLIT可能通过与SCIT相似的机制发挥免疫调节作用,但前者在口腔黏膜和(或)局部淋巴结作用较突出,是一种无创、方便的ASIT新方法,且SLIT对患者年龄没有具体的上限或下限,甚至在5岁以下 幼儿中也可应用[18]。当前SCIT与SLIT已经成为ASIT最主要的两种途径,然而二者的优劣尚无统一的结论 。SLIT多在患者家庭中自行操作,远离医护人员的直接监控,因此医生应向患者及家属交代清楚用药前后注意事项,如何识别和处理不良反应,以及保持良好的医患沟通尤为重要,所以其安全性尚待进一步证实。从总体上看,ASIT具有良好的安全性,但临床上发生局部和全身不良反应的风险依然存在,包括注射部位的瘙痒、红晕、肿胀、硬结、坏死,严重者甚至出现休克、喉头水肿、荨麻疹、血管炎、支气管哮喘等。而这又会影响患者对长期治疗的依从性。本文试验结果表明,SCIT组和SLIT组全身不良反应的发生率差异无统计学意义(P>0.05)。对出现不良反应的患者及时处理,及时调整药物剂量,尽量避免不良反应的发生,以提高安全性及患者治疗的依从性。
ASIT一般需要持续治疗2年以上,患者的依从性是确保治疗成功和取得良好效果的关键。本文患者在治疗第1年内依从性较好,无中途退出。但1年以后因为种种原因(如治疗效果不满意、交通不方便、不能耐受不良反应等)退出治疗的较多,故未统计2年的临床疗效及不良反应。国外报道显示,SCIT和SLIT的依从性在75%~90%[19],国内报道显示SCIT组和SLIT组的依从性分别为86.4%和79.7%[14],两者之间差异无统计学意义。因此,对患者进行必要的健康教育,说服其完成整个疗程的脱敏治疗,针对不同个体选择不同的脱敏治疗方式,提高患者的依从性,是特异性免疫治疗成功的关键之一。
