阿萨希毛孢子菌体外亚硫酸氢钠甲萘醌抗氧化诱导及对其形态学影响的研究
2019-08-15李海涛欧敏仪敖俊红杨蓉娅
李海涛,欧敏仪,敖俊红,杨蓉娅,祝 贺
近30年来,由于广谱抗生素、糖皮质激素、抗肿瘤药的广泛使用,以及器官移植、放化疗、导管插管等技术的普遍应用,真菌感染大幅增加,深部真菌感染已成为住院患者死亡的主要原因之一[1,2]。阿萨希毛孢子菌(Trichosporon asahii,T.asahii)是毛孢子菌属中最重要的临床致病菌,可引起皮肤感染、夏季超敏性肺炎和深部感染,特别是播散性深部感染,病死率达80%以上[3-6],且该菌对临床常见的抗真菌药物如卡泊芬净、两性霉素B、氟康唑等均耐药[7-9]。目前为止,该菌的感染致病机制尚不明确,因此需要探索T.asahii的感染和致病机制、研发新的抗真菌药物。
病原体的抗氧化机制与其致病性密切相关,这一点不仅在细菌[10],在酿酒酵母、念珠菌、烟曲霉、隐球菌等常见致病真菌的研究中已经得到证实[11-13]。在本课题组前期研究发现H2O2(hydrogen peroxide)、二酰胺、甲萘醌可对T.asahii可产生不同程度的氧化杀伤作用,其中甲萘醌的杀伤作用最强[14]。Zhang等[15]发现不同来源T.asahii的过氧化氢酶(catalase,CAT)和总超氧化物歧化酶(superoxide dismutase,SOD)活性不同,这些结果表明T.asahii与其他真菌一样,也具有抗氧化机制。为了进一步研究其抗氧化机制,需要获得稳定的抗氧化菌株。当细胞暴露于相对温和、亚致死胁迫刺激后会对随后的致死性胁迫刺激产生耐受,这种现象不但出现在细菌中,而且也发生在真核生物中,该现象被称为适应[16]。基于这一原理,笔者参考真菌耐药诱导的方法,用亚硫酸氢钠甲萘醌(menadione sodium bisulfite,MSB)对T.asahii的临床株和环境株进行体外抗氧化诱导,并进一步研究诱导前后菌株生物学特性的变化。
1 材料与方法
1.1 实验菌株
T.asahii共2株,T.asahii临床标准株CBS 2479、环境株CBS 8904均购自荷兰皇家艺术与科学学院真菌多样性研究中心(CBS-Knaw)。 药敏质控标准株:近平滑念珠菌ATCC22019,由北京大学第一医院真菌研究中心惠赠。
1.2 主要试剂与仪器
PDA干粉培养基(德国默克公司),蛋白胨干粉和葡萄糖干粉(北京化学试剂有限公司),酵母粉(英国Oxoid公司),MSB(美国Sigma公司),RPMI1640培养基(美国Gibco公司),三氮吗啡琳丙磺酸(MOPS,美国Sigma公司),总蛋白定量测定盒(微板法)、CAT测定试剂盒(可见光法)、SOD测定试剂盒(WST-1 法)(南京建成生物工程研究所)。
1.3 方法
1.3.1 MSB体外诱导T.asahii制备经传代纯化的单克隆T.asahiiCBS 2479、CBS 8904菌悬液,用细胞计数板调整浓度为1~5×106CFU/ml,取100 µl菌悬液加入10 ml不含MSB的YPD培养液中,37℃振荡培养10 h后加入MSB使药物浓度达8 µg/ml(CBS 2479、CBS 8904菌株的1/2MIC MSB)后继续培养,当培养菌液达到约0.5 U(麦氏)单位时转至同一药液浓度的培养液中培养,每一浓度梯度转种2~3次后再取0.5 U(麦氏)单位菌液100 µl~10 ml含1/2MIC 浓度MSB的YPD液体中培养10 h后再加入MSB使之达最小抑菌浓度(MIC),当培养菌液达到约0.5 U(麦氏)单位时转至同一药液浓度的培养液中培养,每一浓度梯度转种2~3次。如此类推,直至菌株被杀死不再生长,即终止诱导。
对诱导第2代、诱导第4代的菌株检测总蛋白浓度、CAT、SOD,并行氟康唑、MSB的MIC值测定。将所得菌株以40%甘油保存于-80℃中。
1.3.2 MSB诱导菌株的回复性研究 选用32 µg/ml浓度MSB诱导所得的菌株(即诱导第4代)在不含氧化剂的YPD液体培养基中连续传代10次。对回复第2、5、8、10代的菌株检测总蛋白浓度、CAT、SOD,并行氟康唑和MSB的MIC值测定。将所得菌株以40%甘油保存于-80℃中。
1.3.3 MSB诱导前后T.asahii抗氧化酶活性测定 菌株用细胞计数板配成麦氏比浊度为0.5的菌悬液,取1 ml加到50 ml YPD液体中,37℃振荡培养48 h(150 r/min)。培养所得菌液用离心机(20℃,3 500 g,10 min)离心,弃去上层培养液,取下层细胞沉淀,无菌水冲洗混匀再离心,重复3次。加入约200 µl裂解缓冲液(磷酸钾50 mmol/L,pH7.0)并混匀,将菌液转到含有0.5 g直径425~600 µm玻璃微珠的小EP管中再悬浮。将混悬液在Fastprep核酸提取仪中以4.0 m/s 的速度强振荡20 s,冰上冷却3~5 min,再强振荡20 s,重复6次。最后1次冰上冷却后,离心机分离(4℃,16 000 g,10 min),取上层清液用于酶活性的分析。
1.3.4 BCA法测定蛋白质浓度
用标准血清蛋白作对照。用CAT测定试剂盒和SOD测试盒分别测定CAT和SOD活性,具体操作方法按照说明书进行。重复2~4遍。
1.3.5 形态学变化观察 取诱导前、诱导第4代、回复第10代的2479和8904菌株进行肉眼形态和光镜下形态学观察。①肉眼形态: 制备 1×105cfu/ml浓度的T.asahii菌悬液,取5 µl菌悬液接种到固体 PDA培养基上;37 ℃培养 7 d后观察菌落生长情况。②光镜形态:制备1×106cfu/ml 浓度的T.asahii菌悬液。分别取 0.5 ml 菌悬液接种于 10 ml YPD 培养基中;37℃、150 r/min 摇床培养 72 h,取少量菌液,乳酸酚棉蓝染色后光镜下观察。
1.4 统计学方法
实验数据用SPSS20.0软件进行分析,两组间比较采用配对样本t检验和独立样本t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 MSB诱导前后T.asahii抗氧化酶活性变化
CBS 2479诱导前CAT值为46.89 U/mgprot,经MSB诱导后、回复后CAT均值分别为(150.36±62.49)、(82.35±21.13)U/mgprot。CAT 值 经 MSB诱导后比诱导前升高,两者差异有统计学意义(P<0.05),回复后比诱导前升高,两者差异有统计学意义(P<0.05),回复后比诱导末期下降,两者差异有统计学意义(P<0.01)。CBS 8904诱导前CAT值44.06 U/mgprot,经MSB诱导后、回复后,CAT 值分别为(109.69±39.80)、(83.30±6.96)U/mgprot。诱导后的CAT酶活性比诱导前升高,两者差异具有统计学意义(P<0.05);回复后比诱导前升高,两者差异具有统计学意义(P<0.01);回复后比诱导末期下降,两者差异具有统计学意义(P<0.01)(表1,图1,图2)。
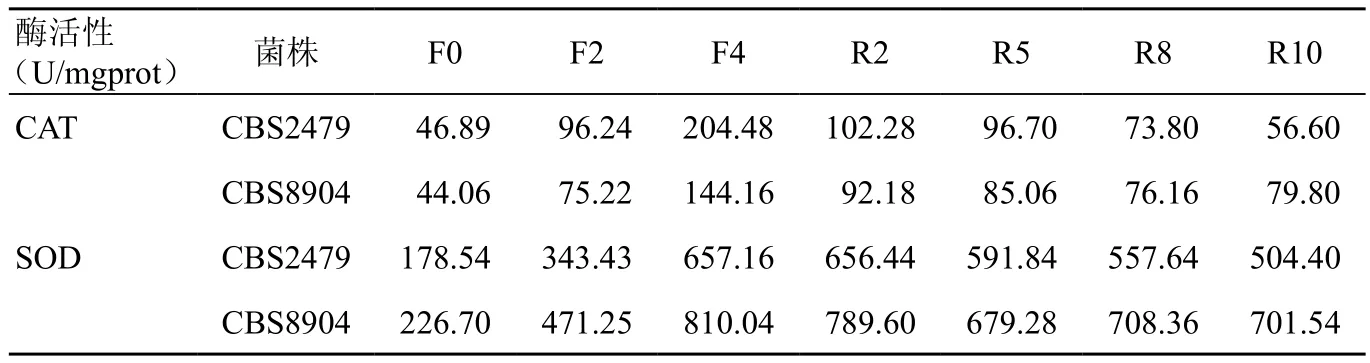
表1 MSB诱导前后T.asahii菌株的抗氧化酶活性

图1 MSB诱导前后T.asahi的CAT变化

图2 MSB诱导前后T.asahi的CAT变化
CBS 2479诱导前SOD值为178.54 U/mgprot,SOD值经MSB诱导后、回复后分别为(500.30±181.13)、(577.58±63.71)U/mgprot。SOD 酶 活 性经MSB诱导后比诱导前升高,两者差异具有统计学意义(P<0.05);回复后比诱导前升高,两者差异具有统计学意义(P<0.01);回复后与诱导末期比较,差异无统计学意义。CBS8904诱导前SOD值为226.70 U/mgprot,经MSB诱导后、回复后,SOD值 分 别 为(640.65±195.60)、(719.70±48.23)U/mgprot,诱导后比诱导前升高,两者差异具有统计学意义(P<0.05),回复后比诱导前升高,两者差异具有统计学意义(P<0.01),回复后比诱导末期下降,两者差异具有统计学意义(P<0.05)(图3,图4)。

图3 MSB诱导前后T.asahi的SOD变化
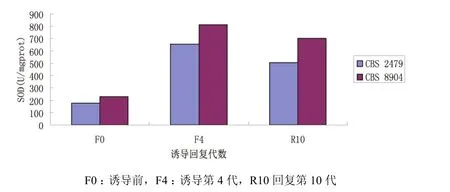
图4 MSB诱导前后T.asahi的SOD变化
2.2 MSB诱导前后T.asahii形态学变化
2.2.1 肉眼形态 各菌株在PDA固体培养基上培养7 d后,观察可见CBS 2479诱导前乳白色菌落呈放射状,菌落轮廓呈圆形,中央有多量不规则皱褶,堆积呈珊瑚状;经MSB诱导后,菌落轮廓呈不规则形,菌落中央不规则皱褶明细变短变少,局部像破了的水疱;回复实验后,菌落轮廓仍呈不规则形,中央不规则皱褶与诱导末差异不大,CBS 2479-MSB回复菌株中央的不规则皱褶仍短而少(图5)。

图5 MSB诱导、回复前后T.asahii菌落形态变化
CBS 8904诱导前菌落轮廓呈不规则形,中央有少量较大的沟回,表面颗粒状凸起,边缘呈花瓣状;经MSB诱导后,菌落轮廓呈类圆形,中央沟回变小、数量显著增多,颗粒状凸起增多,菌落中央出现大量不规则皱褶,边缘整齐;回复后,菌落轮廓呈圆形,菌落中央出现呈同心圆样的辐射状轮纹,中央出现较多不规则皱褶,边缘整齐(图6)。

图 6 MSB诱导、回复前后T.asahii光镜下形态变化
2.2.2 光镜下形态
CBS 2479菌株诱导前以菌丝为主,MSB诱导末菌丝明显减少变短,出现较多假菌丝,与孢子混合分布,回复末仍可见少量假菌丝混合在孢子中。CBS 8904菌株诱导前几乎全为孢子状态,MSB诱导末以假菌丝为主,仅有少量孢子,回复末仍可见大量假菌丝,中间散在分布少量孢子(图6)。
3 讨论
病原体(包括细菌、真菌和病毒等)侵入机体后,诱导机体进入氧化应激状态,释放大量活性氧递质(reactive oxygen,ROS)来杀灭病原体。ROS主要包括过氧化氢、超氧阴离子、羟自由基、过氧化物等[17],ROS 的杀伤力非常强,几乎能破坏所有的生物分子,包括所有病原体[18],如细菌、真菌、病毒等。ROS主要通过与细胞内成分如蛋白质、脂质、DNA 等发生反应,使细胞严重破坏,引起细胞死亡。而病原体为了生存,会启动自身的一系列抗氧化机制,来对抗机体的氧化杀伤,为它们的侵袭感染和致病创造条件。笔者前期研究发现,常用的3种氧化剂中,甲萘醌对T.asahii的氧化杀伤作用最强[14]。因此,本研究首次应用甲萘醌体外诱导T.asahii,以期获得T.asahii抗甲萘醌菌株,并观察诱导前后菌株的生物学特性变化,为下一步抗氧化机制研究奠定基础。
本研究发现,经MSB诱导后,CBS 2479和CBS 8904的抗氧化酶活性均升高。CBS 2479诱导第4代(即诱导末)CAT值较诱导前升高了4.36倍,而CBS 8904诱导第4代(即诱导末)CAT值则较诱导前升高了3.27倍;CBS 2479诱导第4代(即诱导末)SOD值较诱导前升高了3.68倍,而CBS 8904诱导第4代(即诱导末)SOD值较诱导前升高了3.57倍。本研究结果表明,MSB在体外可以成功诱导T.asahii,并可激活或诱导抗氧化酶活性,使T.asahii的抗氧化能力显著提高,从而不被宿主免疫系统释放的ROS杀死,为其今后感染宿主奠定重要基础。
CBS 2479和CBS 8904回复后,它们的抗氧化酶活性均较诱导末明显下降,但是仍高于诱导前。CBS 2479回复末CAT值较诱导末下降了3.6倍(P<0.05),而CBS 2479回复末SOD值则较诱导末仅下降了1.3倍。CBS 8049回复末CAT值较诱导末下降了1.8倍,而CBS 8904回复末SOD值则较诱导末仅下降了1.1倍。提示当去除MSB暴露后,菌株的SOD、CAT值逐渐下降,说明菌株的CAT和SOD的诱导具有可调节性。本研究发现,CBS 2479回复末的抗氧化酶活性较诱导末显著下降,其CAT值几乎回复到诱导前水平,而CBS 8904回复末较诱导末有下降,不如CBS 2479明显,但与诱导前比,仍高1.8倍,提示CBS 2479对MSB干预后可调节性较强,而CBS 8904对MSB干预后可调节性相对较弱。笔者分析,临床分离株CBS 2479由于之前曾与机体免疫系统等相互作用后激活了其抗氧化能力,因此其抗氧化能力的可调节性较强;而环境分离株CBS 8904未曾进入机体,其抗氧化能力未被激活,因此其抗氧化调节能力相对较弱。
为了生存,真菌常通过形态转换逃避有害因素的刺激,真菌形态转换是其重要的毒力或致病因素。本研究发现,CBS 2479和CBS 8904诱导前后其菌落形状、菌落上沟回或皱褶的形状、数量以及菌落的质地发生较明显变化,光镜下观察发现其菌丝、孢子之间出现相互转换。笔者分析认为,在MSB的干预下,T.asahii为了生存,进行形态转换来应对这种有害刺激。因此,T.asahii在氧化剂MSB的干预下发生形态转换,不仅是其为了逃避有害因素刺激,而且其毒力或致病性也将发生了变化,为其今后感染宿主创造了重要条件。
总之,笔者通过在体外用MSB对T.asahii的临床标准株和环境株进行抗氧化诱导,成功诱导出抗氧化菌株,并对抗氧化菌株的稳定性进行了研究,同时观察了MSB对T.asahii的临床标准株和环境株形态学的影响。本研究为今后阿萨希毛孢子菌感染的抗氧化机制研究提供了实验模型,也为T.asahii抗氧化机制的后续研究奠定了重要基础。
