丙戊酸对骨代谢的影响及其机制
2019-08-15樊丹旸孙美珍
樊丹旸,孙美珍
0 引言
丙戊酸(Valproic acid,VPA)是一种多功能药物,广泛用于癫痫、双相情感障碍、抑郁症、偏头痛等疾病[1]。近年来,有学者发现其可作为辅助抗癌剂,VPA作为组蛋白去乙酰化酶(Histone deacetylases,HDAC)抑制剂,可抑制肿瘤生长和肿瘤血管生成[2]。恶心、呕吐、腹泻、体重增加、血小板降低和中性粒细胞减少是VPA最常见的不良反应,其中,针对骨质疏松症和骨折风险增加的研究较为广泛,但其结果不一致,且其潜在的机制目前仍不明确。本文概述了关于VPA对骨代谢的影响以及所涉及的分子机制的研究。
1 骨结构和代谢
骨骼是一个动态的组织,其在整个生命过程中不断变化,以保持骨骼的大小、形状和结构完整性,调节矿物质平衡。骨重塑通过骨细胞的高度调节和协同作用发生,包括破骨细胞激活、骨基质溶解、骨钙移出,以及骨表面成骨细胞形成、骨基质合成、钙沉积矿化2个方面。骨组织在合成与分解代谢过程中产生许多代谢产物,并以不同浓度和结构方式分布于骨骼、血液、尿液及体液中;调节骨代谢的内分泌激素,不但影响骨重塑,也反馈调控骨代谢的多个环节,维持骨代谢平衡和内环境稳定。
骨代谢标志物大致分为一般生化标志物、骨代谢调控激素和骨转换标志物3类[3]。一般生化标志物主要指血钙、血磷、尿钙、尿磷等。骨代谢调控激素主要包括维生素D[25(OH)D]、甲状旁腺激素(Parathormone,PTH)等。骨转化标志物则反映骨形成标志物和骨吸收标志物2类。前者代表成骨细胞及骨形成状态,后者主要反映破骨细胞活性与骨吸收水平。骨形成标志物有Ⅰ型前胶原N端前肽(N-terminal propeptide of type 1 precollagen,PINP)、Ⅰ型前胶原C端前肽(C-terminal propeptide of type 1 precollagen,PICP)、骨特异性碱性磷酸酶(Bone-specific alkaline phosphatase,BALP)、碱性磷酸酶(Alkaline phosphatase,ALP)、骨钙素(Osteocalcin,OC)等。骨吸收标志物有Ⅰ型胶原交联氨基端肽区(Type 1 collagen cross-linked N-telopeptide,NTX)及羧基端肽区(Type 1 collagen cross-linked C-telopeptide,CTX)、Ⅰ型胶原交联羧基末端肽(Carboxyterminal cross linked telopeptide of type 1 collagen,ICTP)及羟脯氨酸(Hydroxyproline,HOP)等。
2 抗癫痫药物对骨代谢的影响
抗癫痫药物(Antiepileptic drugs,AEDs)对骨代谢影响的潜在病理-生理机制是多因素的,包括细胞色素P450酶的激活、骨转换增加和尿钙及尿磷的损失增加[4]。然而,AED类型与骨折风险之间的关系仍然是不确定的。
苯巴比妥、苯妥英钠、卡马西平等作为肝细胞色素P450酶的诱导剂,是降低骨密度(Bone mineral density,BMD)及影响骨代谢的主要机制。诱导细胞色素P450酶的AEDs促进维生素D分解代谢,维生素D水平下降导致钙吸收减少,继发甲状旁腺激素增加,从而激活破骨细胞来增加骨转换,并从骨骼中吸收钙,最终导致骨质流失[5]。非酶诱导剂AEDs如拉莫三嗪、左乙拉西坦对骨代谢影响的数据较少[6]。酶抑制剂VPA对骨代谢的影响仍存在争议。早期研究显示,VPA的使用与骨丢失没有关联,而近期研究显示,儿童和成人癫痫患者长期使用VPA治疗后,出现骨及矿物质代谢生化指标异常,且骨折发生率较高[7-9]。
3 VPA对骨的影响
3.1 临床试验
3.1.1 VPA对骨密度的影响 关于VPA对骨密度影响的临床试验结果并不一致。有报道,儿童或成年人的VPA 单药治疗对股骨颈和腰椎BMD值没有影响[10-11],而在其他研究中,使用VPA治疗超过6个月后,腰椎、股骨颈的BMD显著降低[7-9],见表1。Guo等[12]发现,儿童癫痫患者全身BMD的变化似乎不是由VPA引起的,而是由于体力活动水平下降引起的。如果怀疑活动量低这个原因,全身骨量的测量就尤为重要,因为负重区域骨骼部位在不同的生活方式中是不同的,而很多研究只进行了诸如前臂、腰椎等区域骨骼的测量,需要更多的研究进一步支持。一项Meta分析中,研究者纳入了对儿童进行长期VPA治疗(0.5~6年)的研究,结果表明,VPA可导致腰椎、股骨颈、大转子BMD显著下降[13]。
3.1.2 VPA对骨代谢标志物的影响 在VPA治疗期间,一般生化标志物,如血钙、血磷、骨代谢调控激素25(OH)D和PTH增加、降低、不变均有,但大多数研究报道,VPA治疗并未显著改变血Ca、P、25(OH)D、PTH浓度(表2)。在骨转化标志物中,Verrotti等[20]研究表明,儿童患者使用VPA治疗后,骨形成标志物PICP增加,而血清OC、ALP及BALP水平增加、降低或不变均有,且血清BALP值并不一定总伴随着ALP变化,因为ALP值的变化受肝和骨代谢共同影响,骨吸收标志物血清ICTP增加,表明VPA加快了骨转化。
3.2 动物实验 有报道,VPA治疗癫痫大鼠90 d后,股骨、股骨颈、大转子及腰椎BMD均下降,骨钙素升高,表明骨转换增加[28],且观察到VPA治疗大鼠BMD下降与骨转换增加有关,骨吸收程度超过骨形成。Anwar等[29]用100、300 mg/kg剂量VPA处理小鼠4个月后,发现腰椎BMD显著降低,且其尿钙排泄显著增多。Parveen等[30]用VPA对健康小鼠处理10周,结果显示,股骨和腰椎的BMD显著降低,RANKL增加,表明骨吸收增加。而RANKL参与破骨细胞形成和骨重建的调节,并通过破骨细胞生成或多核成熟破骨细胞的活化促进骨吸收[31]。李欣等[32]用海人酸注射入大鼠腹腔制作癫痫模型后,使用VPA灌胃治疗,结果显示,与正常对照组及模型组比较,大鼠血清PICP降低,NTX增加,表明采用丙戊酸钠治疗不但起到抑制骨形成作用,还能促进骨吸收。VPA对骨密度及骨代谢影响的动物实验结果显示,VPA可加快骨转换,且骨吸收程度大于骨形成程度,导致腰椎、股骨颈等骨密度降低。
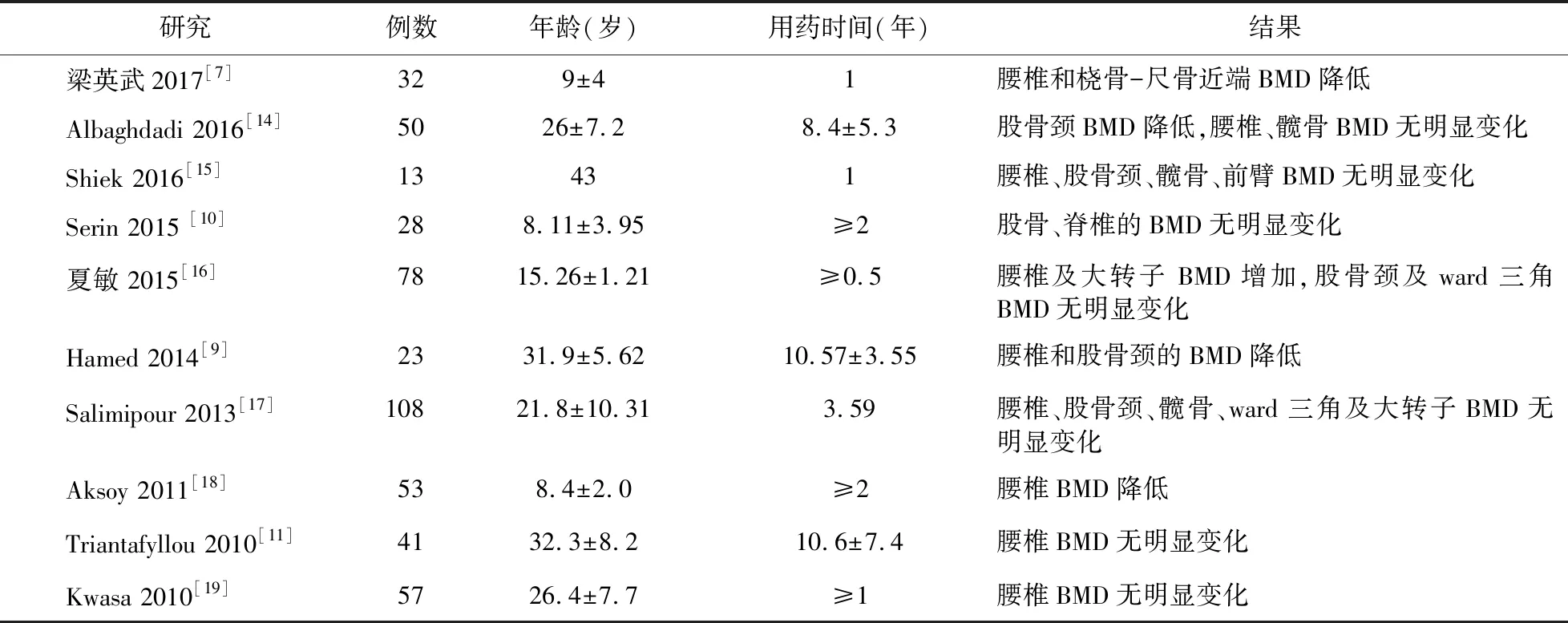
表1 使用VPA治疗的BMD研究
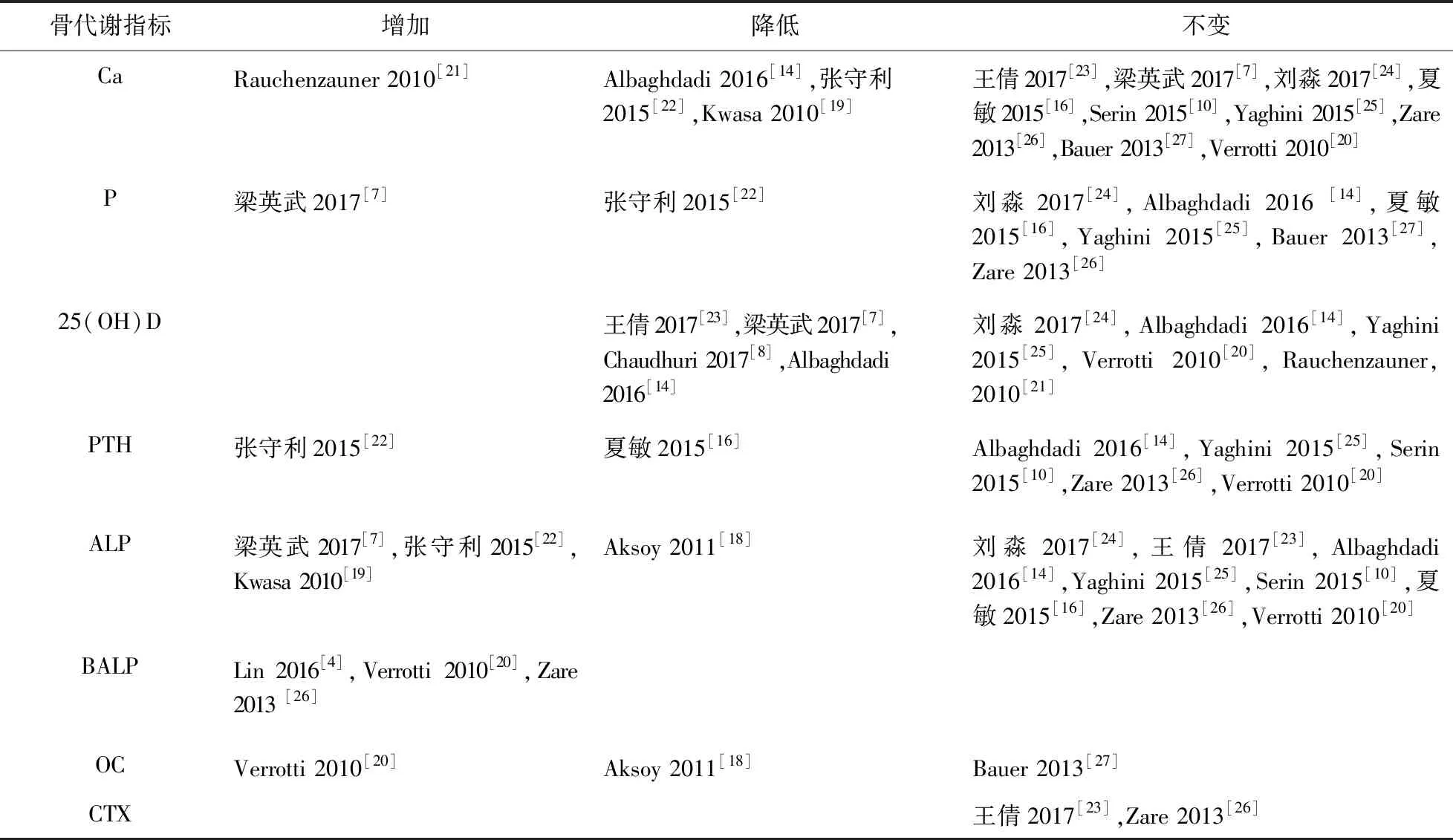
表2 使用VPA治疗的患者的骨代谢标志物研究
3.3 VPA对骨代谢影响的机制
3.3.1 对骨细胞的直接影响 有报道,VPA作为HDAC抑制剂对骨细胞有直接作用。HDAC参与染色体结构修饰和基因表达的调节,组蛋白乙酰化可以开放染色质结构,促进基因的转录;反之,当组蛋白处于去乙酰化状态时,染色质结构变得致密,阻碍转录复合体的结合,抑制基因的转录表达[33]。
VPA通过增强Runx2基因转录来调节成骨细胞分化和骨形成。Runx2基因是成骨细胞分化所必需的转录因子,且受HDAC调控[34]。尽管成骨细胞分化增强,但在成骨细胞系hFOB1.19的分化过程中,用VPA处理后可显著降低Ⅰ型胶原和骨黏连蛋白的合成。Ⅰ型胶原蛋白是骨骼的主要蛋白质成分,骨黏连蛋白是维持骨量和正常骨重塑所必需的胶原结合糖蛋白[35],这2种关键骨蛋白减少可能是癫痫和其他疾病使用丙戊酸治疗后相关的骨质流失和骨折风险增加的机制。因此,VPA可能增强成骨细胞分化,但是可能不会形成成熟的成骨细胞。 骨不仅由成骨细胞和骨细胞组成,还由软骨细胞和脂肪细胞组成,其组织、整合以维持骨稳态,这些不同类型的细胞均来自间充质细胞(Mesenchymal stem cells,MSCs)。Hatakeyama等[36]在小鼠胚胎间质细胞系C3H10T1/2 中进行了实验,观察VPA对MSCs的影响,结果显示,VPA在细胞外基质蛋白如纤维连接蛋白和Ⅰ型胶原蛋白下抑制MSCs增殖;之后,有学者也发现,VPA可抑制大鼠MSCs中的细胞增殖[37],提示VPA以抑制MSCs增殖为前提,促进骨的前成骨细胞的分化。
根据目前的证据,虽然VPA可能对成骨细胞分化产生积极影响,但其抑制成熟成骨细胞活性,提示可能与临床研究中显示的骨质流失和骨折风险增加有关。
3.3.2 VPA对维生素D代谢的影响 尽管VPA是细胞色素P450抑制酶,仍有一些研究表明VPA可诱导维生素D分解代谢。
人肝细胞和人胚胎肾细胞的体外研究显示,VPA增加了CYP24mRNA表达[38],CYP24是参与维生素D分解代谢的主要酶,可加快维生素 D代谢,这可能是药物诱导的骨软化的原因。在另一项研究中,VPA可以通过CYP3A4诱导维生素D分解代谢[39],且发现VPA可作为孕烷X受体(Pregnane X receptor,PXR)和雄甾烷受体(Androstane receptor,CAR)的激活剂,PXR和CAR可通过调节CYP24和CYP3A4基因表达改变VD3激素活性。
3.3.3 VPA通过性腺功能减退间接影响骨代谢 VPA治疗可导致性腺功能减退,这也可能是这些患者骨质流失的原因。女性的雌激素和男性的睾酮可作用于破骨细胞并减少骨吸收[40]。VPA治疗可引起女性明显的生殖内分泌改变、多囊卵巢综合征、月经紊乱和排卵障碍等;VPA治疗的男性表现出雄激素血液浓度降低、精子活力和勃起功能障碍的异常[41]。
雄激素对男性的骨骼生长及骨量维持具有重要作用[42]。目前,雄激素对骨代谢的调控有2条途径:一是通过与骨细胞、成骨细胞上的雄激素受体结合来调控成骨、破骨细胞的功能;二是雄激素芳香化为雌激素,通过雌激素受体实现其调控骨代谢的作用[43]。有研究表明,女性骨质疏松症与雌激素减少密切相关:当女性进入绝经期时,女性性腺分泌雌激素尤其是雌二醇明显减少,相应骨代谢中出现骨吸收大于骨形成[44]。AEDs可刺激雌二醇和雌酮的微粒体分解代谢以及性激素结合球蛋白合成,增加的性激素结合球蛋白水平可导致C19类固醇的血清水平降低,导致C19类固醇向相应的雌激素的转化率降低。雌激素减少可增强骨中白细胞介素-7的产生,进一步激活T细胞并释放干扰素、肿瘤坏死因子和RANKL,从而介导破骨细胞生成[45]。
3.3.4 遗传因素 有学者发现某些基因与骨转换加快、骨密度降低或骨折有关[46]。Senn等[47]使用VPA处理不同品种的小鼠,处理8周后,评估其总骨矿物质含量、小梁体积及数目,发现不同品系的小鼠总骨矿物质含量、小梁体积及数目不同,表明长期VPA治疗对骨的不良反应易感性可能与遗传基因有关。Lambrinoudaki等[48]发现,维生素D受体基因多态性中,B等位基因与使用VPA及其他AEDs治疗患者的骨密度降低有关,且这种作用可能是通过维生素D-甲状旁腺素途径介导的。还有研究显示,在COL1A1 Sp1多态性s等位基因与接受VPA治疗的癫痫患者中腰椎及股骨 BMD降低有关[49]。今后需更多的相关研究以发现参与这种疾病的易感基因。
4 小结
VPA是目前临床上使用最广泛的AEDs之一,研究表明,长期使用VPA可能会对骨代谢产生影响。上述临床试验中结果尚不一致,大多为阴性结果,考虑试验中可能存在重要的混杂因素,如膳食、摄入钙及维生素D、日光照射量和运动水平并不能完全控制;也可能出现其他共存病及相关药物使用影响;年龄也可能影响骨密度及骨代谢指标。在骨密度研究中,骨密度明显降低大多发生在儿童患者中。与成人相比,儿童尚处于生长发育期,骨代谢调控体系可能尚未发育成熟,因此,儿童患者骨密度等更易受影响[50]。大多数研究总样本量偏小,尚需大样本的病例对照研究来阐明VPA可能影响骨密度和骨代谢的时间、剂量和其他因素。VPA对骨骼的作用机制是多方面的,总体效果是骨折风险增加。VPA在骨中的主要作用包括通过降低成骨细胞增殖、抑制成骨细胞活性和诱导维生素D分解代谢而直接影响骨细胞;也可通过性腺机能减退间接导致骨质流失增加;此外,VPA治疗对骨的不良反应易感性可能与遗传基因有关,如维生素D受体基因多态性中B等位基因及COL1A1 Sp1多态性s等位基因等。在临床中使用VPA时,要长期监测BMD及骨代谢标志物,有异常时要及时调整VPA剂量,必要时补充钙及维生素D。
