原发中枢神经系统淋巴瘤乏坏死的影像与病理研究
2019-08-14刘丹丹解丽梅刘亚敏巴照贵
刘丹丹,解丽梅,薛 辉,刘亚敏,巴照贵
(1山东第一医科大学附属莱钢医院影像科 莱芜 山东 271100)(2山东第一医科大学附属莱钢医院病理科 莱芜 山东 271100)
原发中枢系统淋巴瘤(Primary central nervous system lymphoma,PCNSL)是一种少见的仅发生于中枢神经系统恶性肿瘤,主要发生于脑内,约占颅内肿瘤的1%~3%左右[1-2],病理类型大多为弥漫大B细胞淋巴瘤。在MRI上肿瘤信号多均匀,少坏死。目前,多认为PCNSL少坏死主要与肿瘤浸润血管壁、血脑屏障破坏有关[2]。但PCNSL是乏血管肿瘤,能从破坏的血管内漏出的营养物质是有限的;且PCNSL网状纤维丰富,纤维也会阻碍营养物质的弥散。基于此,我们对一组经病理证实的PCNSL进行研究,并与高级别胶质瘤(high grade glioma,HGG)对照,探讨PCNSL影像学表现与病理相矛盾的机制。
1 资料与方法
1.1 一般资料
回顾性分析我院2012—2017年间病理证实的PCNSL和HGG患者各21例,其中PCNSL中男13例,女8例,年龄31~76岁,中位年龄57岁。HGG男11例,女10例,年龄39~73岁,中位年龄54岁。纳入标准:临床及影像学资料齐全;无免疫缺陷的病史;MRI检查前无激素治疗;排除系统性淋巴瘤。所有患者均在MRI检查后2周内取得病理结果。PCNSL患者中14例单发,7例多发;HGG患者20例单发,1例多发;多发病灶中,取最大病灶纳入研究,各21个病灶纳入研究。
1.2 MRI检查方法及结果判读
利用MR扫描仪(Horizontal,GE)及8通道头线圈进行扫描。扫描参数如下:轴位T1WI(TR:450ms,TE:10ms)、T2WI(TR:4200ms,TE:98ms)、DWI(TR:7000ms,TE:83.7ms),增强扫描SE T1WI(TR:450ms,TE:10ms),FOV 240mm×240mm,矩阵 256×192,层厚5mm,层间距1mm,NEX=1;以最快速度经肘正中静脉注射钆喷酸葡胺(剂量0.1mmol/kg)。
计算坏死指数(Necrosisindex,NI)。NI=V2/V1,V1为肿瘤体积,V2为坏死体积。V=4πABC/3,A、B为轴位最大截面互相垂直的两条径线,C为矢状位上的最大高度。NI<1/3为轻度坏死,1/3≤NI<2/3为中度,NI≥2/3为重度。
1.3 病理染色及结果判读
根据说明书行常规HE染色、CD34+PAS双重染色、α-SMA免疫组化染色。
MVD计数参照Weidner[3]的方法:低倍镜(×100)下确定肿瘤血管密度最高处,高倍镜(×200)下,以1个棕色染色的内皮细胞或细胞丛作为1支血管,只要结构不相连,其分支结构也作为1支血管计数。随机选取3个视野并取平均数,以每mm2微血管数作为MVD值。成熟血管计数(α-SMA染色)参照MVD计数方法,以血管平滑肌细胞出现棕色染色为阳性。
血管生成拟态分析:PAS阳性结构为红色条索状、环形、网状结构。半定量分析:随机取5个视野观察,若3个或以上视野内出现PAS阳性结构,并占每个视野1/2以上区域者,为强阳性。反之为弱阳性。
1.4 统计学分析
采用SPSS19.0统计软件,相关性采用Sperman相关性分析。P<0.05表示差异有统计学意义。
2 结果
2.1 肿瘤内血管、血管生成拟态、网状纤维分析
PCNSL的MVD和成熟血管数目均明显低于HGG(表1);所有病灶皆有PAS染色阳性索状或网状结构(即图案样基质型血管生成拟态),其中强阳性12个,PAS阳性结构相互连接呈网状(图1),并可形成“背靠背”的结构;弱阳性9个。HGG病灶仅可见少量的条索状PAS阳性结构及肿瘤细胞围成的环形结构(图2)。
表1 PCNSL与HGG血管数目比较(±s)
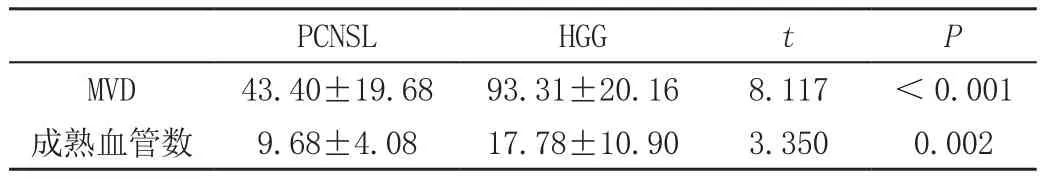
表1 PCNSL与HGG血管数目比较(±s)
PCNSL HGG t P MVD 43.40±19.68 93.31±20.16 8.117 <0.001成熟血管数 9.68±4.08 17.78±10.90 3.350 0.002
2.2 MRI图像分析
21个纳入研究的PCNSL病灶最大径为1.0~7.5cm,平均3.68±1.51cm。共9个病灶出现坏死,7例轻度坏死(其中3例为点状坏死),1例中度坏死,1例重度坏死。坏死病灶中出现硬环征者4例,2例出现于轻度坏死病灶,其余两个分别为中、重度坏死病灶。病灶最大径小于2.5cm者均无囊变坏死现象。
HGG最大径为2.1~7.2cm,平均3.96±1.65cm。所有病灶均出现坏死,轻度坏死2例,中度坏死10例,重度坏死9例。
2.3 PCNSL坏死指数与肿瘤血管及血管生成拟态、网状纤维的关系
NI与VM呈负相关(r=-0.198,P=0.015;与病变大小呈正相关(r=0.546,P=0.01);与MVD及成熟血管数未见相关性(P>0.05)。
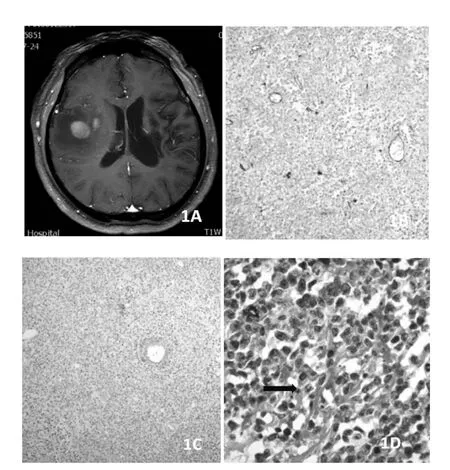
图1A:PCNSL,1B:CD34染 色,×200,MVD为 27.3/mm2;1C:α-SMA染色,×100,成熟血管数为6.3/mm2;1D:PAS+CD34染色,×400,红染的网状结构PAS阳性结构,为图案基质型VM(黑箭)。
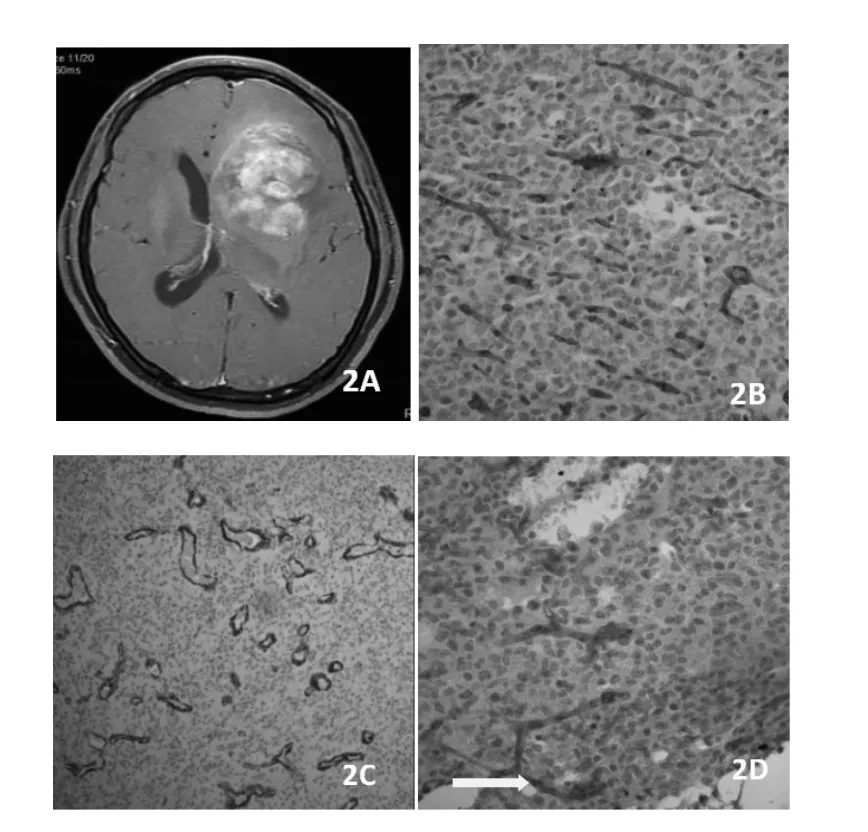
图2A:HGG,2B:CD34染色,×100,MVD为98.7/mm2;2C:α-SMA染色,×100,成熟血管数为33/mm2;2D:PAS+CD34染色,×200,图案基质型VM(黄箭)。
3 讨论
典型的PCNSL在MRI表现为T1WI等或稍低信号,T2WI等或稍高信号,DWI呈明显高信号,信号较均匀,囊变、出血少见,增强呈均匀明显强化;HGG则表现为稍长T1稍长T2信号肿块,内信号不均匀,出血、囊变常见,强化不均匀,部分病环形强化。
王继伟[4]等报道25例行MRI扫描患者的43个病变中,有4个病灶出现囊变坏死。王成龙[5]等报道的36个病灶中,仅有4个出现坏死。但我们发现淋巴瘤内部出现囊变坏死并不少见。本组选取的21例病灶中共9个发生坏死囊变,这远远高于既往报道,这可能与本组病变选择有关,本组患者所选取的皆是最大病灶,本组病灶的坏死与肿瘤的大小呈正相关,只有大于2.5cm的病灶才出现囊变坏死,肿瘤越大,生长所需的营养越多,那么越容易出现坏死囊变。本组大部病灶为轻度坏死,其中3个为灶性。这远比HGG的坏死程度轻,本组HGG均出现坏死。理论上病变囊变坏死与肿瘤内血管数量有关,肿瘤内血管少是导致囊变坏死的主要原因。PCNSL的肿瘤微血管密度低,而囊变坏死发生率低HGG较、坏死程度较HGG轻,我们认为这不仅与其浸润血管,使瘤细胞可以获得氧气和营养物质有关。因为PCNSL的血管数量少,从破损的血脑屏障漏出的营养物质有限,不足以支撑肿瘤的生长。
1999年Maniotis等[6]首次报道了血管生成拟态(vasculogenic mimicry,VM),近些年来在研究发现多种恶性肿瘤中均有发现[6-8]。VM存在两种形式:即图案样基质型和管道型。VM是肿瘤细胞通过自身塑形模拟血管内皮细胞形成可以运输血浆和(或)红细胞的管道系统并与血管相连,以满足肿瘤生长所需的血液供应[6-8]。本研究通过CD34+PAS双重染色发现,肿瘤内部有不同数量的PAS阳性网状、索条状物质,可形成“背靠背”样的环形结构,这是图案基质型血管拟态。我们推测血管周围的瘤细胞可以通过浸润、破坏血管壁使营养物质漏出而得到营养供应,而距离血管较远的瘤细胞可以通过VM结构运输氧气和营养物质,以满足其生长需求。
尽管本研究样本量较小,统计偏畸不可避免,但综上所述,PCNSL中丰富的图案基质型VM的可能是导致乏血管的PCNSL呈现少坏死、轻坏死的主要原因之一。
