炎性小体在右美托咪定减轻大鼠肾缺血再灌注损伤中的作用
2019-08-12王全胜艾热提路菲菲
王全胜 艾热提 路菲菲
急性肾损伤是临床手术的常见并发症,其可显著增加慢性肾脏疾病和患者死亡的风险[1]。炎性小体(NLRP3)是免疫炎性反应的重要组成部分,参与了急性肾损伤、糖尿病肾病及慢性肾脏病的发生、发展过程[2~4]。有研究显示,NLRP3的激活可导致促炎细胞因子如白细胞介素-1β(IL-1β)和IL-18的合成与分泌,引发肾脏炎性反应和纤维化[5]。右美托咪定是一类高选择性的α2肾上腺素能受体激动剂,其受体广泛分布于肾脏近曲和远曲小管[6]。动物实验研究表明,右美托咪定可显著减轻重要脏器如心脏、肝脏、肾脏等缺血再灌注损伤,及其引发的炎性反应和细胞凋亡、坏死[7~9]。右美托咪定能否通过降低NLRP3表达,减轻肾缺血再灌注损伤,目前研究尚不清楚。因此,本研究拟评价右美托咪定在肾缺血再灌注损伤中的保护作用及其与NLRP3的关系。
材料与方法
1.实验动物及模型建立:SD清洁级雄性大鼠32只(12~14周,体质量230~250g)由新疆医科大学实验动物中心提供,动物实验合格证:SCXK(新)2011-0004。采用数字表法随机分为4组,即假手术组(Sham组,n=8)、肾缺血再灌注损伤组(I/R组,n=8)、肾缺血再灌注损伤+右美托咪定预处理组(I/R+Dex预处理组,n=8)和肾缺血再灌注损伤+右美托咪定后处理组(I/R+Dex后处理组,n=8)。大鼠肾缺血再灌注损伤模型参考文献[10]。简要操作如下:经腹腔注射戊巴比妥钠(50mg/kg,美国Sigma公司)麻醉大鼠后,经腹部正中切开,暴露双侧肾脏,分离肾蒂。Sham组为仅暴露分离双侧肾蒂后,关闭腹腔;I/R组为夹闭双侧肾蒂,阻断供血45min后,松开血管夹,再灌注24h;I/R+Dex预处理组为缺血前1h腹腔注射右美托咪定(美国Pfizer公司)10μg/kg;I/R+Dex后处理组为再灌注后1h腹腔注射右美托咪定10μg/kg。再灌注24h后收集上述各组肾脏组织标本。
2.血肌酐和尿素氮水平检测:各组大鼠于肾缺血再灌注24h后鼠尾静脉血,1500×g离心5min,取上清,采用全自动生化分析仪(美国Beckman公司)检测各组血清上述指标。
3.TNF-α和IL-10的水平的检测:各组大鼠于肾缺血再灌注24h后鼠尾静脉血,1500×g离心5min后,取上清,采用ELISA试剂盒(南京建成生物技术公司)检测各组大鼠炎性指标如TNF-α和IL-10水平。
4.TUNEL染色:取上述肾脏组织标本,经石蜡切片,加入20μg/ml不含DNA酶的蛋白酶K,采用TUNEL试剂盒(德国Roche公司)提供的检测液,加入50μl,室温孵育。用抗荧光淬灭封片液封片后观察,每张片放大400倍,随机取5个视野,进行凋亡细胞(棕褐色或棕黄色颗粒)和总细胞计数,细胞凋亡指数(%)=凋亡细胞计数÷总细胞计数×100%。
5.免疫印迹法检测肾脏NLRP3、凋亡信号(caspase-1、Bcl-2)的表达水平:提取各组大鼠肾脏组织蛋白,50μg组织蛋白于10%聚丙烯酰胺凝胶电泳分离后,转移置硝基纤维素膜,给予5%脱脂牛奶封闭2h,分别孵育鼠抗NLRP3抗体(1∶400,英国Abcam公司)、caspase-1抗体(1∶300,英国Abcam公司)、Cleaved caspase-1抗体(1∶400,英国Abcam公司)、Bcl-2抗体(1∶400,美国Cell Signaling Technology公司)及抗GAPDH抗体(1∶400,美国Santa Cruz Biotechnology公司),4℃避光孵育过夜。次日取出膜,给予避光室温孵育荧光羊抗兔二抗(1∶11000),采用凝胶成像系统测定蛋白条带灰度值,以GAPDH为内参,并计算目的条带与GAPDH灰度比值。

结 果
1.各组大鼠肾功能水平比较:与Sham组比较,I/R组、I/R+Dex预处理组及I/R+Dex后处理组血肌酐和尿素氮水平均明显升高(P<0.05);与I/R组比较,I/R+Dex预处理组和I/R+Dex后处理组血肌酐和尿素氮水平均明显降低(P<0.05);而I/R+Dex预处理组和I/R+Dex后处理组比较,血肌酐和尿素氮水平差异无统计学意义(P>0.05),详见表1。

表1 各组大鼠肾功能水平比较
与Sham组比较,*P<0.05;与I/R组比较,#P<0.05
2.各组大鼠血清炎性因子水平比较:与Sham组比较,I/R组、I/R+Dex预处理组及I/R+Dex后处理组血清TNF-α和IL-10水平均明显升高(P<0.05);与I/R组比较,I/R+Dex预处理组和I/R+Dex后处理组上述指标均明显降低(P<0.05),详见表2。
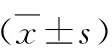
表2 各组大鼠血清炎性因子水平比较
与Sham组比较,*P<0.05;与I/R组比较,#P<0.05
3.各组大鼠肾小管细胞凋亡水平比较:Sham组未发现明显的肾小管细胞凋亡,而I/R组、I/R+Dex预处理组及I/R+Dex后处理组较Sham组肾小管细胞凋亡明显增多(P<0.05);而与I/R组比较,I/R+Dex预处理组和I/R+Dex后处理组肾小管细胞凋亡明显减少(P<0.05,图1)。

图1 各组大鼠肾小管凋亡水平(×400)A.Sham组;B.I/R组;C.I/R+Dex预处理组;D.I/R+Dex后处理组
4.各组大鼠肾组织NLRP3、caspase-1、Cleaved caspase-1和Bcl-2表达水平:与Sham组比较,I/R组肾组织NLRP3、caspase-1、Cleaved caspase-1表达水平均明显升高,而Bcl-2表达明显降低(P<0.05);与I/R组比较,I/R+Dex预处理组和I/R+Dex后处理组肾组织NLRP3、caspase-1、Cleaved caspase-1表达水平明显降低,Bcl-2表达明显升高(P<0.05),详见图2。

图2 各组大鼠肾组织NLRP3、Cleaved caspase-1、caspase-1和Bcl-2表达水平与Sham组比较,*P<0.05;与I/R组比较,#P<0.05
讨 论
相关研究显示,右美托咪定可保护重要脏器如肾脏、肝脏及心脏等缺血再灌注损伤,但机制还不完全清楚[11~13]。本研究结果显示,右美托咪定保护肾脏缺血再灌注损伤与降低NLRP3表达有关。肾脏缺血再灌注损伤可增加NLRP3和caspase-1的水平,而给予右美托咪定处理,可显著逆转上述作用,同时降低体内炎性水平,表现为TNF-α降低和IL-10的升高。
血肌酐和尿素氮水平是临床评判肾功能的重要指标,在急性肾损伤、慢性肾功能不全等,可显著升高。本研究通过建立肾脏缺血再灌注损伤模型,结果显示,与Sham组比较,I/R组血肌酐和尿素氮水平显著升高,表明肾缺血再灌注引起了肾功能显著受损,提示模型制备成功。NLRP3是由胞质内多种蛋白质组成的复合体,其含有凋亡相关微粒蛋白、caspase-1等,是天然免疫系统的重要组成部分。当NLRP3受外在刺激被激活时,活化的caspase-1随后激活IL-1β和IL-18,产生炎性级联反应[14]。相关研究显示,NLRP3可促进肾脏相关疾病如慢性肾功能不全及糖尿病肾病的进展,同时其可作为潜在的治疗靶点[15,16]。抑制NLRP3激活可显著降低糖尿病肾病的炎性反应,改善肾功能及预后[17]。
右美托咪定是高选择性的α2肾上腺素能受体激动剂,具有镇静、镇痛及抗交感作用,同时其受体在肾脏具有广泛分布,对肾脏缺血再灌注损伤具有显著保护作用,但机制不清。已有研究表明,右美托咪定通过调节细胞凋亡,降低炎症及氧化应激,从而对重要器官缺血损伤起保护作用[18]。因此,笔者假设通过抑制NLRP3,降低炎症及细胞凋亡,可能参与了右美托咪定对肾脏缺血再灌注损伤的保护作用。本研究发现,肾脏缺血再灌注损伤可显著增加NLRP3、caspase-1及Cleaved caspase-1的表达,而右美托咪定可显著抑制NLRP3激活,降低炎性反应即TNF-α降低而IL-10升高,进一步抑制凋亡通路的激活。TNF-α和IL-10是单核-吞噬细胞产生的重要炎性因子,可进一步刺激中性粒细胞分泌趋化因子及黏附因子,介导炎性反应的放大[19]。以往研究显示,炎症可促进细胞凋亡,而细胞凋亡是器官缺血再灌注损伤的主要机制之一,在细胞凋亡通路中,caspase-1是重要的剪切酶,抑制caspase-1活性可显著减轻细胞凋亡[20]。本研究结果显示,肾脏缺血再灌注损伤时,其体内炎性反应显著增强,进而引起肾小管细胞凋亡明显增多,导致肾功能受损。
综上所述,NLRP3与大鼠肾缺血再灌注损伤的发生、发展密切相关,右美托咪定可能通过降低NLRP3表达,改善炎症及细胞凋亡,从而保护肾缺血再灌注损伤。
