白藜芦醇通过调节SIRT1/AMPK信号通路对复发大鼠MCAO的神经保护作用机制研究
2019-08-12王永久宫珍卿
王永久 宫珍卿 程 焱
复发性脑卒中的致残率和致死率远远高于单次脑卒中发作,因此在首次脑卒中发作后应用神经保护剂预防脑卒中复发导致的神经元损害非常重要。白藜芦醇(resveratrol, RSV)是一种多酚化合物,在心血管和神经变性动物模型中的保护作用已经得到证实[1, 2]。然而其参与相关调节作用的细胞和分子机制仍不清楚。沉默信息调节因子2相关酶1(silent information regulatorT1, SIRT1)是抗老化基因,在脑缺血时SIRT1活性增强,细胞生命周期延长,抵抗应激能力增加,对致命性脑缺血起到神经保护作用[3, 4]。腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK)是细胞内的能量开关,急性脑缺血后AMPK激活可导致能量衰竭、代谢障碍增加、神经功能损害,而抑制AMPK磷酸化可减轻MCAO模型的神经功能损害[5, 6]。AMPK的激活可通过磷酸化起到类他汀类药物的调脂和神经保护作用[7, 8]。因此,本研究旨在探讨白藜芦醇对复发大鼠缺血性脑卒中的神经保护功能,及其与SIRT1/AMPK信号通路的相关作用机制。
材料与方法
1.单次和复发动物模型制备:18~20月龄成年雄性Wistar大鼠38只,由山东大学动物中心提供,于实验室内适应性饲养1周,室温25~30℃,自由饮水、进食,自然光照。术前12h禁食。参照Qiao等[9]的方法,大鼠复发MCAO模型采用微动脉瘤夹夹闭大脑中动脉(middle cerebral artery, MCA),简单来说,大鼠用异氟烷吸入麻醉(4%诱导麻醉,2%维持),麻醉后的大鼠取侧卧位,在右眼和右外耳间做一条长约10mm的纵切口,分离组织,暴露颞骨,在鼻裂处用微钻头钻一小孔A(直径2mm)以暴露MCA,在A孔背侧3mm处(即MCA近端)钻一小孔B,在A孔后侧3mm处(即MCA远端)钻一小孔C。用激光多普勒仪探头监测B孔和C孔处局部脑血流量(regional cerebral blood flow,rCBF),用微动脉瘤夹夹闭MCA,同时用血管钳夹闭双侧颈总动脉。检测rCBF下降90%以上认为MCAO模型成功。在MCA缺血40min后去掉微动脉瘤夹和血管钳,这样单次MCAO模型成功。单次MCAO模型成功的大鼠喂养3天,在第4天进行第2次MCAO模型手术,手术过程同上述方法,这样双次MCAO模型成功。在术中及术后保持直肠温度在37.0~37.5℃,PE50导管插入股动脉,外接动脉血压检测仪,进行持续动脉血压检测。
2.干预措施:大鼠按照数字表法随机分为假手术组、单次MCAO模型组、双次MCAO模型组,每组又分为实验对照组(予以含15%~20%凝胶的可口饲料作为安慰剂)和RSV治疗组[25mg/(kg·d)喂养]。双次MCAO模型组在第1天行MCAO术后,用安慰剂或RSV喂养3天,第4天进行第2次MCAO手术,继续喂养3天至第7天进行行为学测试。单次MCAO模型组先喂养3天,第4天进行首次MCAO手术,继续喂养3天至第7天进行行为学测试。假手术组制作步骤同上,但不夹闭MCA,详见表1。

表1 大鼠分组情况 (n)
3.观察指标:(1)行为学测定:由1名不知情者应用水平梯任务和圆柱体任务对大鼠的神经行为功能进行评分[10, 11]。(2)TTC染色测量脑梗死体积:大鼠在喂养7天后,10%水合氯醛麻醉,断头取脑,采用Jacobowitz 脑切片仪自前向后连续冠状切片(厚度2mm),置入含2%TTC溶液中,37℃避光孵育10min。正常组织呈鲜红色,坏死区呈苍白色。拍照后应用图像分析仪(Axiovision LE 4.1, Carl Zeiss, Jena, Germany)计算梗死体积。校正的测量梗死面积=测量的梗死面积×{1-[(同侧半球面积-对侧半球面积)/N侧半球面积]}。根据公式V=t(A1+A2+A3+…An)计算出体积,n为单个鼠脑切片数,t为切片厚度,A为每个切片梗死面积[12]。(3)标本的制备:用于活性测定、蛋白表达和ATP水平测定的脑组织标本均采用以下方法制备。大鼠水合氯醛麻醉后迅速断头取脑,取缺血周围脑组织标本约100mg,立即浸泡于液氮中,随后于-70℃保存。(4)SIRT1去乙酰化活性测定:上述脑组织标本加适量裂解液孵育1h,离心取上清液进行SIRT1活性测定。SIRT1活性测定采用去乙酰化荧光检测试剂盒(CycLex, Ina,日本长野公司)进行[13]。在加入荧光底物肽和蛋白质浓度标准化后,反应板在室温下孵育45min,用荧光度仪测定荧光强度(Ex: 350nm, Em: 450nm)。(5)Western blot法印迹检测SIRT1、AMPK及phospho-AMPK表达:上述脑组织加入细胞裂解液,冰浴20min,4℃12000r/min离心10min,取上清液,Lowry法测定蛋白浓度。制备SDS-PAGE凝胶,加样电泳,半干法转膜。室温封闭2h后,加入一抗(SIRT11:500、AMPK1:1000、phospho-AMPK1:1000),4℃过夜,二抗(1∶600)室温孵育2h。以β-actin作为内参。利用Model GS-700图像显像仪测定各条带的灰度值。计算各目的蛋白的相对灰度值(relative value of protein,RVP)。(6)ATP水平测定:上述脑组织冰浴匀浆裂解,4℃15000r/min 离心1min,取上清进行ATP含量测定。参照Troyano等[14]的研究方法,采用ATP生物发光检测试剂盒(Bioluminescence Assay kit CLSII,罗氏诊断,西班牙),应用LuminMax-C 冷光仪检测发光样品强度含量,根据ATP标准品绘制标准曲线,计算样本的ATP含量。

结 果
1.大鼠MCAO模型rCBF监测:大鼠MCA近侧及远侧rCBF比较,差异无统计学意义(P>0.05)。各组的大鼠脑缺血核心区rCBF均下降90%以上,说明大鼠MCAO模型制备成功,详见表2。

表2 缺血核心区rCBF (%)
2.RSV对MCAO大鼠行为学影响:实验结果显示双次MCAO大鼠的行为学缺损比单次MCAO严重(P<0.05)。在水平梯任务实验,RSV治疗组较对照组的步态错误发生率显著降低。在圆柱筒任务实验,RSV治疗组较对照组的非对称积分显著降低,详见图1。
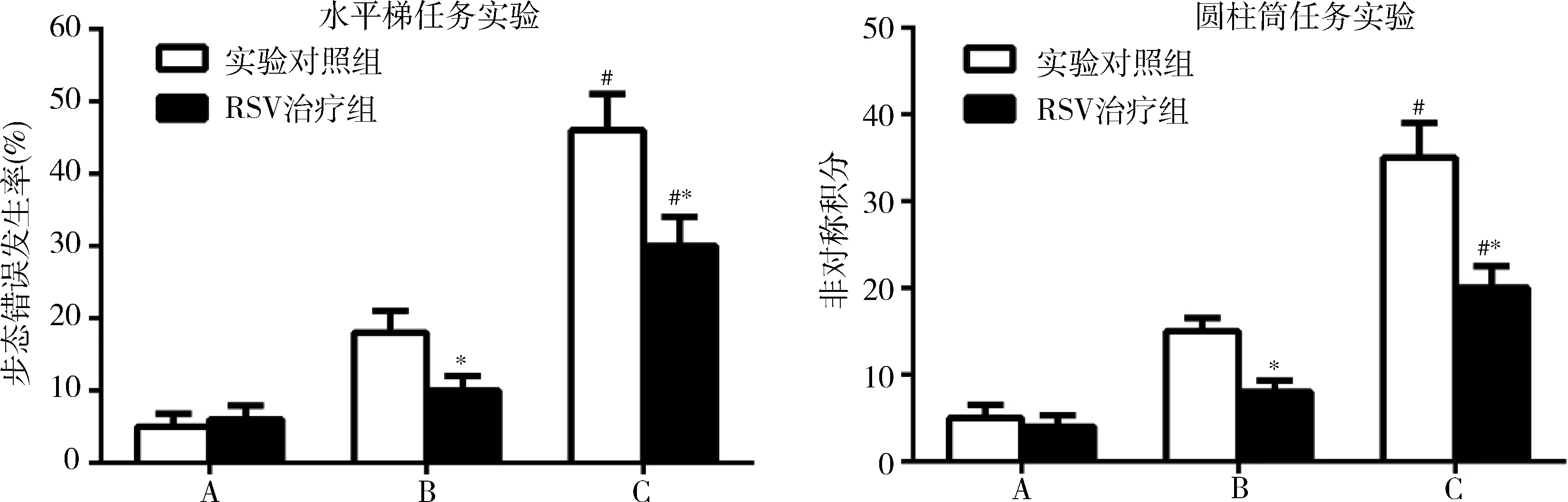
图1 RSV对MCAO大鼠行为学影响A.假手术组;B.单次MCAO组;C.双次MCAO组;与A比较,*P<0.05;与B比较,#P<0.05
3.RSV对MCAO大鼠脑梗死体积影响:TTC染色结果显示双次MCAO模型梗死体积显著大于单次MCAO模型。单次MCAO模型大鼠的梗死灶呈散在的点状分布,脑梗死体积较小,经过RSV处理后脑梗死体积显著变小,与对照组比较,差异有统计学意义(P<0.05)。双次MCAO模型大鼠皮质出现明显的大面积梗死,而经过RSV治疗的脑梗死体积显著变小,与对照组比较,差异有统计学意义(P<0.05),详见图2。
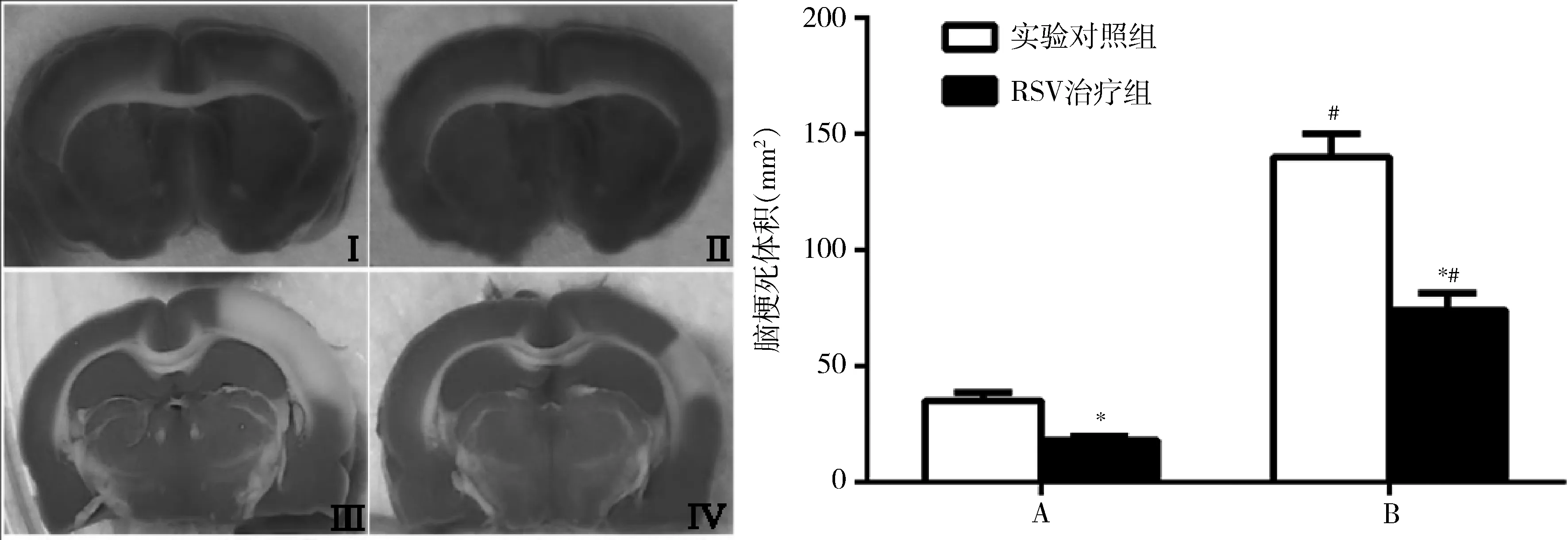
图2 RSV对单次和双次MCAO脑梗死体积影响Ⅰ.单次MCAO实验对照组;Ⅱ.单次MCAO RSV治疗组;Ⅲ.双次MCAO实验对照组; Ⅳ.双次MCAO RSV治疗组;A.单次MCAO组;B.双次MCAO组;与同组实验对照组比较,*P<0.05;与A比较,#P<0.05
4.RSV对复发脑缺血大鼠脑组织SIRT1活性和SIRT1蛋白表达影响:与实验对照组比较,假手术组、单次MCAO组和双次MCAO组经RSV治疗后SIRT1活性显著增加,差异有统计学意义(图3,P<0.05),而SIRT1蛋白表达差异无统计学意义(图4,P>0.05)。与假手术实验对照组比较,单次MCAO组SIRT1活性显著增加,差异有统计学意义(P<0.05),而双次MCAO组SIRT1活性差异无统计学意义(P>0.05)。
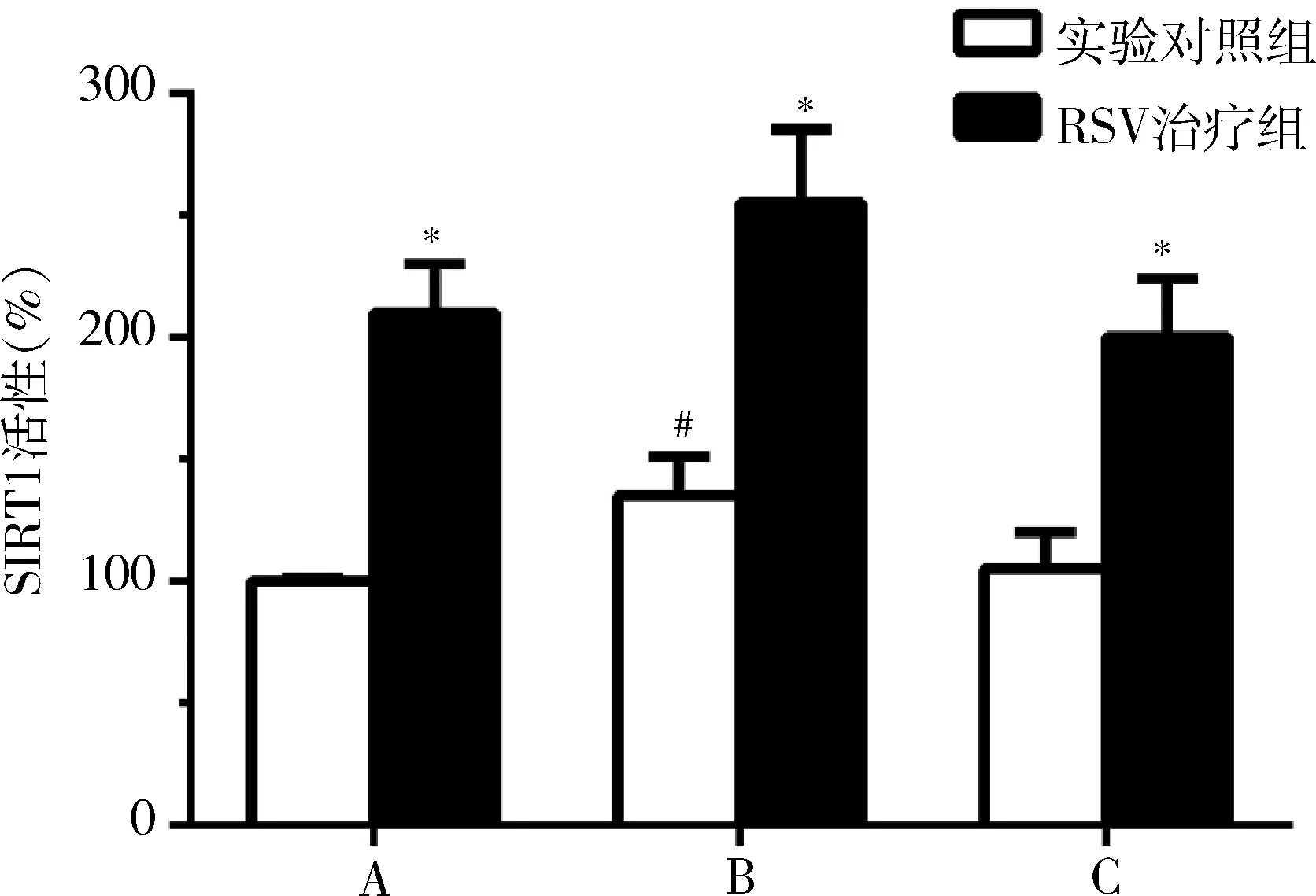
图3 RSV对各组SIRT1活性影响A.假手术组;B.单次MCAO组;C.双次MCAO组;与同组实验对照组比较,*P<0.05;与假手术实验对照组比较,#P<0.05
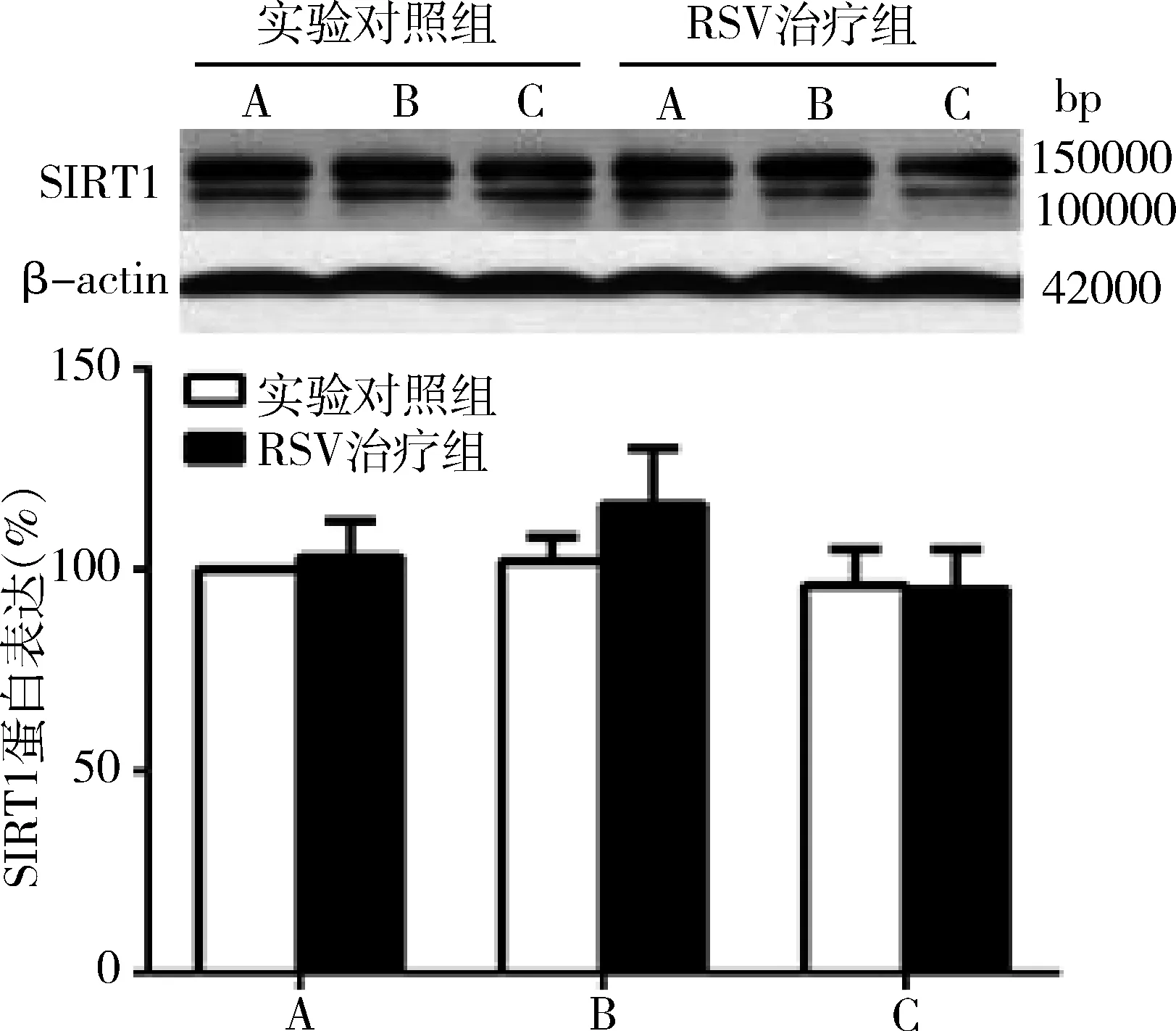
图4 RSV对各组SIRT1蛋白表达影响A.假手术组;B.单次MCAO组;C.双次MCAO组
5.RSV对复发脑缺血大鼠脑组织AMPK活性影响:本实验通过检测AMPK-Thr-172的磷酸化来检测AMPK活性。与实验对照组比较,RSV喂养后假手术组、单次MCAO组和双次MCAO组AMPK磷酸化显著增加(P<0.05)。与假手术实验对照组比较,单次MCAO组AMPK磷酸化显著增加(P<0.05),双次MCAO组AMPK磷酸化比较,差异无统计学意义(P>0.05),详见图5。
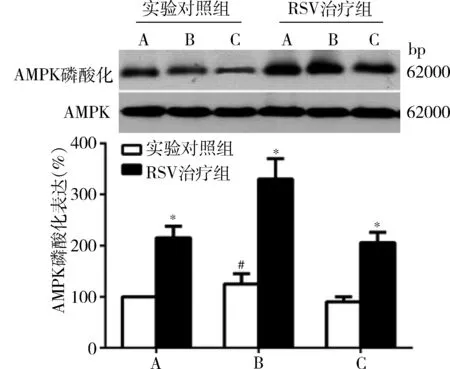
图5 RSV对各组AMPK磷酸化表达影响A.假手术组;B.单次MCAO组;C.双次MCAO组;与同组实验对照组比较,*P<0.05;与假手术实验对照组比较,#P<0.05
6.RSV对复发脑缺血大鼠脑组织ATP水平影响:与假手术实验对照组比较,单次和双次MCAO显著降低大鼠缺血脑组织ATP含量(P<0.05),双次MCAO后缺血脑组织ATP含量仅为假手术组的17%,RSV喂养后假手术组、单次和双次MCAO组大鼠缺血脑组织ATP含量显著增高(P<0.05),RSV使组织内ATP含量升高1.5~2.0倍,详见图6。
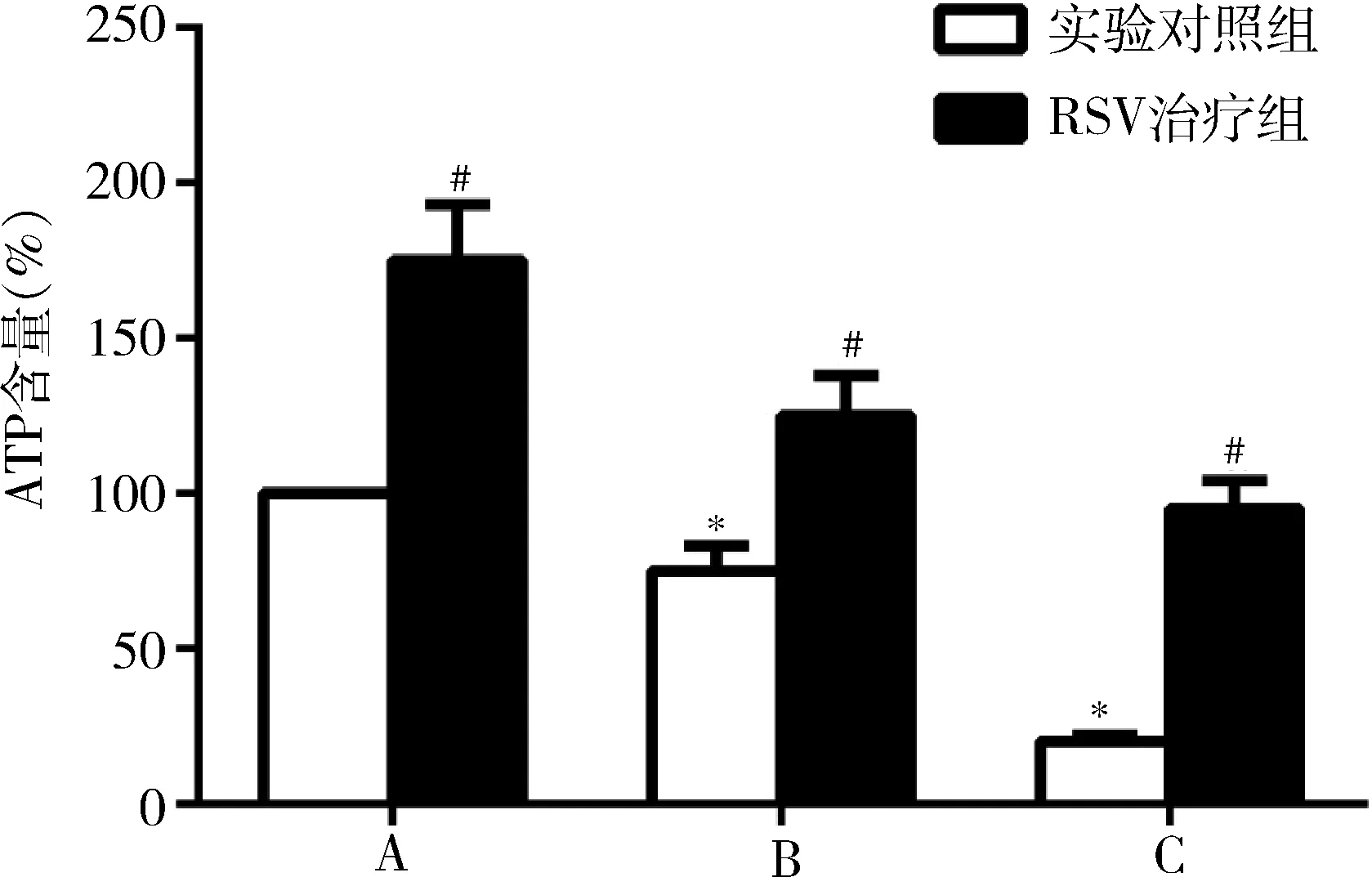
图6 RSV对各组ATP水平影响A.假手术组;B.单次MCAO组;C.双次MCAO组;与假手术实验对照组比较,*P<0.05;与同组实验对照组比较,#P<0.05
讨 论
约23%缺血性脑卒中发病前有短暂性脑缺血发作(transient ischemic attack, TIA)或小卒中(minor stroke)发作,约10.5%的反复脑卒中或TIA发作的患者是在首次发作后90天内出现双次发作,且50%的双次发作发生在首次发作后2天内[15,16]。因此在首次脑卒中发作后应用神经保护剂预防脑卒中复发导致的神经元损害非常重要。本研究参照Qiao等[9]的研究方法成功制备了复发缺血性脑卒中模型。
研究发现RSV具有抗氧化、抗炎、抗细胞凋亡等作用,对代谢、心血管和其他与年龄有关的并发症(包括神经变性和癌症)具有很强的保护作用[1, 2, 17]。但RSV对第1次小卒中或TIA发作后第2次脑卒中发作有无神经保护作用尚未见报道。AMPK是细胞内代谢传感器,能感知细胞内ATP∶ADP和ATP∶AMP的比值[18]。在缺血或缺氧的情况下,线粒体迅速停止产生ATP,AMP∶ATP的比值增加,从而促进AMPK的激活[19]。激活的AMPK可以促进细胞能量的产生和线粒体功能的发挥[20]。SIRT1是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的去乙酰化酶,NAD+是细胞呼吸和糖酵解所必需的关键代谢辅助因子,SIRT1催化NAD+生成烟酰胺。已研究表明SIRT1通过可增加Nrf 2蛋白的表达,提高线粒体抗氧化能力对脑缺血起到神经保护作用[21]。本研究旨在探讨RSV对复发大鼠缺血性脑卒中的神经保护功能,及其与SIRT1/AMPK信号通路的相关作用机制。
本研究双次MCAO较单次MCAO大鼠的梗死体积增大、步态错误和前肢非对称积分显著增高,提示双次MCAO大鼠的大脑皮质损害更严重。而RSV治疗可显著改善单次和双次MCAO大鼠的脑梗死体积及神经行为功能,说明RSV能够显著改善脑缺血导致的大鼠运动-感觉功能障碍,对复发缺血性脑卒中有显著的神经保护作用。本研究发现,RSV对单次MCAO和双次MCAO的大鼠缺血脑组织的SIRT1表达水平均无影响,但却显著提高SIRT1去乙酰化活性,起到正性调节作用,这可能与RSV作用于SIRT1蛋白的调节部位,增强酶的催化活性有关;也可能是RSV与SIRT1的某些部位结合使其构象发生改变,这种作用的机制需要进一步研究证实[22]。脑缺血后,缺血脑组织ATP含量降低,RSV可以增加大鼠缺血脑组织的ATP,上调AMPK磷酸化,从而激活下游PGC1α、MEF2、eNOS等,对缺血区脑血流的调节起保护作用。
综上所述,本研究发现RSV可改善复发MCAO大鼠行为功能、缩小脑梗死体积,对大鼠单次和双次MCAO模型均具有神经保护作用,其保护作用与提高SIRT1及AMPK活性和增加脑缺血时能量有关。同时笔者研究为复发缺血性脑卒中提供了动物模型,为复发缺血性脑卒中神经保护治疗提供新的药理学途径奠定基础。
