PD-1抑制剂Pembrolizumab联合培美曲塞治疗非小细胞肺癌的疗效观察
2019-08-12钱如林
冯 雨 崔 东 钱如林
肺癌是全球最常见的、对人类健康威胁最大的呼吸系统恶性肿瘤之一。原癌基因的激活或抑癌基因的失活,均可导致肺组织细胞无限增殖形成恶性肿瘤。癌细胞容易扩散到其他肺组织或身体远隔脏器,因此患者病死率高[1]。吸烟与肺癌的发生关系密切,长期大量吸烟者患肺癌的概率是不吸烟者的10~20倍,烟草中的致癌物能够诱发基因突变[2]。根据病理类型,肺癌可分为小细胞癌和非小细胞肺癌。非小细胞肺癌最常见,约占所有肺癌病例的80%~87%,病死率高达80%~90%,5年生存率仅为18.2%[3]。肺癌早期患者可采用根治性手术联合药物进行治疗,对于中、晚期患者,最好的方法是采用姑息化疗,在一定程度上缓解病情,改善生活质量,延长患者生命[4]。2016年美国食品药品监督管理局正式批准PD-1抑制剂Pembrolizumab用于一线治疗非小细胞肺癌[5]。有研究表明,Pembrolizumab联合标准化疗方案治疗非小细胞肺癌疗效可喜,且并无严重不良反应[6]。本研究采用Pembrolizumab联合培美曲塞和卡铂治疗非小细胞肺癌,旨在探讨其临床治疗效果及对患者血清肿瘤标志物CYFRA21-1、CEA及CA125水平的影响,现报道如下。
资料与方法
1.一般资料:选取笔者医院胸外科2015年3月~2016年7月收治的非小细胞肺癌患者114例,随机分为观察组(n=56)和对照组(n=58)。患者一般资料情况详见表1。两组患者在一般资料方面比较,差异无统计学意义(P>0.05),具有均衡性。本研究已通过笔者医院医学伦理学委员会批准,患者及家属均已签署知情同意书。
表1 患者的一般资料 [n(%)]
2.纳入排除标准:(1)纳入标准:①经病理学诊断确诊为非小细胞肺癌,TNM分期为ⅢB或Ⅳ期的患者;②接受过肺癌根治性手术治疗者;③患者及家属知情同意并配合治疗, 愿意接受随访。(2)排除标准:①曾接受过免疫调节剂治疗者;②对Pembrolizumab、培美曲塞等治疗药物不能耐受者;③合并其他恶性肿瘤、严重心脏、肝脏、肾脏疾病、血液系统疾病者;④妊娠或哺乳期妇女;⑤有认知功能障碍、存在精神异常的患者;⑥未按规定服用药物,不愿配合随访的患者。
3.治疗方法:对照组患者给予4周期培美曲塞(500mg/m2,第1天)和卡铂(AUC=5,第1天)静脉滴注治疗,每3周1次,培美曲塞单药维持治疗。观察组患者在此化疗基础上加用Pembrolizumab治疗,200毫克/次,每3周1次,共24个月。
4.观察指标及检查方法:观察并比较两组患者的血清肿瘤标志物CYFRA21-1、CEA及CA125水平,分别于治疗开始前,治疗第3、6、9、12周末的清晨抽取患者静脉血,3000r/min离心15min取血清,采用电化学发光法检测CYFRA21-1、CEA及CA125水平,仪器为瑞士Roche公司生产的E170系统,记录[7]。观察并比较两组患者完全缓解、部分缓解、疾病稳定、疾病进展情况,统计患者的中位反应时间和中位PFS时间,观察并记录患者的不良反应发生情况,计算不良反应发生率。

结 果
1.两组患者临床疗效比较:观察组部分缓解率为55.36%,远高于对照组29.31%,观察组临床疗效(有效率为87.50%)明显优于对照组(有效率为70.69%),两组比较差异有统计学意义(P<0.05),详见表2。

表2 两组患者临床疗效比较 [n(%)]
2.两组患者中位反应时间和中位PFS比较:观察组中位反应时间为1.7个月,低于对照组2.5个月(P=0.042);观察组中位OS为15.4个月,高于对照组7.6个月(P=0.034);观察组中位PFS为10.3个月,高于对照组4.2个月(P=0.012),详见表3、图1。
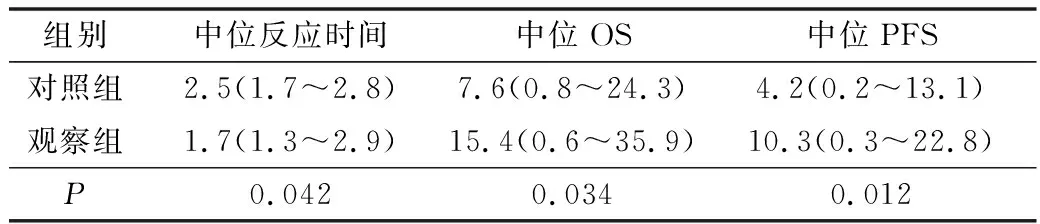
表3 两组患者中位反应时间和中位PFS比较(月)

图1 两组患者Kaplan-meire生存分析A.总生存期分析;B.无进展生存期分析
3.两组患者治疗前后CYFRA21-1、CEA、CA125水平比较:治疗前两组患者血清肿瘤标志物水平比较,差异无统计学意义(P>0.05);治疗后两组患者的CYFRA21-1、CEA、CA125水平均低于治疗前,且随着治疗时间的延长,CYFRA21-1、CEA、CA125水平呈下降趋势,治疗12周后,观察组CYFRA21-1、CEA、CA125水平分别为10.59±3.18ng/ml、11.65±4.82ng/ml、58.16±12.47U/ml,明显低于对照组15.26±4.73ng/ml、17.42±6.59ng/ml、65.34±11.52U/ml,差异有统计学意义(P<0.05),详见表4~表6。

表4 两组患者治疗前后CYFRA21-1水平比较
与治疗前比较,*P<0.05;与6周后比较,#P<0.05;与9周后比较,ΔP<0.05

表5 两组患者治疗前后CEA水平比较
与治疗前比较,*P<0.05;与6周后比较,#P<0.05;与9周后比较,ΔP<0.05

表6 两组患者治疗前后CA125水平比较
与治疗前比较,*P<0.05;与6周后比较,#P<0.05;与9周后比较,ΔP<0.05
4.两组患者不良反应比较:两组患者均出现贫血、中性粒细胞减少、急性肾损伤等不良反应,其中贫血发生率较高,观察组为10.71%,对照组为13.79%,其他不良反应发生率均低5%。观察组不良反应总发生率为30.36%,与对照组(29.31%)比较,差异无统计学意义(P>0.05)。联合组患者死亡1例(全血细胞减少),对照组死亡1例(败血症),详见表7。

表7 两组患者不良反应比较 [n(%)]
讨 论
肺癌在全球肿瘤中发生率和病死率均位列第1位,40%~70%的早期非小细胞肺癌患者经过根治性手术后仍发生远处转移[8]。目前临床常用的治疗药物有贝伐珠单抗、抗肿瘤血管生成药物、重组人血管内皮抑制素等,表皮生长因子受体酪氨酸激酶抑制药吉非替尼、阿法替尼等对EGFR过表达的患者反应性好,效果显著[9]。晚期肺癌患者受化学治疗不良反应的影响,免疫功能严重下降,有些患者因不能耐受而不得不放弃治疗。近年来,针对免疫检查点的单抗疗法(以PD-1/PD-L1为靶点的免疫治疗)表现出很好的效果[10]。阻断PD-1/PD-L1信号通路可改善肿瘤局部微环境,促进CD4+、CD8+T细胞的增殖,增强机体对肿瘤细胞的免疫杀伤力,从而抑制肿瘤生长[11]。Pembrolizumab是一种新型人源化单克隆抗体,高选择性地干扰PD-1和 PD-L1结合,从而提升免疫力,发挥抗肿瘤作用[12]。培美曲塞是一种含有吡咯嘧啶基团的抗叶酸制剂,通过破坏细胞内叶酸的代谢过程,抑制肿瘤生长[13]。培美曲塞在细胞内转化为多谷氨酸的形式,多谷氨酸是甘氨酰胺核苷酸甲酰转移酶和胸苷酸合成酶的抑制剂,它在肿瘤细胞内有时间-浓度依赖性,半衰期长,对肿瘤的作用时间也相应延长[14]。研究显示,培美曲塞体外可抑制间皮瘤细胞系MSTO-211H的生长,且培美曲塞与铂类联合有协同作用[15]。
血清肿瘤标志物CYFRA21-1、CEA、CA125与非小细胞肺癌的疾病进展及预后关系密切,肿瘤标志物水平升高提示预后差、生存时间短。CYFRA21-1是非小细胞肺癌病情检测最有价值的血清肿瘤标志物,主要分布在癌变的乳腺和肺上皮并释放入血[16]。CYFRA21-1是利用单克隆抗体检测细胞角蛋白的可溶性酸性蛋白,对非小细胞肺癌的疗效判断有重要的临床价值[17]。CEA是一类位于呼吸道、消化道等空腔脏器的酸性糖蛋白,由糖链和肽链组成,存在于巨噬细胞、单核细胞、多核细胞中,具有人类胚胎抗原决定簇,为特异性肿瘤相关抗原,与肿瘤复发有关[18]。CA125是一类肿瘤糖类抗原,在恶变组织和肿瘤细胞中浓度高,肿瘤组织遭到破坏时可释放入血,对非小细胞肺癌的诊断和预后有重要价值[19]。
本研究治疗前两组患者血清肿瘤标志物水平比较,差异无统计学意义(P>0.05);治疗后两组患者的CYFRA21-1、CEA、CA125水平均低于治疗前,且随着治疗时间的延长,CYFRA21-1、CEA、CA125水平呈下降趋势,治疗12周后,观察组CYFRA21-1、CEA、CA125水平分别为10.59±3.18ng/ml、11.65±4.82ng/ml、58.16±12.47U/ml,明显低于对照组(15.26±4.73ng/ml、17.42±6.59ng/ml、65.34±11.52U/ml),差异有统计学意义(P<0.05)。治疗后观察组患者的血清标志物CYFRA21-1、CEA及CA125水平低于治疗前,且比对照组降低更明显,提示Pembrolizumab联合培美曲塞和卡铂治疗非小细胞肺癌能有效缓解病情,效果显著,比单用培美曲塞及卡铂治疗效果更好。观察组部分缓解率为55.36%,远高于对照组29.31%,观察组临床疗效(有效率为87.50%)明显优于对照组(有效率为70.69%),观察组中位反应时间为1.7个月,低于对照组2.5个月,观察组中位PFS为12.8个月,明显长于对照组8.6个月,差异有统计学意义(P<0.05)。说明Pembrolizumab联合培美曲塞和卡铂治疗非小细胞肺癌能更有效地缩短反应时间,延长患者生存期。不良反应方面,两组患者均出现贫血、中性粒细胞减少、急性肾损伤等,但发生率均不高且患者可耐受。
综上所述,PD-1抑制剂Pembrolizumab联合培美曲塞和卡铂治疗非小细胞肺癌能明显降低血清肿瘤标志物CYFRA21-1、CEA及CA125的水平,并有效缓解病情,延长患者的生存时间,临床疗效显著,值得推广应用。本研究的样本量较小,临床上还需要大规模的试验来探讨其最佳用药剂量、不良反应发生情况等。期待研究者能充分利用现代技术,更系统、深入地研究免疫治疗与化疗药物之间的相互作用,推荐更优化的联合治疗方案应用于临床。
