SPOCK1在大肠癌组织中表达的研究
2019-08-12毕丹丹成秉林李宝华陈晓宇张淑君
毕丹丹 成秉林 李宝华 陈晓宇 张淑君
大肠癌(colorectal cancer,CRC)的发生率在恶性肿瘤中高居第3位,大肠癌患者死亡人数占所有恶性肿瘤死亡人数的8%左右,早期发现大肠癌的患者只占所有大肠癌总患病人数不到1%[1]。目前手术是结直肠癌的主要治疗手段,手术切除后的5年生存率平均可达40%~60%,然而术后的局部复发、远处的转移却成了大肠癌患者死亡的最主要原因[2]。因此,提高大肠癌预后效果的关键在于如何尽早发现、诊断大肠癌并对其开展规范化的手术治疗。
细胞外基质(extracellular matrix,ECM)是一种非细胞成分,存在于组织和器官中,蛋白多糖和纤维蛋白是其主要的两种分子成分。ECM中的大分子被肽酶分解,使其不断地处于动态的重塑状态,保持组织的分化和稳态。肽酶的异常改变以及ECM的分解与合成之间平衡的破坏,都可以使ECM的动态平衡发生明显的改变,进而导致肿瘤的发生。SPOCK1是一种由细胞产生并分泌到细胞间质中的ECM蛋白多糖,直接参与ECM的构成,同时也是新发现的钙离子结合蛋白多糖家族成员之一,对ECM的合成及积累起到了重要的调节作用,同时也可抑制肽酶的活性。近年来,因其具有促进肿瘤形成、抑制肿瘤凋亡、促进肿瘤侵袭和转移、调节ECM重构等生物学作用而备受关注与研究。
材料与方法
1.标本来源:收集2014年7月1日~2015年5月31日哈尔滨医科大学附属第四医院普外科手术切除的19例新鲜大肠癌组织及癌旁组织标本,每例标本取2块,将其中一块标本迅速放于-80℃冰箱中冻存,用于实时荧光定量PCR检测SPOCK1 mRNA;将另一块标本制成相应的石蜡标本。连同收集2007年7月1日~2012年2月28日病理科库存的大肠癌及其癌旁石蜡标本35例,共54例石蜡标本切片进行免疫组化。54例患者均出生于黑龙江省,其中男性33例(61.1%),女性21例(38.9%);患者年龄<60岁23例(42.6%),患者年龄≥60岁31例(57.4%);结肠癌41例(75.9%),直肠癌13例(24.1%);肿瘤直径<5cm 39例(72.2%),肿瘤直径≥5cm 15例(27.8%);大体类型为溃疡型42例(77.8%),隆起型10例(18.5%),平坦型2例(3.7%);组织学分级为低分化13例(24.1%),中分化35例(64.8%),高分化6例(11.1%);有淋巴结转移20例(37.0%),无淋巴结转移34例(63.0%)。所有患者均为首次发现,未接受过放疗和化疗,并且由资深病理医生进行病理诊断和分级,实验中标本均设相应的癌旁组织为对照。
2.主要试剂与仪器:主要试剂中Trizol购自上海TaKaRa公司,反转录试剂盒购自康为世纪公司,实时荧光定量PCR 试剂盒购自康为世纪公司,SPOCK1、GAPDH上下游引物由上海生工工程公司合成,兔抗人多克隆抗体SPOCK1购自武汉三鹰生物技术公司,抗兔二抗购自北京中杉金桥公司,DAB浓缩显色液购自北京中杉金桥公司。主要仪器中real-time-PCR仪产自上海罗氏制药有限公司,低温高速离心机产自德国Eppendorf公司,超净工作台产自美国Thermo公司,制冰机产自日本Sanyo公司。
3.SPOCK1 mRNA表达:采用实时荧光定量PCR方法检测大肠癌中SPOCK1 mRNA的表达。用Trizol分别提取19例新鲜组织标本中的总RNA,并反转录为cDNA。SPOCK1上游引物:5′-CAACTGCTTGTTCCCAGAGG-3′,下游引物:5′-GCCAATGACTTCCC TATCCA-3′,产物长度109bp;GAPDH 上游引物:5′-CAGGAGGCATTGCTG ATGAT-3′,下游引物:5′-GAAGGCTGGGGCTCAT TT-3′,产物长度为138bp。根据Ultra SYBR Mixture试剂盒操作说明书加样:加入2×Ultra SYBR Mixture为1×10-5L;加入上游引物,10μmol/L为5×10-7L;加入下游引物,10μmol/L 为5×10-7L ;加入Template DNA 为8×10-7L;加入RNase-Free Water 为8.2×10-6L。反应体系为20μl,35~40个循环,预变性95℃ 10min;变性95℃ 15s;退火/延伸 60℃ 1min;溶解曲线分析95℃ 15s、60℃ 1min、95℃ 15s、60℃ 15s。采用2-△△Ct分析法,Ct值是每个反应管里的荧光信号达到所设定域值经历的循环数,按照公式计算,扩增的GAPDH作为内参,将每个分组都设为3个复孔。△Ct=Ct平均值(目的基因)-Ct平均值(内参);△△Ct=△Ct实验组-△Ct空白对照组。
4.免疫组织化学检测SPOCK1蛋白表达:54例大肠癌石蜡标本采用免疫组织化学SP法检测大肠癌SPOCK1蛋白的表达。标本经中性甲醛溶液固定,石蜡包埋,制成4μm组织切片。经脱蜡、梯度水化后采用柠檬酸高温高压修复4min,放至室温。在3%H2O2中常温孵育0.5h,目的是将内源性过氧化物酶的活性消除。非特异性抗原被山羊血清封闭0.5h之后,滴入1∶100比例的兔抗人多克隆抗体SPOCK1,放入4℃湿盒中过夜。用磷酸盐缓冲液(PBS)冲洗3min×3次。在抗兔二抗工作液37℃中孵育0.5h,用PBS溶液冲洗3min×3次。最后用DAB进行显色、苏木素进行复染、中性树胶进行封片。
5.免疫组化结果判定标准:SPOCK1表达阳性的染色反应呈现棕黄色,随机抽取5个高倍镜视野。A:计算阳性细胞占肿瘤细胞的百分比,阴性计0分,0~10%计1分,11%~50%计2分,51%~80%计3分,80%~100%计4分。B:按高比例阳性表达细胞所呈现染色强度进行计分,阴性的计0分,弱阳性的计1分,阳性的计2分,强阳性的计3分。根据阳性表达的细胞数和着色的强度得出综合性的判断,两者相乘计分,乘积结果分别为0、1、2、3、4、6、9、12分,其中0~2分计为SPCOK1蛋白阴性表达,≥3分计为SPOCK1蛋白阳性表达。
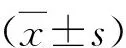
结 果
1.SPOCK1 mRNA表达:SPOCK1 mRNA在大肠癌组织中表达明显上调,与癌旁组织比较,差异有统计学意义(P<0.05),详见图1。
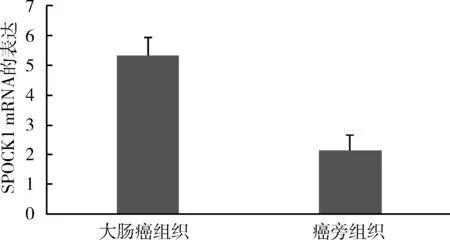
图1 SPOCK1 mRNA在大肠癌与癌旁组织中的表达
2.SPOCK1蛋白表达:SPOCK1属于分泌型蛋白,其分泌到细胞间质中参与ECM的构成,主要表达于胞质, 阳性染色为棕黄色,呈颗粒状(图2)。54例大肠癌标本中SPOCK1蛋白的表达水平显著升高,与正常组织中的表达比较,差异有统计学意义(P<0.05,图3)。并且SPOCK1的阳性表达和大肠癌组织学分级呈正相关,差异有统计学意义(P<0.05);而与年龄、性别肿瘤部位、肿瘤直径、大体类型、淋巴结转移、浸润深度、远处转移无关,差异无统计学意义(P>0.05,表1)。
图2 SPOCK1免疫组化染色A.SPOCK1在大肠癌组织中表达(×100);B.SPOCK1在大肠癌组织中的表达(×400);C.SPOCK1在癌旁组织中表达(×100);D.SPOCK1在癌旁组织中表达(×400)
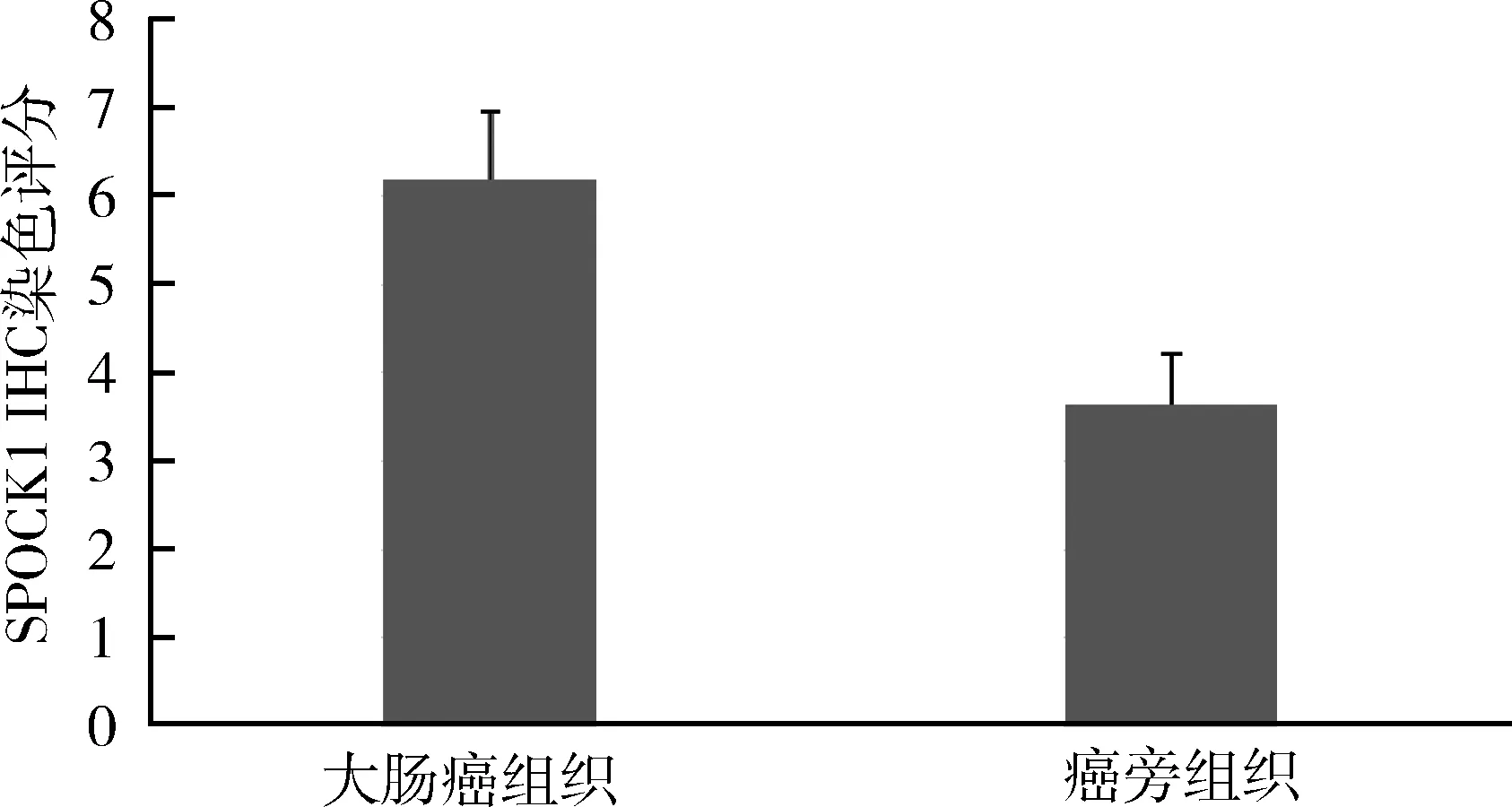
图3 SPOCK1蛋白在大肠癌与癌旁组织中的表达
表1 SPOCK1阳性着色和临床病理学资料关系
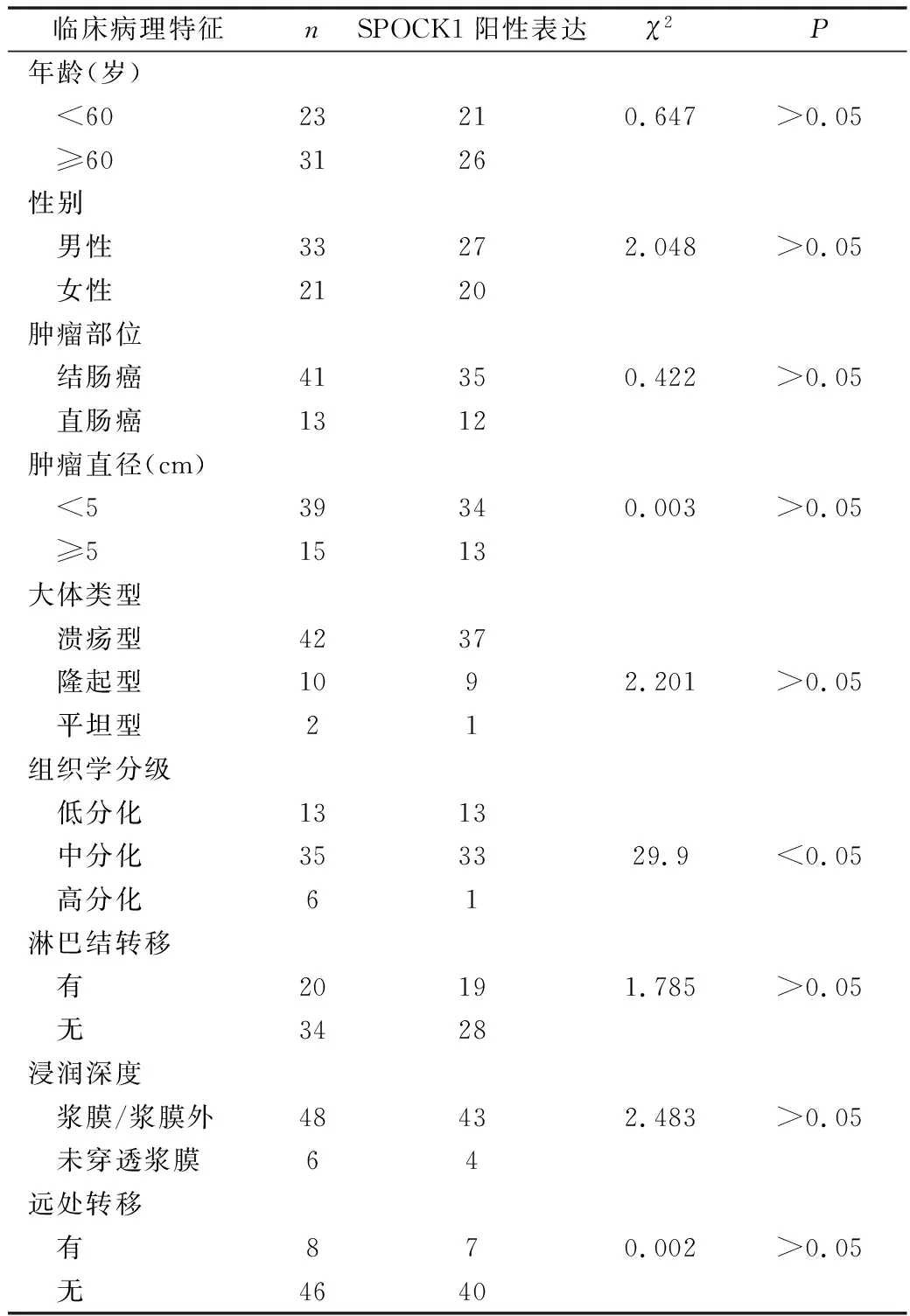
临床病理特征nSPOCK1阳性表达χ2P年龄(岁) <6023210.647>0.05 ≥603126性别 男性33272.048>0.05 女性2120肿瘤部位 结肠癌41350.422>0.05 直肠癌1312肿瘤直径(cm) <539340.003>0.05 ≥51513大体类型 溃疡型4237 隆起型1092.201>0.05 平坦型21组织学分级 低分化1313 中分化353329.9<0.05 高分化61淋巴结转移 有20191.785>0.05 无3428浸润深度 浆膜/浆膜外48432.483>0.05 未穿透浆膜64远处转移 有870.002>0.05 无4640
3.SPOCK1蛋白的表达与大肠癌临床病理学参数的关系:SPOCK1表达阳性率在低分化大肠癌组织中为100%(13/13),在中分化组织中为94.3%(33/35),在高分化组织中为16.7%(1/6),差异有统计学意义(χ2=29.9,P<0.05),详见表1。
讨 论
许多恶性肿瘤患者术后无法达到很好的预后效果,甚至出现死亡的原因是肿瘤细胞具有转移和侵袭能力。肿瘤细胞的侵袭和转移会经历以下几个步骤:肿瘤细胞之间黏附性改变,使原发灶脱落,脱落的肿瘤细胞分泌酶降解并穿过ECM屏障,侵入淋巴管和血管,并随着血流在周围组织或远端器官中建立新的肿瘤细胞集落[3]。因此在肿瘤侵袭和转移过程中,ECM屏障被降解是重要步骤,只有ECM屏障被降解,肿瘤细胞才能侵入血管,随着血流转移到其他器官[4]。
SPOCK1是一种ECM蛋白多糖,SPOCK1蛋白的发现是研究者提取睾丸精液中94000的蛋白多糖,为了检测其主要成分,却无意中发现了一个序列,命名为testican,而后改名为SPOCK1。编码此蛋白的SPOCK1基因定位于人染色体5q31区域,含硫酸软骨素链及硫酸乙酰肝素链,其mRNA 长度为5kb,包含12 个外显子,开放阅读框架长1.3kb, 3′端非编码区长达3.3kb,约为其他基因非编码区的4倍,并编码SPOCK1蛋白的439个氨基酸残基。SPOCK1的同源基因为SPOCK1,含有6个功能区域,部分区域能抑制蛋白酶活性。研究表明其第3号外显子可以被选择性地分解,从而发挥特定的靶向功能。SPOCK1同时又属于钙离子结合蛋白多糖家族的成员,共同特点是有着相似的N端、C端和含有卵泡素样结构的区域,并参与细胞的增殖、黏附及转移。蛋白多糖家族除了SPOCK1之外还包括SPARC、testican-2及testican-3。
近期研究发现,SPOCK1不仅在食管鳞状细胞癌、胆囊癌、肝癌、肺癌及胰腺癌中有高表达,而且其表达的程度也与肿瘤的组织学分级、淋巴结转移及患者的短期存活时间有明显的相关性。特别要强调的是,经统计学分析证实,SPOCK1不仅可以作为胆囊癌患者的一个预后指标,也可以对胰腺癌和肝癌的预后起到一定的参考价值[5,6]。研究发现,SPOCK1在前列腺癌中表达量较高,特别在已经出现转移的情况下癌组织SPOCK1表达量更高;同时研究发现SPOCK1能促进前列腺癌的增殖,抑制其凋亡,在胶质母细胞瘤、肝癌、尿路上皮癌、卵巢癌的侵袭和转移中也能发挥一定的促进作用[7~13]。此外,研究表明SPOCK1的高表达会影响胰腺癌及乳腺癌的预后[14~16]。
本研究通过荧光定量PCR检测到SPOCK1基因在癌变组织中的表达明显高于正常组织中,同时应用IHC检测到大肠癌中SPOCK1蛋白也同样高表达,表明SPOCK1也许能促进大肠癌的发生、发展。经进一步研究发现,SPOCK1明显和大肠癌的组织学分级呈正相关。虽然在研究SPOCK1与大肠癌患者临床特征中,SPOCK1和淋巴结转移相关性不明显(P=0.915),但是考虑到纳入研究的标本量有限,提高研究的标本量或许能有新的发现。SPOCK1作为分泌型蛋白,可以在组织中被灵敏的检测出来,SPOCK1或许可以作为大肠癌早期检测的生物学标志物。笔者下一步重点要研究SPOCK1在大肠癌中是如何发挥促进肿瘤形成、抑制肿瘤凋亡作用的。
