Flic对低剪切力所致动脉粥样硬化的影响
2019-08-12石润竹于江波杨树森
石润竹 王 鑫 陈 浩 于江波 董 国 杨树森
动脉粥样硬化是冠心病的病理基础,以血管壁进行性的炎性反应导致动脉壁增厚和动脉硬化斑块的形成[1]。以血管内脂质、纤维成分堆积、管腔狭窄为主要特征,是多种心血管不良事件的主要原因[2]。慢性炎症是冠心病的典型标志,该慢性炎性反应涉及先天性和适应性免疫应答[3]。其发病机制一直未能完全阐明。近年来对于动脉粥样硬化的免疫机制研究取得了很大进展,研究发现单核-吞噬细胞介导的天然免疫及T细胞介导的适应性免疫应答与动脉粥样硬化关系密切,调节相关免疫应答可能是抑制诱导动脉粥样硬化斑块形成及斑块稳定性破坏的炎症关键,这些因素可能是动脉粥样硬化发生、发展的免疫基础[4]。
鞭毛蛋白Flic是沙门菌鞭毛的主要成分,作为重要的免疫调节剂Flic蛋白有很强的抗原性,参与机体免疫应答过程。鞭毛蛋白可以与表达于上皮细胞、单核细胞和未成熟的树突状细胞顶端和基底外侧的TLR5受体结合,触发炎性因子和趋化因子分泌,介导激活T细胞和B细胞应答[5]。因而被广泛用作疫苗的佐剂以及治疗肠道感染[6]。然而,Flic蛋白发挥的免疫调节作用能否影响动脉粥样硬化过程尚无报道。因此,本研究对动脉粥样硬化动物模型注射Flic蛋白,评价Flic蛋白对动脉粥样硬化的作用及机制,旨在证实Flic蛋白是否可以通过免疫调节作用抑制动脉粥样硬化的发生、发展。
材料与方法
1.实验动物分组与建模:选取雄性新西兰大耳白兔18只,体重2.0~2.5kg,随机分为3组,即对照组(Con组,n=6)、低剪切力组(LSS组,n=6)、低剪切力+Flic注射组(Flic组,n=6)。Con组不做处理,不予高脂饮食,为空白对照。LSS组采用颈动脉套管联合高脂饮食法建立动脉粥样硬化模型:3%戊巴比妥钠经耳缘静脉注射麻醉(30mg/kg),颈正中切开皮肤表面,钝性分离动脉周围组织,暴露右侧颈动脉约2~3cm,使用硅胶套管(长1.0cm、内经1.5mm、外径2.0mm)套扎于动脉表面,硅胶管使用手术缝合线固定,确认套扎颈动脉通畅后,缝合皮肤。术后第3日开始高脂饮食8周(高脂饮食配制比例为1.5%胆固醇+10.0%猪油+7.5%蛋黄粉+81.0%基础饲料组成)。Flic组:建立动脉粥样硬化模型与LSS组相同,术后第3日开始Flic蛋白100μg皮下注射(GenbankAY353373.1,哈尔滨兽医研究所细菌室赠予),每周1次,共8周。
2.彩色多普勒超声检查:分别在实验开始前(第0周)及第8周后进行彩色多普勒超声检查(PHILIPS IE-33)。高频血管探头(15MHz)检查右侧颈动脉。测量右侧颈动脉收缩期峰流速(cm/s)、舒张期峰流速(cm/s)及阻力指数RI值,观察套管两端血管内壁有无毛糙、有无动脉粥样硬化斑块及斑块面积(mm2)。
3.血浆IFN-γ和IL-4水平测定:第10周(LSS组及Flic组停用高脂饮食2周后),采空腹静脉血,1000×g4℃离心15min,取上清液,应用ELISA法检测血浆IFN-γ和IL-4水平,根据ELISA试剂盒(上海康朗公司)说明书操作步骤操作。制作标准曲线后计算IFN-γ和IL-4水平。
4.颈动脉组织形态学观察:第10周(LSS组及Flic组停用高脂饮食2周后),采用空气栓塞法处死动物,取套管段近心端5mm范围内颈动脉,10%甲醛固定,石蜡制片,切片,HE染色,光镜下观察形态学变化。

结 果
1.动物情况:第0周及第10周对各实验组进行称重,Con组体重由2.28±0.06kg增加到3.10±0.09kg,LSS组体重由2.30±0.04kg增加到3.37±0.07kg,Flic组体重由2.35±0.04kg增加到3.25±0.07kg。3组间动物体重增加值比较,差异无统计学意义(P>0.05)。
2.超声评价动脉粥样硬化:第0周各组管腔无狭窄,无动脉粥样硬化斑块。第8周,Con组管腔无狭窄,无动脉粥样硬化斑块形成。与Con组比较,Flic组和LSS组动脉血管狭窄程度、阻力指数RI值及斑块面积均明显增加;与LSS组比较,Flic组动脉血管狭窄率、阻力指数RI值及斑块面积大小明显较小,差异有统计学意义(P<0.05,表1,图1)。
与Con组比较,*P<0.05;与LSS组比较,#P<0.05
3.HE染色结果:光镜下,Con组无明显动脉粥样硬化斑块,内膜无增厚。与Con组比较,LSS组血管内膜明显增厚,内膜大量平滑肌细胞增殖,内有大量泡沫细胞沉积,细胞排列紊乱,斑块面积明显增加。与LSS组比较,Flic组血管内膜增厚程度及内膜平滑肌细胞增殖和泡沫细胞沉积较轻,斑块面积明显减小(图2)。
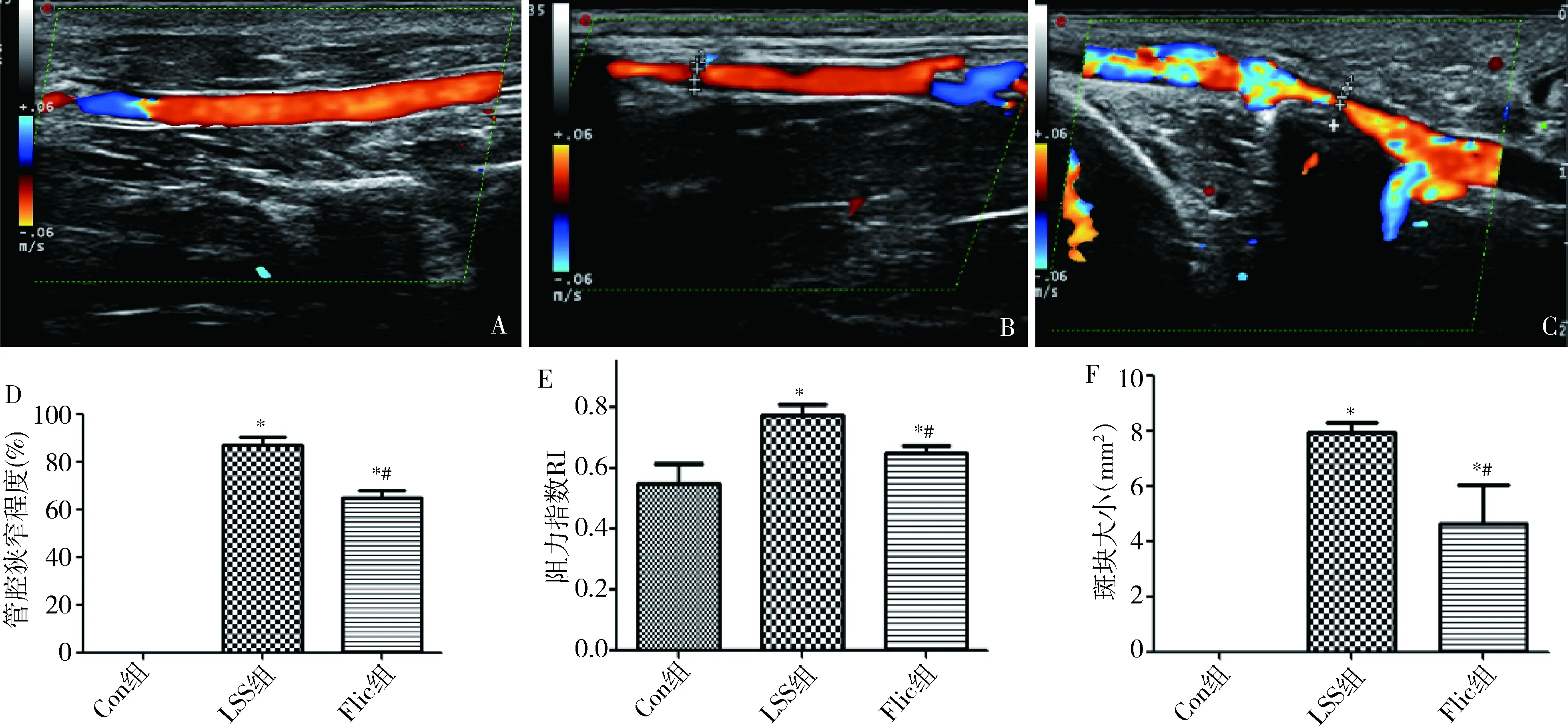
图1 各组实验动物彩超图像及LSS组和Flic组血管狭窄程度、阻力指数RI值及斑块面积A.Con组;B.LSS组;C.Flic组;D.管腔狭窄程度(%);E.阻力指数RI值;F.斑块面积(mm2);与Con组比较,*P<0.05;与LSS组比较,#P<0.05

图2 HE染色结果(×10)A.Con组;B.LSS组;C.Flic组;D.斑块与管腔面积比(%);与Con组比较,*P<0.05;与LSS组比较,#P<0.05
4.血清细胞因子水平结果:与Con组比较,Flic组和LSS组血清中Th1细胞代表性细胞因子IFN-γ水平明显升高(P<0.05),Th2细胞代表性细胞因子IL-4水平明显降低(P<0.05),IFN-γ/IL-4比值升高(P<0.05);与LSS组比较,Flic组Th1细胞代表性细胞因子IFN-γ水平明显降低(P<0.05),Th2细胞代表性细胞因子IL-4水平明显升高(P<0.05),IFN-γ/IL-4比值明显降低,差异有统计学意义(P<0.05,表2、图3)。

表2 各组血清细胞因子水平
与Con组比较,*P<0.05;与LSS组比较,#P<0.05
讨 论
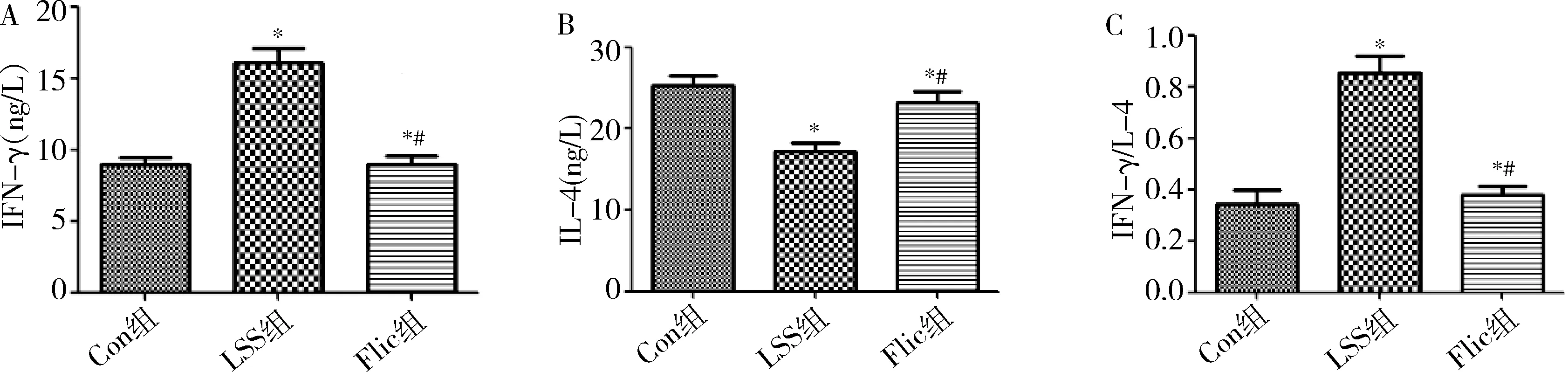
图3 各组实验动物血清细胞因子的比较A.各组血清细胞因子IFN-γ水平;B.各组血清细胞因子IL-4水平;C.IFN-γ/IL-4;与Con组比较,*P<0.05;与LSS组比较,#P<0.05
动脉粥样硬化是多因素参与的复杂病理过程,除高血压、高血脂、糖尿病、吸烟等传统危险因素外,剪切力被认为与动脉粥样硬化关系同样密切,其不但能够决定斑块的分布位置,更是动脉粥样硬化发生、发展的重要机制之一。壁面剪切应力可以调节冠状血管内皮功能,血液对血管壁施加的摩擦力可以帮助解释冠状动脉粥样硬化的斑块发展[7]。研究证实,湍流形成的低剪切力(<4dynes/cm2)具有促动脉粥样硬化的作用,层流形成的高剪切力(10~70dynes/cm2)则具有抗动脉粥样硬化的作用[7]。在冠脉分叉处,由于分叉导致了明显的速度降低和回流形成降低了剪切应力,导致剪切应力小于1~2Pa,研究表明,壁面剪切力应低于1.2Pa或者震荡剪切力指数>0.3的区域动脉粥样硬化斑块发生风险更大[8]。本研究利用动脉套管法改变血管局部血流状态及剪切力大小建立动脉粥样硬化模型。超声检测结果显示,与Con组比较,LSS组动脉套管远心端血管管腔内血液呈湍流。高脂饮食8周后,套管远心端血管管腔狭窄程度、阻力指数RI值及斑块面积均明显增加,提示套管法使局部形成低剪切力进而导致了局部AS的形成。
研究发现,动脉粥样硬化是一种免疫相关性疾病,天然免疫和获得性免疫在动脉粥样硬化发生、发展过程中均起重要作用[1]。动脉粥硬化是一个包含强烈炎性反应的复杂过程,研究显示巨噬细胞和T细胞的丰富程度与斑块进展存在正相关,除降脂之外,抗炎治疗对进一步减少心血管事件不可或缺[9]。T细胞是最早被募集并参与动脉粥样硬化适应性免疫应答的淋巴细胞。T细胞由多种细胞亚群组成并分泌大量极具功能的细胞因子[2]。IFN-γ作为Th1分泌的代表性细胞因子,具有很强的促动脉粥样硬化作用。
IFN-γ能够活化单核-吞噬细胞和树突状细胞来维持Th1细胞的促进动脉粥样硬化效应,并可以通过活化这些细胞来抑制血管平滑肌细胞增殖和减少胶原纤维合成,促使纤维帽变薄[2]。表达p-选择素糖蛋白配体-1(PSGL-1)的CD4 T细胞促进急性冠脉综合征中斑块不稳定性,从而导致心血管不良事件发生[10]。同时,Chen等[11]在研究白细胞计数与冠状动脉疾病(CAD)关系中发现,CAD患者细胞毒性T细胞自然杀伤细胞水平显著降低。最近证据表明循环CD4+CXCR5+T细胞可以促进炎性反应,导致动脉壁增厚,促进炎性反应,CAD患者的CD4+CXCR5+T细胞比正常对照组分泌着更多的IFN-γ、IL-17A、IL-21[1]。
本研究结果表明,与Con组比较,LSS组细胞因子IFN-γ水平明显升高,提示Th1细胞活化,参与低剪切力致动脉粥样硬化过程。Th2在动脉粥样硬化中的作用具有两面性,依据斑块位置、Th2细胞所处阶段及其分泌细胞因子种类和动脉粥样硬化模型的不同而作用不一。本研究发现,与Con组比较,LSS组Th2代表性细胞因子IL-4水平明显降低。提示低剪切力致动脉粥样硬化过程中,Th2细胞活化参与免疫应答。
鞭毛蛋白Flic是一种蛋白性的病原相关分子模式(pathogen-associated molecular patterns, PAMP),是沙门菌鞭毛的主要成分,可被TLR5为主的模式识别受体(PRR)识别,作用于表达TLR5的靶细胞,并通过活化MyD88依赖的信号通路,调控IFN-γ、TNF-α、IL-6和IL-12等促炎细胞因子的合成,上调协同刺激分子CD80、CD86以及MHC Ⅱ分子,使抗原递呈细胞激活和成熟,摄取抗原能力增强,向引流淋巴结迁移能力增强,从而募集、激活和分化Th细胞,最终启动获得性免疫应答;亦可通过激活TLR5下游信号通路IRAK-TRAF6复合体和NF-κB来诱导炎性反应,进而调节Th1、Th2、Treg细胞以及IFN-γ、IL-4和IL-12等细胞因子发挥作用[6]。然而,Flic蛋白能否通过调控Th1/Th2及相关细胞因子影响动脉粥样硬化的发生、发展鲜有报道。
本研究发现,与LSS组比较,Flic组动脉粥样硬化明显减轻,Th1细胞代表性细胞因子IFN-γ水平降低,Th2细胞代表性细胞因子IL-4水平升高,IFN-γ/IL-4比值明显降低。提示Flic蛋白可能通过调控Th1/Th2抑制低剪切力致动脉粥样硬化过程。这与以往的研究相类似,Didierlaurent等[12]及Cunningham等[13]研究发现,重组可溶性Flic蛋白和聚合Flic蛋白均对Th2的分化有强烈的刺激作用。而以往关于Flic影响Th1的研究结果却与本研究不完全相同。McSorley等[14]在小模型研究中发现,Flic蛋白可以促进OVA323~339特异性Th1型CD4+T细胞的分化。Means等[15]的研究并不支持这些观点,他们认为Flic蛋白激活人类DCs并不产生IL-12p70,进而对Th1细胞反应无明显影响。相同的情况在动物模型中也有体现,Bobat等[16]研究发现,重组的Flic蛋白能够引起小鼠IL-4 mRNA及蛋白表达增加,但对IFN-γ无影响。这些结论的得出可能模型的选择,尤其是Flic蛋白种类、应用时间和剂量等因素有关。
近年来,关于Flic蛋白通过调节细胞和体液免疫影响动脉粥样硬化的研究正逐渐成为热点。虽然多项研究中Flic蛋白对动脉粥样硬化的影响不尽相同,具体作用与机制还有待于进一步验证与阐明,但“以菌治病”将可能成为抗动脉粥样硬化治疗的新方向。
