合成ε-己内酯相关体系气液平衡数据的测定与关联
2019-08-12石楷华张光旭
石楷华,张光旭,丁 榕,杨 洁
(武汉理工大学 化学化工与生命科学学院,湖北 武汉 430070)
ε-己内酯是一种重要的化学合成中间体,主要用于合成聚己内酯或与其他酯类共聚或共混改性,其中聚己内酯具有良好的生物相容性和生物降解性,以及良好的渗透性,在医药、涂料、生物降解、包装材料等领域具有广泛的应用。根据氧化剂的不同,合成ε-己内酯的方法主要有过氧酸氧化法和双氧水氧化法、空气/氧气氧化法等[1-4]。在原料的选用上主要有环己酮氧化法、环己醇氧化法、己二酸环化法等。本课题组已经探索出过氧酸和双氧水氧化环己酮法合成ε-己内酯的适宜反应条件并制备出较理想的催化剂[5-6]。为了在合成ε-己内酯的产物分离过程中获得温度、压力与组成之间的关系,则需要通过对反应物与产物之间的多元平衡体系进行数据测定,从而得到合适的相平衡模型,而ε-己内酯、乙酸、环己酮等物质作为反应过程中的主要组成物质,气液平衡数据必不可少[7]。关于ε-己内酯-环己酮、乙酸-环己酮等二元体系的气液平衡数据尚未见文献报道。
本工作采用校核后的Rose气液平衡釜,在20 kPa和30 kPa下测定了ε-己内酯-环己酮、乙酸-环己酮二元体系的气液平衡数据并对其进行关联,为后续工业化设计提供了参考数据。
1 实验部分
1.1 实验试剂
环己酮、乙酸、1,4-二氧六环(99.0%(w)):分析纯,国药集团化学试剂有限公司。依据沸点与溶解度选择1,4-二氧六环作为色谱定量分析中的内标物,使用时均为原始材料,未进行预处理。所有试剂的物理性质及常用数据见表1。
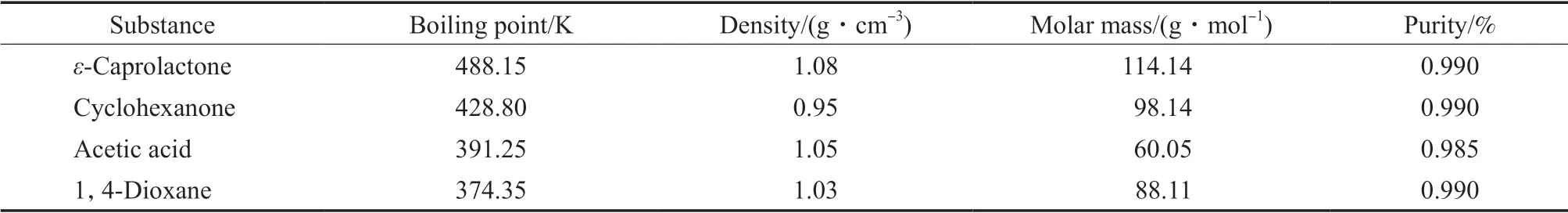
表1 纯物质的物性常数[8-9]Table 1 Physical properties of pure components[8-9]
1.2 实验仪器及步骤
采用Rose气液平衡釜(见图1)进行气液平衡数据的测定。将一定配比的待测溶液混合均匀后倒入釜内,调节加热电压使温度上升至溶液稳定循环回流,同时打开真空泵使系统压强达到设定压力值,当回流液滴流速约为每分钟30滴且体系温度稳定时,可认为气液两相达到平衡。用两只取样针分别取样0.2 mL置于离心管中待分析。

图1 Rose气液平衡釜Fig.1 Rose vapor-liquid equilibrium still.
用测温计,配套使用数字温度仪来显示平衡温度,偏差为0.1 K;通过真空泵以及缓冲罐配套装置维持系统压力,误差为0.1 kPa;采用Agilent公司GC-6890N型气相色谱仪对实验试样进行定量分析,HP-5型毛细管色谱柱(30 m×0.32 mm×0.25 μm),氢火焰离子化检测器。
1.3 实验装置的可靠性检验
为保证实验数据的可靠性,在常压下测定了乙酸乙酯-异丙醇二元体系的气液平衡数据,并将实验值与文献值对比,实验值与文献值吻合良好,说明可以采用此实验装置进行气液平衡数据的测定[10]。
1.4 分析方法
利用气相色谱仪分别对试样组分含量进行定量分析[11]。分析条件为:载气N2,流量30 mL/min,H2和空气的流量分别为30,300 mL/min;柱箱温度353 K,进样器温度523 K,每次进样0.2 μL。
气相色谱的定量分析方法主要有归一化法、外标法和内标法等[12-13]。由于本工作采用的气相色谱仪进样方式为手动进样,虽然保持每次进样体积相同,但是不可避免会产生人为误差导致的峰面积偏差从而对组分含量的分析造成影响,因此选用内标法。在内标物的选择过程中需遵循几点要求:1)内标物必须完全溶于待测体系,且与待测体系中各组分的色谱峰完全分离。2)内标物必须是待测体系中不存在的物质。3)内标物色谱峰的位置与组分的色谱峰位置相近且不受其他组分峰的影响。因此,选用1,4-二氧六环作为ε-己内酯-环己酮、乙酸-环己酮二元体系的内标物,配制不同浓度的某组分与内标物的混合液可得到待测组分与内标物的峰面积比与含量之间的关系,即校正方程。
2 结果与讨论
2.1 气液平衡数据
在20 kPa和30 kPa下,气相可视为理想气体,气液相组成之间的关系见式(1)。

式中,p为体系总压力,kPa;i表示组分;yi为气相摩尔分数;xi为液相摩尔分数;γi为活度系数;pis为组分i的饱和蒸气压,kPa。由Antoine方程计算得到纯物质的饱和蒸气压,Antoine常数见表2。气液平衡数据与活度系数见表3和表4。
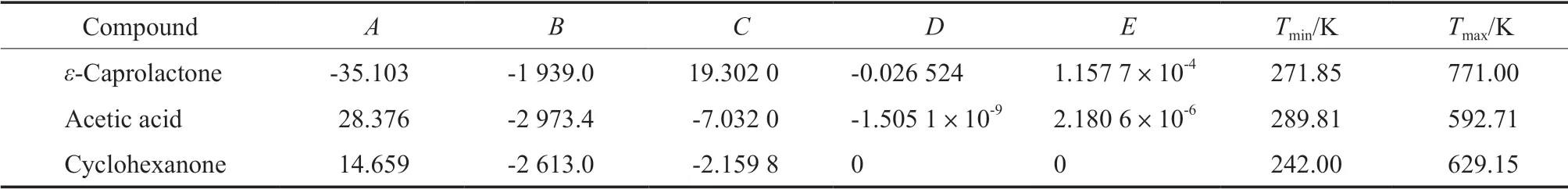
表2 乙酸与环己酮的Antoine方程参数Table 2 Antoine constants of acetic acid and cyclohexanone

表3 乙酸(1)-环己酮(2)气液平衡数据Table 3 Experimental vapor-liquid equilibrium data for acetic acid(1)-cyclohexanone(2)
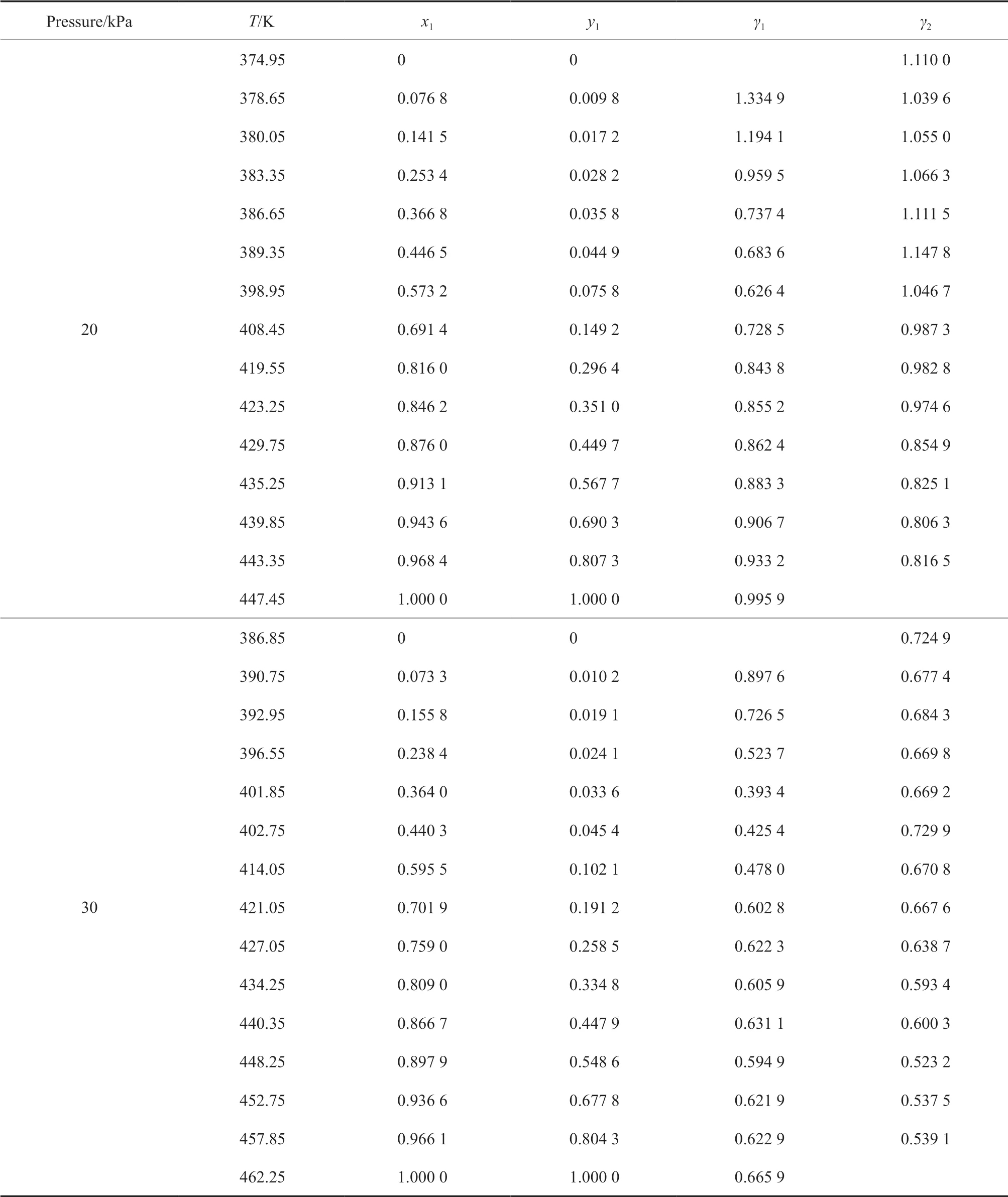
表4 ε-己内酯(1)-环己酮(2)气液平衡数据Table 4 Experimental vapor-liquid equilibrium data for ε-caprolactone(1)-cyclohexanone(2)
2.2 热力学一致性检验
气液平衡数据的热力学一致性主要是通过Gibbs-Duhenm方程的活度系数来检验,采用半经验方式的Herington面积积分法表示气液两部分组成[14]。表5为热力学一致性检验结果。其中,D和J的计算见式(2)。由表5可知,D-J<10,说明实验数据可靠,所测气液平衡数据符合热力学一致性。

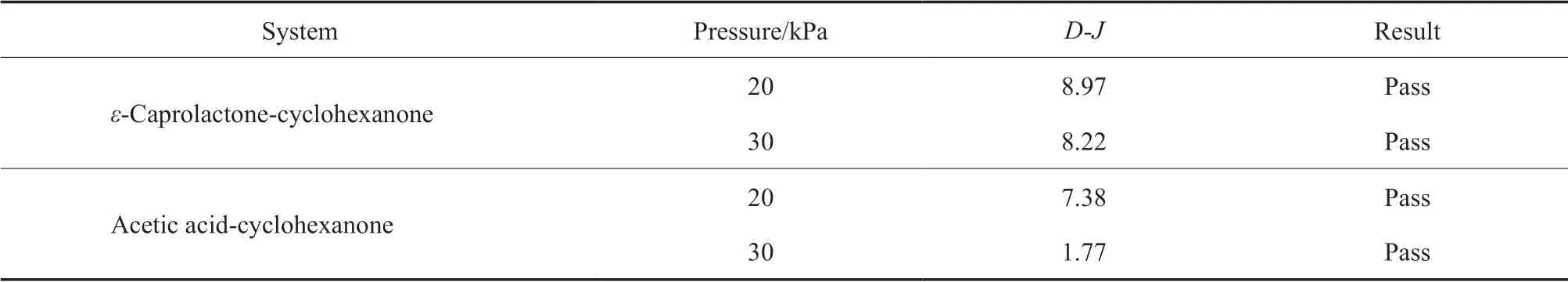
表5 热力学一致性检验结果Table 5 Check results of thermodynamic consistency
2.3 实验数据的关联
实验测定了乙酸-环己酮、ε-己内酯-环己酮二元体系的气液平衡数据,采用活度系数法中的Wilson和NRTL热力学模型[15]关联,关联后得到的各体系各压力下的二元交互参数如表6和表7所示。由表6和表7可知,Wilson和NRTL模型均能良好地应用于这两组二元体系的气液平衡计算,对于乙酸-环己酮体系,在20 kPa和30 kPa下气相组成的实验值与估算值最大标准差为0.001 1,但平衡温度的标准差最大达到了1.46,偏差略大。实验过程中当乙酸含量较高时,因为乙酸的凝点高,实验装置对于乙酸的冷凝循环具有一定困难,可能造成系统误差。对于ε-己内酯-环己酮体系,在20 kPa和30 kPa下气相组成的最大标准差为0.001 1,平衡温度的标准差最大为2.38。由于ε-己内酯的沸点很高,在体系中ε-己内酯浓度较高时,测量过程中需要对气液平衡釜外部保温,难以避免内外温差导致的平衡点偏差,从而造成温度偏差。

表6 乙酸-环己酮体系的二元交互参数与偏差Table 6 Binary interaction parameters and deviations for acetic acid-cyclohexanone system

表7 ε-己内酯-环己酮体系的二元交互参数与偏差Table 7 Binary interaction parameters and deviations for ε-caprolactone-cyclohexanone system
2.4 气液平衡T-x-y相图
图2为乙酸-环己酮、ε-己内酯-环己酮二元体系的气液平衡数据的T-x-y相图。
由图2可知,在乙酸-环己酮体系中,乙酸沸点较低,随着温度的升高环己酮的含量逐渐增大;值得注意的是,对于ε-己内酯-环己酮体系,当体系温度较低时,ε-己内酯含量变化不明显,而在体系温度临近最高点时,ε-己内酯含量快速上升,靠近温度最高点和最低点时组分含量对温度变化非常敏感。

图2 二元体系的T-x1-y1相图Fig.2 The T-x1-y1 phase diagram of the binary system.
3 结论
1)分别测定了20 kPa和30 kPa下,ε-己内酯-环己酮、乙酸-环己酮二元体系的气液平衡数据,并采用Herington面积积分法对其进行热力学一致性检验,两组数据均符合热力学一致性。
2)采用Wilson和NRTL活度系数模型对各体系、各压力下的实验数据进行关联,回归得到相应的二元交互参数,经比较可知气相摩尔分数的计算值与实验值吻合,平衡温度偏差略大。回归得到的二元交互参数可以对环己酮催化合成ε-己内酯反应中的物料分离设计提供参考,为工业生产提供数据支持。
